

又一个WordPress站点


关键词:二叶式主动脉瓣


发表期刊:Journal Of Cardiac Surgery
文章作者:Michel Pompeu Sá MD, MSc, MHBA, PhD, FACC / Jef Van Den Eynde BSc
文章来源:
https://doi.org/10.1111/jocs.17185
2022.11.15
摘要:
在过去十年中,免缝合瓣膜(Perceval™)作为支架瓣膜的替代品推向市场,用于主动脉瓣置换(SAVR)的患者。然而,Perceval™需要特定的植入步骤,我们可以对手术团队成员培训。保留胸骨的心脏手术目的在于减少手术创伤,但技术要求和术前计划比常规胸骨切开术更具挑战性。SAVR通常通过上半胸骨切开术进行,而右胸前外侧切口(RAT)代表了一种创伤更小的先进技术。在这种背景下,RAT与Perceval™是完美的结合。在患有二叶化主动脉瓣(BAV)的患者中,一些手术医生最初放弃了Perceval™瓣膜,但随着临床经验的增加,Perceval™瓣膜已经用于多种适应症。根据最近发表的一项国际共识声明,BAV有3种类型:融合型BAV、两窦型BAV和部分融合型BAV,每种都具有特定的形态分型。两窦型BAV有2个瓣尖,大小和形状大致相同,每个瓣尖占环形周长180°,只有2个主动脉窦,无脊,两个瓣叶对称分布,连合部的角度为180°,由于BAV患者的椭圆形主动脉瓣环对免缝合瓣膜构成了挑战,且微创SAVR越来越多地采用RAT入路,因此我们对手术技术的描述侧重于两窦型BAV的左右分部型情况下的具体手术细节。
1|介 绍
二叶主动脉瓣(BAV)是最常见的先天性心脏瓣膜疾病,其负担广泛,导致严重主动脉瓣狭(AS)或严重主动脉瓣反流(AR)。随着对无症状患者的超声心动图监测及多模式影像技术的发杂,最近对BAV疾病的认识更加细化。
在严重AS并采取外科主动脉瓣置换术(SAVR)的患者中,胸骨保留方法(如右前胸廓切开术,RAT)被认为是SAVR的微创方法,在这种情况下,RAT与Perceval™是完美的结合。在BAV患者中,一些外科医生最初放弃了Perceval™瓣膜,但随着经验的增长,Perceval™瓣膜已经用于多种适应症。根据最近发表的《国际共识》关于先天性二叶主动脉瓣及其主动脉病的命名和分类的声明,用于临床、外科、介入和研究,有三种BAV类型:融合型BAV、两窦型BAV和部分融合型BAV,每种都具有特定的形态分型。本共识声明描述了以下内容两窦型BAV(图1):“两窦型不常见,约占病例的5-7%。与融合型相比,两窦型BAV的出现并不表明3个瓣尖中的2个已经融合;相反,它表明只有2个主动脉窦内形成了2个瓣尖,大小和形状大致相等,每个瓣尖占环形周长的180°,导致2窦/2尖瓣(图1),无中缝,180°连合角。通常很难确定哪两个瓣尖可能合并形成一个窦,但通常很明显的是,在心脏平面的短轴基部内,瓣尖是左右分部还是前后分部;因此,这是两窦型BAV类别的2种特定分型。两窦型BAV左右分部型侧方各有一条冠状动脉而前后分布型可能有一条冠状动脉从每个尖点或两条冠状动脉从前尖点开始。”由于BAV患者的椭圆形主动脉瓣环构成对于免缝合瓣膜采用RAT入路的挑战越来越多地用于微创SAVR,我们对手术技术的描述侧重于该场景中的具体手术细节。
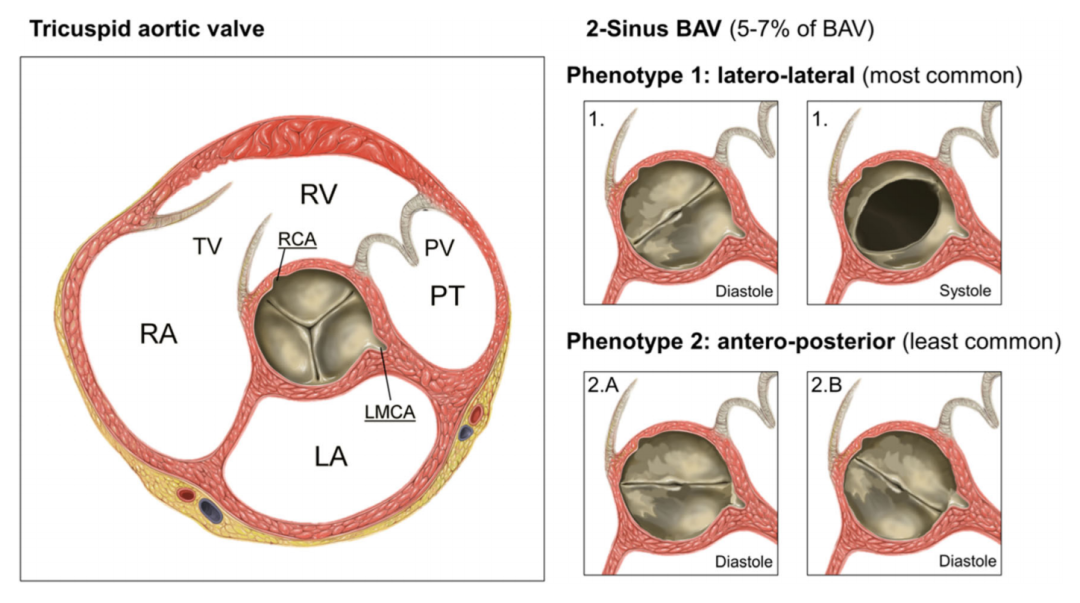
图1:图1比较三叶主动脉瓣和二尖叶主动脉瓣。LA:左心房;LMCA:左冠状动脉主干;PT:肺动脉干;PV:肺动脉瓣;RA:右心房;RV:右心室;TV:三尖瓣。
2|分步描述
2.1 | 患者定位和麻醉药
麻醉诱导后,将患者置于仰卧位,用双腔气管插管,单左肺呼气末正压(PEEP)通气改善了主动脉阻断。
2.2 | 胸廓切开术和切口
做4-5cm RAT 入路,以通过第三肋间间隙进入胸部(图2A)。放置牵开器(图2B),分层解剖组织,夹住右胸廓内动脉和静脉(图2C)。我们进行肋骨横断(图2D、E)。带伤口保护器的肋骨扩张器(图2F)提供额外的显露术野。
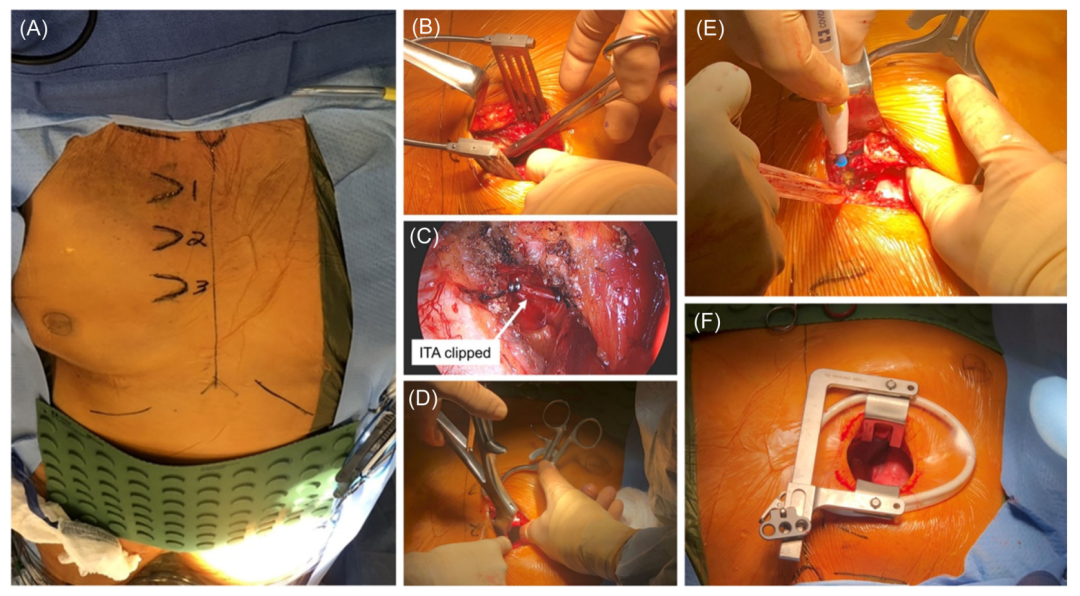
图2:右前胸廓切开术的入路准备。(A)参考标记的投影;(B)软组织牵开器和解剖各层;(C)夹闭胸内动脉(ITA);(D)肋骨横断;(E)肋骨横断后显露;(F)带切口保护的肋骨扩张器。
2.3 | 胸腔内显露
心包在主动脉上方打开(图3A,B),切口向下延伸至下腔静脉。放置心后撑条缝合线对于充分显露主动脉和主动脉瓣至关重要。这些缝合线被拉伸并固定通过将它们缝合到皮下组织(图3A)。
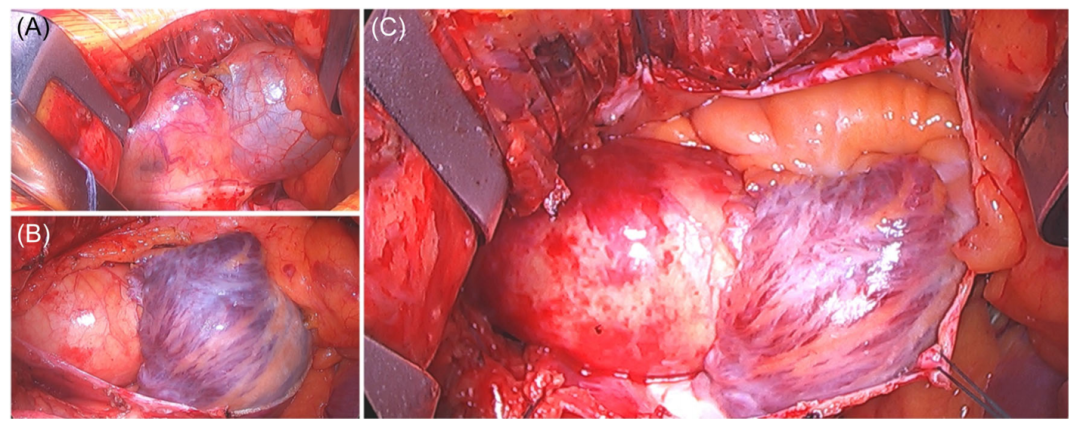
图3:经心包进入心脏。(A)闭合心包;(B)心包开放;(C)缝合固定心包以更好地暴露。
2.4 | 置管和体外循环
对于动脉置管,插入套管之前进行椭圆形纵向荷包缝合(图4A)。套管在经食道超声心动图引导下放置在上腔静脉(图4B,C)和腹主动脉(图4D)中。通过右股动脉和右股总静脉插管建立体外循环(图4E,F)。通常,根据患者动脉直径的大小,16 FR或18 FR动脉插管就足够了。必要时,通过真空辅助加强静脉引流,减轻右心减压,体温保持在34°C左右。
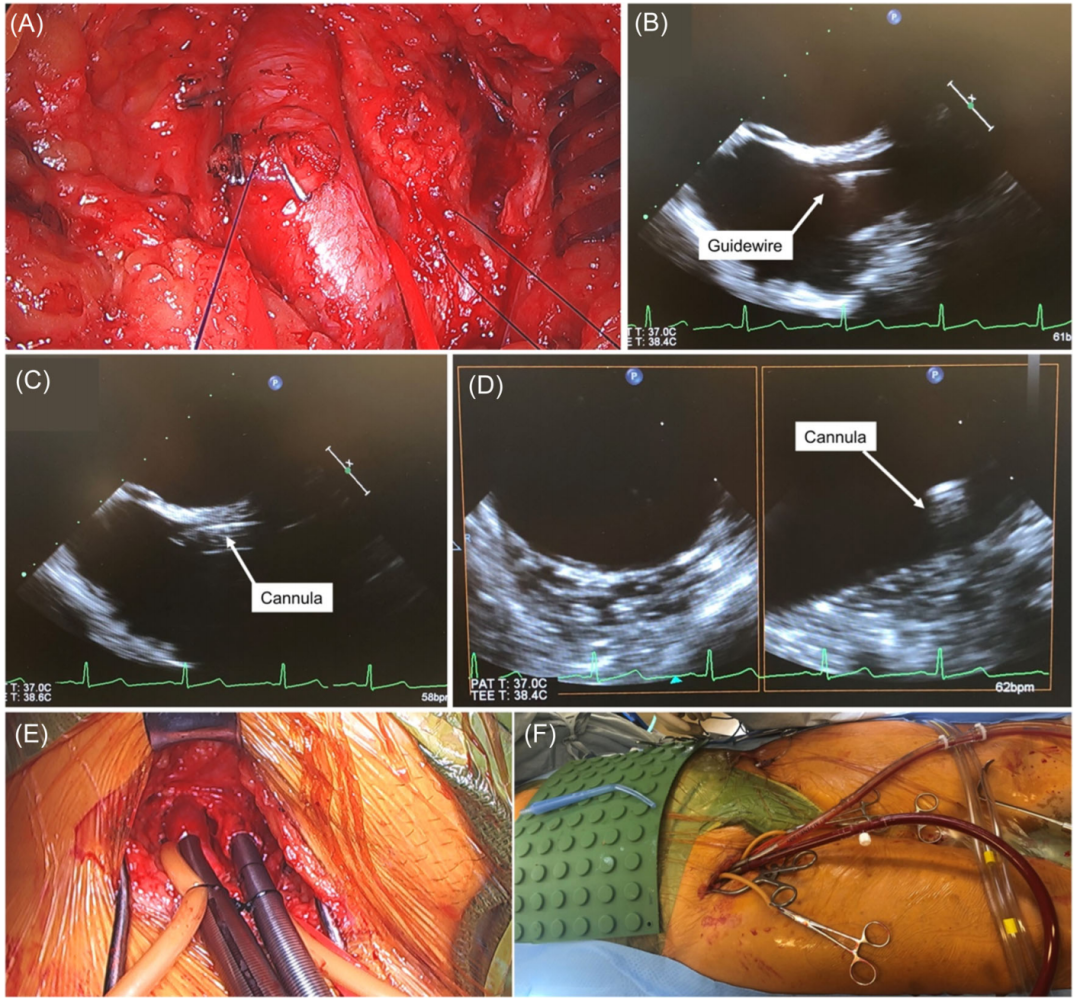
图4:体外循环置管。(A)股动脉内的荷包缝合;(B)下腔静脉导丝;(C)下腔静脉置管;(D)经食管超声心动图下置于腹主动脉的动脉插管监测;(E、F)通过右股总动脉和右股总静脉插管建立的体外循环。
2.5 | 主动脉阻断和心脏停搏
顺行心脏停搏液(在我们的情况下,我们通常更喜欢Del Nido心脏停搏溶液)通过长针直接输送到主动脉根部(图5A),或在主动脉瓣关闭不全的情况下直接输送到冠状动脉口,如有必要,重复输送。经胸外主动脉交叉钳CYGNET®(图5B)可实现隧道和精确钳位安置一旦正确定位,刚性轴缩回柔性颈部(图5C),可操纵至远程位置(图5D)。
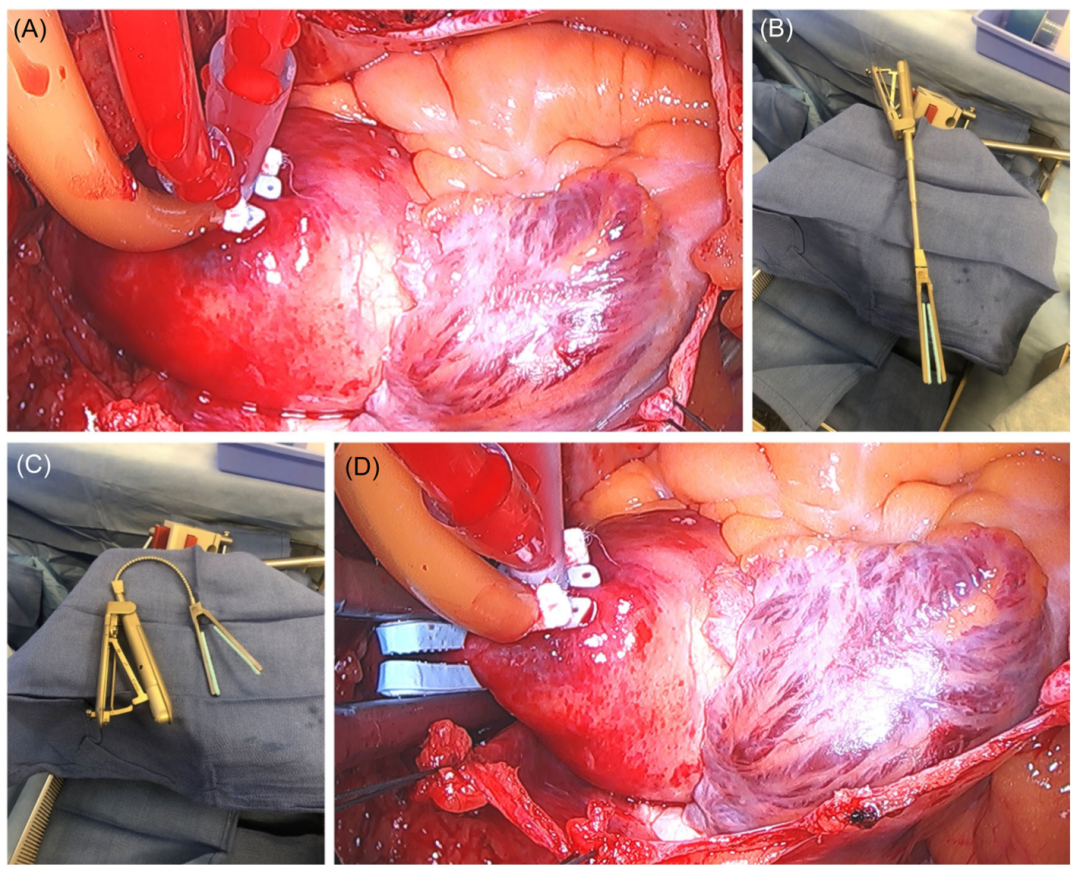
图5:心脏停搏和主动脉夹闭。(A)主动脉阻断后,顺行心脏停搏液将通过长针直接输送至主动脉根部;(B)经胸外主动脉阻断;(C)刚性轴缩回,留下柔性颈部;(D) 交叉夹紧的主动脉,然后给予心脏停搏液。
2.6 | 主动脉瓣显露、瓣膜清理和钙化清除
窦管连接处上方1-2 cm处的横向主动脉切开(略高于传统支架瓣膜的SAVR)因为Perceval免缝合瓣膜的镍钛诺支架其流出部分可能会干扰主动脉切开术或被缝合线夹住,低的切口点的一个很好的参考点是心外膜脂肪褶皱。不必过度扩展切口,然而,主动脉切口的扩展也可以基于手术医生偏爱,由于压缩的Perceval瓣膜需要有限的空间,4–5cm的主动脉切切口足以引入最大的瓣膜。为了改善瓣膜的显露,我们在主动脉壁使用定位线(图6A)。瓣叶切除和瓣环钙化清除(图6B)与传统SAVR技术相似。建议对主动脉环进行彻底钙化清除避免瓣周漏,这是一个不可忽略的技术,确保假体近端完全展开。偏心/粗大突出的钙化必须清除以避免损影响瓣膜膨胀。左心室流出道(LVOT)瓣环下方大量钙化也应清理,因为它可能阻止支架的流入部分,特别是如果其位于非冠血管。
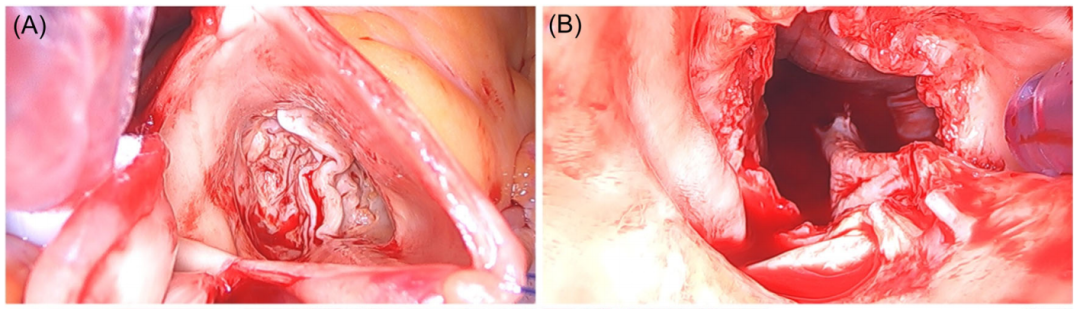
图6:(A)二叶主动脉瓣显露;(B) 瓣叶切除和瓣环钙化清理。
2.7 | 引导缝线在BAV中valsalva窦的再分布
在三尖主动脉瓣中,手术医生在每个瓣膜窦的引导线缝合线呈120°分布,然而两窦型BAV左右分部型只有两个窦,每个窦180°的分布。在这种情况下,外科医生必须重新分配两窦形成三个120°分布(图6C),确保两个冠状动脉口不会阻塞。引导缝线必须放置,并且在假体植入充分保持张力,因为引导线的正确位置是对于假体的正确定位至关重要。这个引导缝线位置末端是LVOT也是假体的深度。因此,引导缝合线应在左心室流出道入针(主动脉瓣环下方)并于主动脉环上方出针。
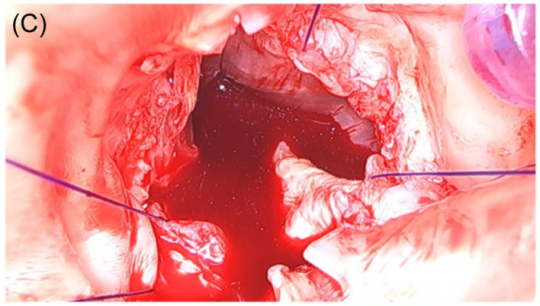
图6:(C)创建再分配三个以120°分布的点。
2.8 | 瓣膜假体大小选择
与传统的支架瓣膜固定的尺寸不同,Perceval瓣膜在型号上会更适应患者真实的瓣环情况。因此,Perceval瓣膜尺寸的选择策略将与传统支架瓣膜不同。
Perceval 有S、M、L和XL四种尺码。手术医生必须确保测瓣器在主动脉瓣环处与主动脉成90°角(图6D)。最初使用S尺码测量,分别使用测瓣器两端测量,如果两端都没有阻力,手术医生应该选择下一个大小。对感到白色测瓣器阻力是正确的尺寸。手术医生可以感到透明的测瓣器容易主动脉环进入左心室(LV),而白色测瓣器在主动脉环上方保持稳定(图6E、F显示了错误的情况)。
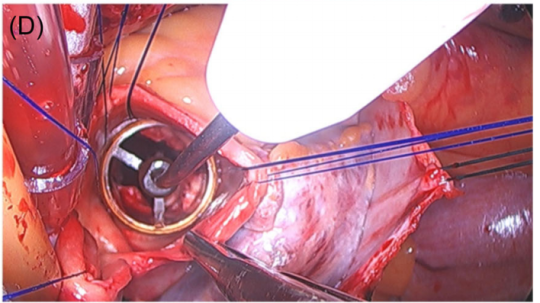
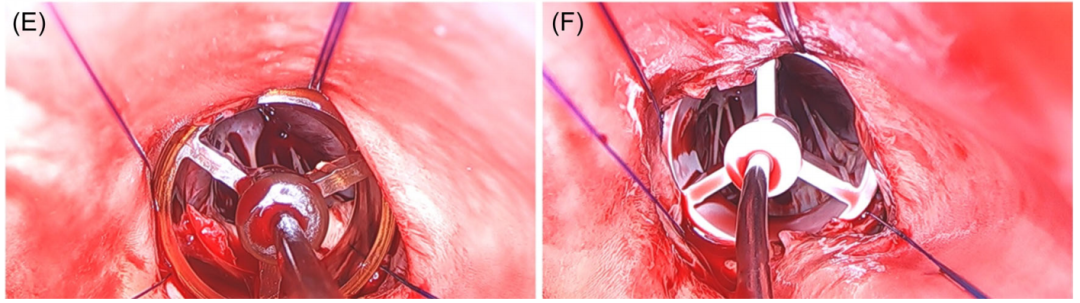
图6:(D)测瓣器与主动脉环成90°角;(E)环上方的透明测瓣器(注意:位置错误!);(F) 环下方的白色测瓣器(注意:位置错误!)。
2.9 | Perceval免缝合瓣膜的植入准备:压瓣步骤
在此阶段,主刀医生(或助手)应遵循以下步骤:
1. 选择符合所选瓣膜假体尺寸的压瓣器(图7A);
2.选择与瓣膜假体符合的植入持瓣手柄;
3.将护套向后拉向把手方向;
4.顺时针转动旋钮解锁直到停止;
5.通过凹槽对齐将压瓣器在底座上固定,持瓣手柄对齐支架上的槽口;
6. 持瓣手柄的位置必须使其标志指向向上并安装在稳定位置;
7.瓣膜的位置必须确保换上黑色结构指向上方;
8.将瓣膜假体通过流入部分(心包部)对齐并将其插入压瓣膜器;
9.推动时检查瓣膜小叶,确保可以从持瓣手柄尖端穿过;
10轻轻推动流出环,检查瓣膜位置;
11.转动压瓣器的杠杆,直到流入和流出瓣环压缩(图7B);
12.检查瓣环支架是否均匀压缩,并且确保没有重叠压缩。将持瓣手柄操纵杆保持在关闭位置并固定位置,滑动护套,直到其覆盖压缩的流出环;
13.将Smart Clip夹置于护套和手柄之间如图7C所示,轻轻按下Smart Clip夹,直到它完全插入插槽;
14.逆时针转动旋钮直到停止;
15.不要松开底座,以确保流入环夹紧;
16.将操纵杆转到打开位置,松开压瓣器;Smart Clip夹将自动推动护套向前以完全覆盖假体的流出环;
17.在拉动持瓣手柄之前完全打开压瓣器(图7D)。

图7:准备Perceval植入,压瓣的步骤。(A) 符合假体尺寸的两用压瓣器;(B) 旋动两用压瓣器的杠杆,直到瓣膜的流入环和流出环折叠;(C) 将Smart Clip夹置于护套和手柄之间;(D) 压缩完成准备植入。
2.10 | 主动脉瓣置换术,Perceval展开
在瓣膜假体展开过程中,必须同样的张力拉动所有三条引导缝线(图8A),避免拉升瓣环平面。检查主动脉瓣环内压缩瓣膜假体的适当位置至关重要。这可以通过显露主动脉瓣环,在支架上施加一定的侧牵引力,并显露缝合线和绿色孔眼来实现。手术医生必须评估瓣膜从左、右和非冠状窦对齐。由于非冠状动脉尖点的最低点较低,应将支架拉向手术医生方向,以确保假体在环形平面上正确位置(图8B),并防止瓣旁反流。然后,手术医生必须顺时针旋转支架顶部的旋钮,直到听到咔嗒声。在此过程中,支架必须保持与环形平面垂直。现在可以拆下Smart Clip夹,并且必须向后拉支架的滑动护套。取出支架后,瓣膜将被释放。假体展开完成后,必须将支架从左心室流出道移除。
球囊扩张(图8C)通过径向扩张流入支架来修复主动脉环。
球囊必须根据瓣膜展开和插入的假体的尺寸进行选择,蓝色标记与瓣叶的自由边缘对齐,保持轴与主动脉瓣环平面垂直。球囊必须充气至4大气压,并保持30秒。关键步骤是在球囊充气时将温热的无菌盐水(约37°C)倒入主动脉根部,以确保最佳的瓣膜密封和固定到主动脉环上。由于Perceval支架由镍钛诺是一种热敏材料,支架在低温下不会充分膨胀。在此之后,完全放气后可移除球囊,并移除引导缝线(图8D)。
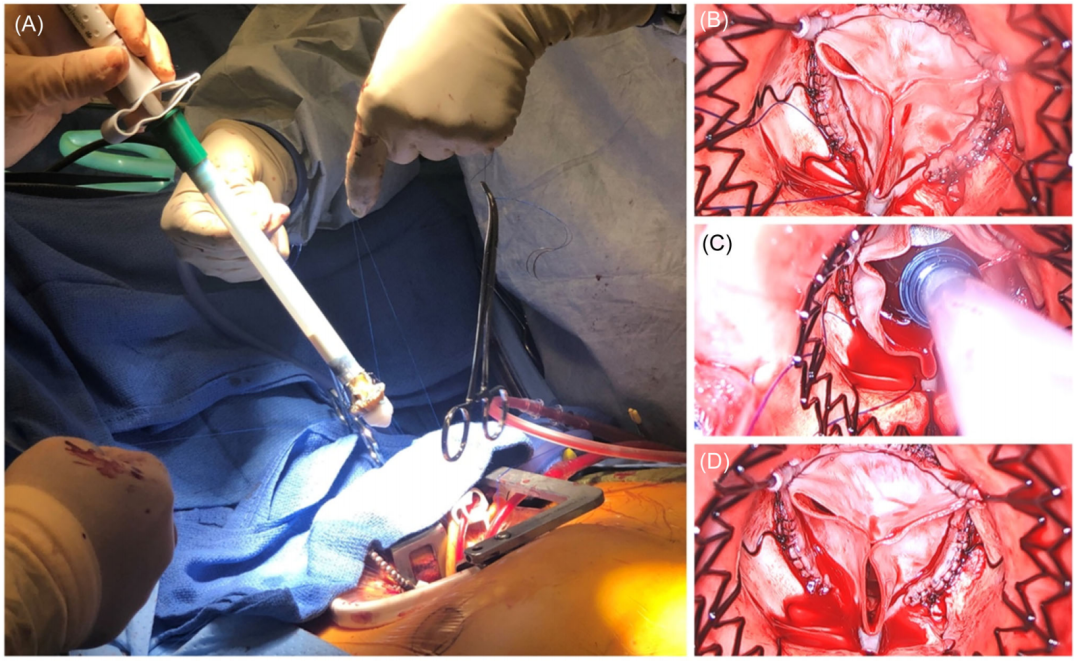
图8:Perceval植入置换瓣膜到胸部关闭。(A)所有三条引导缝线都以相同的张力拉动;(B)假体在瓣环平面上的正确就位;(C)球囊扩张;(D)扩张后移除引导缝线。
2.11 | 主动脉切开术关闭、排气和胸腔关闭
在主动脉切口闭合期间(图8E),手术医生必须检查支架远端流出冠和主动脉边缘之间的空间,以免在缝合时卡住支架。否则,这会导致人工瓣膜移位到主动脉根部。置管和体外循环期间心脏保持减压时,固定心外膜起搏导线。在经食管超声心动图下,通过主动脉切口进行顺行排气,无需直接操作心脏(图8F)。从CPB中断,如在常规SAVR中一样进行静脉插管、拔管和施用鱼精蛋白以逆转抗凝。胸引流管放置在后胸膜腔。部分关闭心包以限制心脏与肺的粘连。肋骨骨折可通过螺钉及接骨板固定(图8G)。RAT切口以常规方式闭合(图8H)。
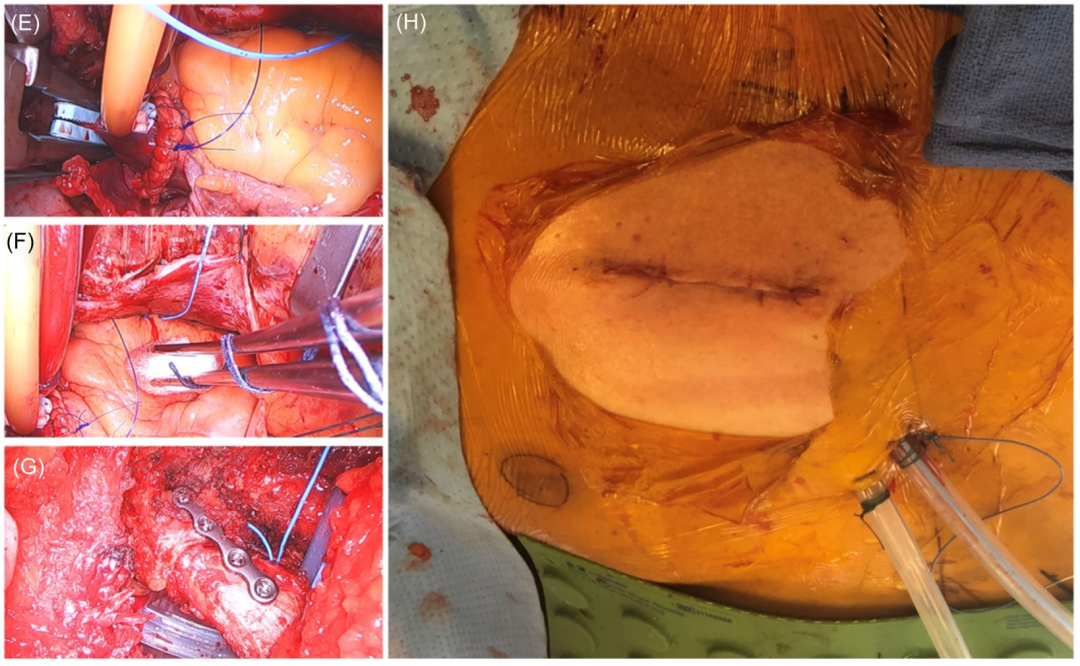
图8:(E)主动脉切开术区关闭;(F)排气;(G)肋骨骨折由螺钉固定的钢板固定;(H)最终皮肤切口闭合。
2.12 | 术后影像学和心电图
Perceval植入经食管超声心动图是质量评估的重要步骤。最好在植入前(图9A)和植入后(图9B,C)进行超声心动图对照,以确认适当的定位并评估心脏跳动时的瓣膜假体血流动力学。在脱瓣后立即检查瓣周漏是至关重要的,因为当患者处于仍在体外循环中。大小正确且位置正确的Perceval不应出现轻度反流。如果检测到轻微(或更大)瓣周漏,则必须进行彻底评估,以评估假体移位或折叠的存在。除术中超声心动图外,建议出院前进行经胸超声心动图评估。评估房室传导阻滞风险也同样重要,关注在瓣膜植入后新的心电图异常,以确保患者在出院前不需要永久性起搏器植入(图9D)。
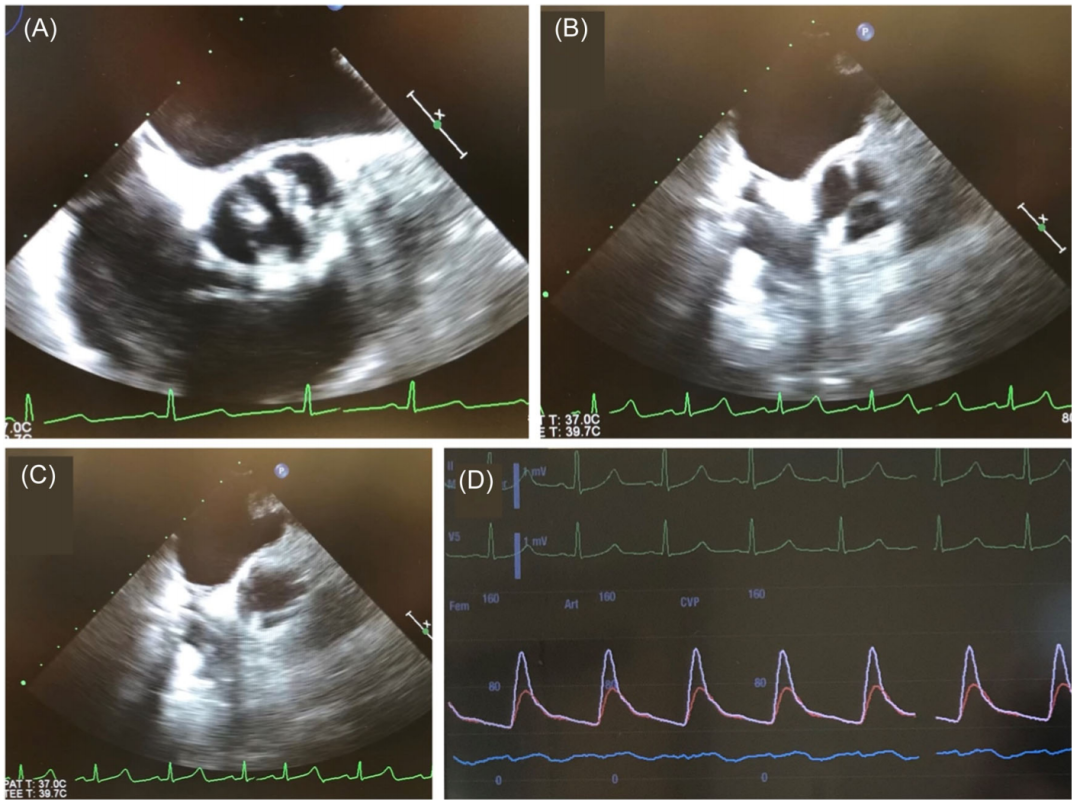
图9:植入Perceval后的影像学和心电图。(A)两窦型二叶主动脉瓣左右分布型;(B)Perceval瓣膜关闭;(C)Perceval瓣膜打开;(D)心电图显示无房室传导阻滞。
3|总结
在两窦BAV左右分部型患者中将SAVR与RAT和Perceval结合时,有几个实际意义:
1.在术前规划中应考虑手术学习曲线、手术的复杂性以及解剖结构及其形态学的识别,然而,如其他组所述,这些方面都不应阻止心脏外科医生采用胸骨保留技术来改善对患者的治疗。
2. SAVR采用RAT入路的优点可以是早期行走活动和优越的胸壁稳定性。
3.作为胸骨保留手术的RAT方法减少了出血的可能性以及输血的需要,并消除了灾难性胸骨深部伤口感染的风险。
4、患者具有两窦型BAV左右分部型和椭圆环的AS,这一事实不应被视为拒绝使用Perceval免缝合瓣膜的理由。
关于CORCYM恪心医疗
CORCYM是一家跨国医疗设备公司,全心专注于先进的结构性心脏病外科手术解决方案。CORCYM在100多个国家开展业务,拥有约850名员工,确保为世界各地的患者、医疗专业人士和医疗系统提供强有力的持续支持。如需了解更多信息,请访问www.corcym.com



关键词:小瓣环

Aortic valve replacement in elderly with small aortic root and low body surface area; the Perceval S valve and its impact in effective orifice area
作者: Panagiotis Dedeilias , Nikolaos G Baikoussis , Efstathia Prappa , Dimitrios Asvestas , Michalis Argiriou , Christos Charitos
DOI: 10.1186/s13019-016-0438-7
关键词: 主动脉瓣;主动脉瓣狭窄;心脏瓣膜手术;Perceval;自膨胀瓣膜;无支架主动脉瓣;免缝合瓣膜
背景
本研究的目的是观察免缝合无支架Perceval S型主动脉瓣在小主动脉根部的老年患者中的表现,并与另一组具有相似特征植入传统支架生物瓣的患者进行比较。本研究为前瞻性随机对照研究
方法
我们的材料来自25例接受免缝合自锚定Perceval S瓣膜置换术的患者,并与25例接受传统支架生物瓣膜植入的患者进行比较。两组患者具有相似的人口统计学和医学特征,均患有重度主动脉瓣狭窄。研究时间为2012年1月至2014年6月。通过对术前、术中及术后各项指标的分析,探讨Perceval S瓣膜在本组患者中的应用价值。
结果:与传统生物瓣膜相比,Perceval S瓣膜具有良好的血流动力学特性,缺血时间更短(40±5.50 min vs 86±15.86 min;P < 0.001),体外循环时间更短(73.75±8.12 min vs 120.36±28.31 min, P < 0.001),手术时间更短(149.38±15.22 min vs 206.64±42.85 min;P < 0.001),术后恢复较好。术后跨瓣压差分别为(23.5±19.20)mmHg和(24.5±19.90)mmHg。两组的术后有效开口面积分别为1.5 =/-0.19 cm(2)和1.1=/-0.5 cm(2) (p 0.002)。在25例植入Soprano支架瓣膜的患者中,3例(12%)患者在6个月内再次出现(NYHA)心功能分级3级。人工瓣膜-患者不匹配(PPM)是这些患者再次入院的原因,需要利尿和补充治疗。
结论
Perceval主动脉瓣置换术治疗高龄合并小瓣环患者,更加安全和快捷,提供了更大的有效瓣口面积,短期、中期效果良好。
关于CORCYM恪心医疗
Corcym是一家全球性医疗设备公司,完全专注于提供最先进的手术解决方案来对抗结构性心脏病。Corcym在100多个国家/地区开展业务,拥有约900名员工,确保为全球患者、医疗保健专业人员和医疗保健系统提供强有力的持续支持。欲了解更多信息,请访问www.corcym.com



关键词:瓣中瓣

Valve-in-valve transcatheter aortic valve replacement for the degenerated rapid deployment PercevalTM prosthesis: technical considerations
作者:
Christophe Dubois1,2^, Lennert Minten1,2, Marie Lamberigts1, Pierluigi Lesizza2, Steven Jacobs1,3, Tom Adriaenssens1,2, Peter Verbrugghe1,3, Bart Meuris1,3
1Department of Cardiovascular Sciences, Katholieke Universiteit Leuven, Leuven, Belgium; 2Department of Cardiovascular Medicine, University Hospitals Leuven (UZ Leuven), Leuven, Belgium; 3Department of Cardiac Surgery, University Hospitals Leuven (UZ Leuven), Leuven, Belgium
期刊: Journal of visualized surgery
DOI: doi: 10.21037/jovs-23-28
摘要
快速部署主动脉瓣假体或“免缝合瓣膜”(SV)具有良好的血流动力学和临床安全性,但对导致瓣膜功能障碍的结构性瓣膜变性(SVD)仍然敏感。 对于 SVD 患者,瓣中瓣经导管主动脉瓣置换术 (ViV TAVR) 因为其手术成功率高,且在老年人群中存在再次手术的固有风险,已成为首选方法。 然而,需要仔细考虑手术假体的解剖特征及瓣膜特性来评估瓣中瓣手术的可行性,包括避免冠状动脉阻塞、瓣膜错位和较高的跨瓣压差。我们系统地描述了经导管治疗衰败的 Perceval™ SV免缝合生物瓣膜 的技术考虑因素。通过设计,Perceval™ 有潜力成为经导管瓣中瓣手术的理想对接站,提供清晰可见的不透射线框架、圆周扩张能力以及降低冠状动脉阻塞和瓣窦隔离的风险。我们展示了手术的要诀和技巧,并提供我们自己的案例经验。在一系列 784 个 Perceval™ 的患者中,每名患者(15 名患者)每年的严重 SVD 发生率为 0.54%,其中只有 9 名患者计划接受 ViV 瓣中瓣TAVR 治疗并取得成功。 治疗使所有患者的临床症状得到改善,跨瓣压差显着降低,并且没有残留主动脉瓣反流
关键词: Valve-in-valve瓣中瓣 (ViV); structural valve degeneration结构性瓣膜衰败 (SVD); Perceval™
手术要诀和技巧
瓣中瓣ViV TAVR 在 Perceval™中的手术成功主要取决于细致的术前检查。 一旦选择了合适的瓣膜和尺寸,植入手术本身是简单的,手术时间短,造影剂的使用也有限。 逆行钢丝穿过时应小心,避免缠绕或 Perceval™ 支架外形成“fausse route”,特别是对于窦管交界处较宽的患者。 在这些患者中,Perceval™ 的流出道通常不贴在主动脉壁上,为交叉线留下空间。 如有疑问,应在多次透视投影中检查导丝轨迹,并确认更换导丝期间尾纤导管的自由运动。
与其他 ViV 手术一样,我们通常不建议对退化的生物瓣膜进行球囊预扩张,因为这可能会增加中风和严重瓣膜反流的风险。 然而,如果在术前 CT 上观察到严重钙化,则可能需要进行预扩张,特别是为了避免自扩张瓣膜严重扩张不足。 在这种情况下,THV应提前做好准备,准备好抢救灾难性的急性主动脉瓣反流。
瓣膜定位完全由 Perceval™ 上重要的不透射线标志引导。 这里的黄金法则是衰败的瓣膜和新植入的瓣膜流入环正确对齐。 对于具有从下到上膨胀的自膨胀瓣膜,例如 Evolut™ 或 Portico™,可以在渐进式瓣膜部署过程中瞄准和调整两个流入环的完美重叠(图 4,左)。 当使用球囊扩张 Sapien 3™ 瓣膜时,应考虑流入侧瓣膜框架的缩短。 因此,未扩张的 Sapien™ 的流入环一侧通常伸入左心室流出道,而流出侧则与 Perceval™ 的柱锥体对齐。 这种定位考虑了瓣膜在扩张过程中的缩短,并允许在完全扩张时两个瓣膜框架完美对齐(图4,右)。 视频 1,2 中介绍了 具有代表性的在Perceval™中 植入Evolut™ 和 Sapien™ 的手术步骤。
案例经验
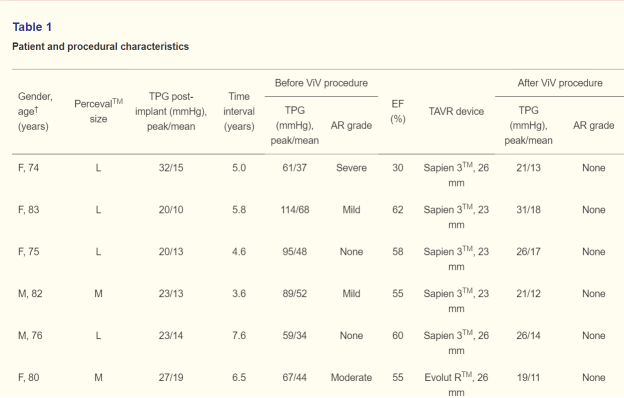
Perceval™ 的多功能性有利于该瓣膜在各种临床情况下的使用,尤其是老年患者。 根据我们的经验,尽管接受治疗的人群处于中等风险状况,但长期临床结果良好,每位患者每年的心内膜炎发生率为 0.46%,严重 SVD 发生率为 0.54%(784 例植入中的 15 名患者)(5)。在这 15 名单纯 SVD 患者中,只有 9 名安排并接受了成功的 ViV瓣中瓣TAVR 经导管置换手术。
患者和手术特征如表 1 所示。大多数患者在我们于 2017 年调整尺寸策略之前接受了 Perceval™ (6),并且没有人接受 Perceval Plus™ 治疗,因为这种带有FREE组织治疗的瓣膜仅在2020年实际使用(4)。 没有患者接受衰败 Perceval™ 的预扩张。 仅接受 Evolut™ 治疗的患者进行了后扩张,其中一名患者明显扩张不足,而另一名患者的峰值跨瓣压差较高(45 mmHg)。
在这些患者中,后扩张导致残余峰值跨瓣压差分别为 2 和 20 mmHg。 表 1 中的患者目前正在 THV-in-SV 后 1 个月和 6 个月以及每年进行一系列临床和超声心动图随访,所有患者均表现出与术后即刻结果相似的跨瓣压差,并且没有或有轻微主动脉瓣反流。 迄今为止最长的随访时间是瓣中瓣ViV手术后 3 年。
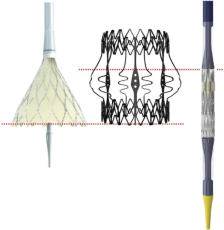
图4,部署过程中THV的对齐。对于Evolut™和Portico™,在展开过程中,Perceval™和经导管瓣膜的流入环应对齐(左)。对于Sapien 3™,在瓣膜扩张之前,应将瓣膜的流出道对准Perceval™的支柱。现阶段Sapien™的流入环仍突出于左心室流出道,并随着瓣膜展开而缩短。当达到最大瓣膜膨胀时,两个流入环将对齐。THV,经导管心脏瓣膜。

结论
虽然结构性瓣膜衰败(SVD) 在接受免缝合生物瓣膜 (SV) 植入的大量患者数据中很少见,但 Perceval™ 似乎非常适合接受经导管瓣膜,只要进行仔细的瓣膜选择,就不会影响未来的瓣膜血流动力学和冠状动脉的通畅性。
关于CORCYM恪心医疗
Corcym是一家全球性医疗设备公司,完全专注于提供最先进的手术解决方案来对抗结构性心脏病。Corcym在100多个国家/地区开展业务,拥有约900名员工,确保为全球患者、医疗保健专业人员和医疗保健系统提供强有力的持续支持。欲了解更多信息,请访问www.corcym.com



关键词:感染

病例报告:经导管主动脉瓣置入术后感染性心内膜炎,采用免缝合瓣膜和升主动脉置换术治疗
经导管主动脉瓣置入术后的感染性心内膜炎(TAVI)是心脏外科医生面临的一个日益增加的挑战。接受TAVI手术的患者通常有较高的死亡风险评分并且解剖结构不适合传统的外科手术方法。因此,手术计划是至关重要的,尽管有时术中发现可能是意想不到的和复杂的情况。我们报告一例感染性心内膜炎TAVI患者,其瓷主动脉和“有挑战的”主动脉根手术治疗,采用免缝合瓣膜假体和升主动脉置换术
关键词:心内膜炎, TAVI, 瓷化主动脉, 免缝合瓣膜, 有挑战的主动脉根部
介绍
随着经导管主动脉瓣置入术(TAVI)的日益普及,瓣膜假体的衰败管理将越来越频繁(1)。在长期并发症中,TAVI的感染性心内膜炎(TAVI-IE)对心脏外科医生来说是一个具有挑战性的问题,1年时发生率为0.2%-3.1%(2),导致37.1%的患者心力衰竭(3)。尽管早期手术治疗先天性瓣膜心内膜炎的患者显示出生存优势,人工瓣膜心内膜炎的治疗选择 (药物治疗vs.手术治疗)仍存在争议。此外,考虑到TAVI-IE患者是一个非常高风险的人群,在心脏手术后与单纯药物治疗相比没有明显的获益(4),治疗应根据心内膜炎的严重程度进行个体化,并由专门的团队指导(5)。
尽管选择了这种方法,但TAVI-IE患者的生存率通常很差,其中约四分之一(22%)的患者接受了手术切除瓣膜假体(6)。我们报告了一例手术治疗高危瓷升主动脉患者严重TAVI-IE的病例。
案例描述
一名患有高血压、血脂异常和类风湿性关节炎的81岁女性,在心脏团队评估为胸外科学会(STS)预测死亡风险(PROM)为4.39%的高危患者后,于2020年5月因主动脉瓣狭窄接受了经股动脉TAVI (CoreValve-EvolutePro,23mm,Medtronic,Minneapolis,MN,USA)
2021年11月,患者因疲劳、劳力性呼吸困难、间歇性发热3周入住急诊科,使用经验性抗生素治疗。心电图示窦性心律,70次/分,伴有左心室肥厚特征。血样显示中度白细胞增多,降钙素原1.14μg/L。血培养金黄色葡萄球菌阳性。经胸超声心动图(TTE)和经食管超声心动图(TEE)均显示主动脉假体上有较大的可移动植被和非结构性瓣膜功能障碍(NSVD),平均梯度为54mmHg。
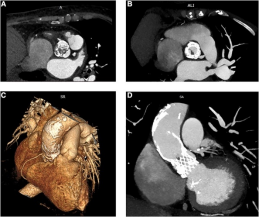
血管CT扫描显示假体左冠状动脉和非冠状动脉尖头之间有血栓形成(图1),并有脾栓塞。在抗生素谱的指导下,开始用抗生素治疗。尽管最初的临床改善,但住院后8天,患者出现发烧复发和初始血流动力学恶化,需要入住重症监护室。尽管患者先前不建议进行手术,但此时TAVI-IE被认为是手术指征,尽管其评分非常高(STS PROM:10.38%)。在完全胸骨切开术后,使用右腋动脉和右心房进行体外循环(CPB)。夹住主动脉(上0区),施行DelNido心脏停博液。通过横主动脉切开术,将假体与原生主动脉瓣一起切除。假体完全被纤维化组织覆盖,同时也检测到心内膜炎的征象。
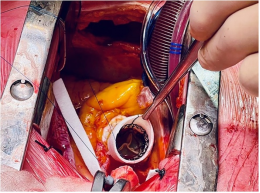
此外,在瓦氏窦的最末端和窦管交界处之间,主动脉管腔由于钙化变狭窄,在这种情况下被描述为主动脉窦管嵴。由于这种具有挑战性的解剖结构,只有Perceval S尺寸适合。此外,考虑到极度钙化的主动脉和冠状动脉开口,选择进行Bentall-DeBono或主动脉根部扩大手术被认为是危险的。因此,首先用24mm Dacron tube代替升主动脉,以便安全部署免缝合瓣膜Perceval S,然后进行充气。此外,主动脉窦管嵴增厚不允许放置用于Perceval部署的三根标准的导引缝线。因此,只使用一根导引缝线将假体降落(图2)。没有使用额外的缝线将瓣膜固定在涤纶移植物上。在TEE监测下,CPB很容易停止,表明假体功能良好。6h后拔管,术后第20天出院。随访15个月,无不良事件发生。随访TTE显示左心室射血分数(LVEF)保存完好,主动脉假体功能良好(平均梯度19mmHg,无反流)。
讨论
本例主动脉环和主动脉根狭窄,钙化程度极度严重。此外,由于TAVI是在1年多前进行的,假体经历了再内皮化,导致主动脉窦管嵴变窄。此外,假体上存在由心内膜炎引起的活动性炎症过程。所有这些方面都使得主动脉根部非常难以处理。在这种情况下,如前所述(10), 免缝合瓣膜可能特别有用,因为在敌对情况下主动脉根部,它避免了缝合线的放置,防止了可能的组织撕裂,省去了更换根部的需要。此外,在心内膜炎的情况下,仅由安装在支架上的小叶制成的假体结构可能有助于减少感染过程。此外,考虑到TAVI应该保留给高危患者,在这个特殊的队列中,显著减少与免缝合瓣膜相关的主动脉阻断时间和体外循环时间是至关重要的。
感染性心内膜炎后使用免缝合瓣膜没有增加瓣膜脱位、瓣周漏、发生三度房室传导阻滞或术后需要永久性起搏器植入的风险(10)。然而,该技术受到小队列患者的限制,并且需要长期随访。
总结
在TAVI-IE合并“有挑战的”(钙化和狭窄)主动脉根的情况下,节段性主动脉置换术和免缝合瓣膜植入术的结合可以避免放置缝合环,避免可能的环撕裂,也避免需要更换主动脉根部。
关于CORCYM恪心医疗
Corcym是一家全球性医疗设备公司,完全专注于提供最先进的手术解决方案来对抗结构性心脏病。Corcym在100多个国家/地区开展业务,拥有约850名员工,确保为全球患者、医疗保健专业人员和医疗保健系统提供强有力的持续支持。欲了解更多信息,请访问www.corcym.com



关键词:联合手术

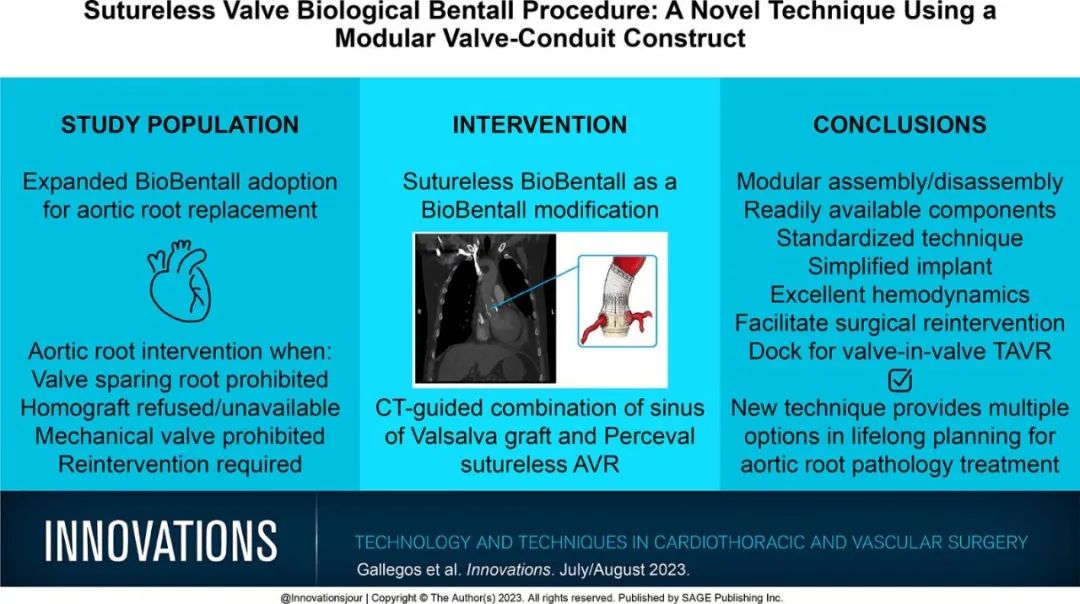
Sutureless Bio-Bentall免缝合生物瓣带瓣血管置换术:一种创建模块化瓣膜-管道结构的新技术
摘要:
Perceval免缝合生物瓣膜(Corcym, Saluggia, Italy)是外科医生治疗退行性主动脉瓣狭窄的有效方法。简化的真正免缝合植入技术已被证明对微创术式有帮助,但将Perceval作为更复杂的根部置换的一部分,以前尚未有报道。我们提出了一种新的技术:改进的人造生物Bentall,称为免缝合生物Bentall。该技术实现了真正的模块化瓣膜-管道结构,简化了未来的再次干预。
关于CORCYM恪心医疗
Corcym是一家全球性医疗设备公司,完全专注于提供最先进的手术解决方案来对抗结构性心脏病。Corcym在100多个国家/地区开展业务,拥有约850名员工,确保为全球患者、医疗保健专业人员和医疗保健系统提供强有力的持续支持。欲了解更多信息,请访问www.corcym.com



关键词:与TAVI对比

摘要:
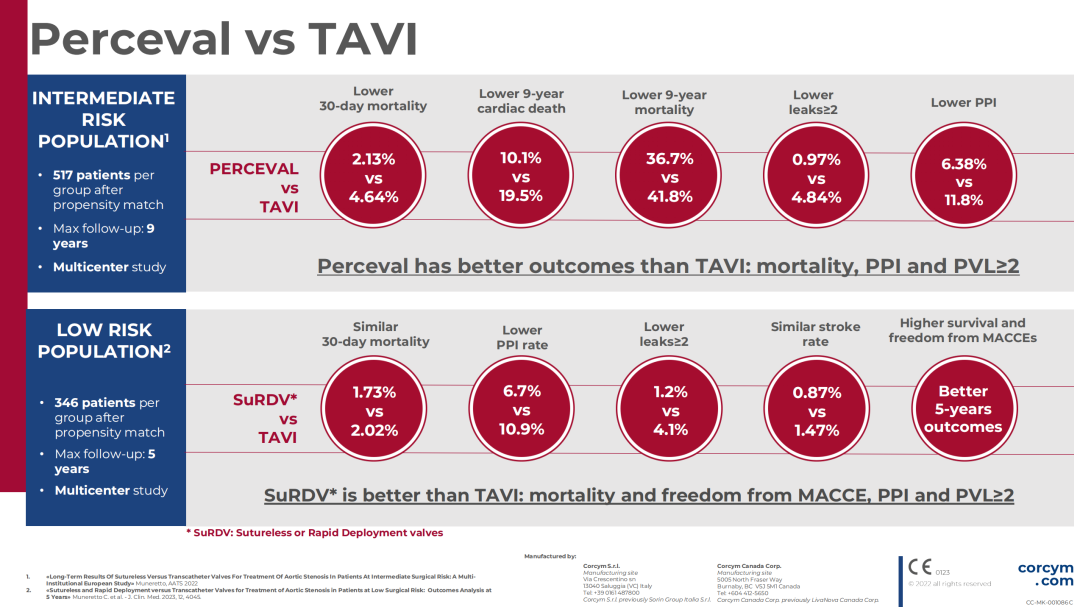
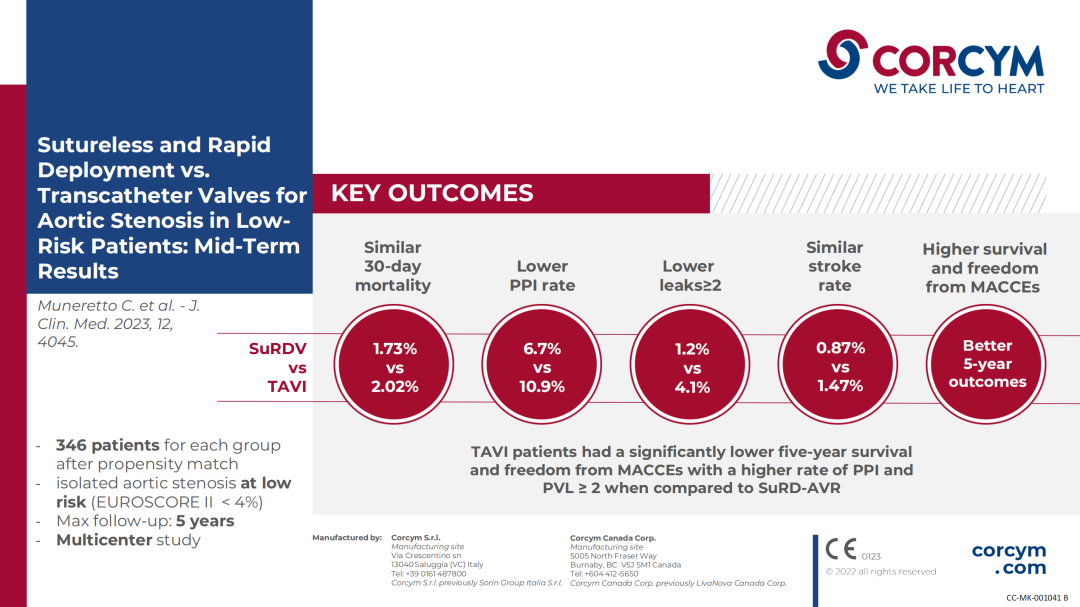
背景:最近的试验表明,TAVI 既不劣于也不优于外科主动脉瓣置换术。 本研究的目的是评估免缝合快速部署瓣膜 (SuRD-AVR) 与 TAVI 在低风险单纯主动脉瓣狭窄患者中的疗效。
方 法
回顾性收集来自五个欧洲中心的数据。 我们纳入了 2014 年至 2019 年期间通过 SuRD-AVR (n = 636) 或 TAVI (n = 670) 接受主动脉瓣置换术的 1306 名连续患者(EUROSCORE II < 4)。按照 1:1 近邻法进行倾向评分,获得两个平衡组,每组 346 名患者。 该研究的主要终点是:30 天死亡率和 5 年总生存率。 次要终点是无主要不良心脑血管事件 (MACCE) 的 5 年生存率。
结 果
两组之间的 30 天死亡率相似(SuRD-AVR:1.7%,TAVI:2.0%,p = 0.779),而 TAVI 组的 5 年总生存率和无 MACCE 生存率显着较低(5 年匹配总生存率:SuRD-AVR:78.5%,TAVI:62.9%,p = 0.039;5 年匹配无 MACCE生存率:SuRD-AVR:64.6%,TAVI:48.7%,p = 0.004)。 TAVI 组术后永久起搏器植入(PPI)和瓣周漏≥2 级(PVL)的发生率较高。 多变量 Cox 回归分析确定 PPI 是死亡率的独立预测因子。
结 论
与 SuRD-AVR 相比,TAVI 患者的五年生存率和无 MACCE 生存率显着较低,且 PPI 和 PVL ≥ 2 的发生率较高。
关于CORCYM恪心医疗
Corcym是一家全球性医疗设备公司,完全专注于提供最先进的手术解决方案来对抗结构性心脏病。Corcym在100多个国家/地区开展业务,拥有约850名员工,确保为全球患者、医疗保健专业人员和医疗保健系统提供强有力的持续支持。欲了解更多信息,请访问www.corcym.com



关键词:微创

Alina Zubarevich1, MD; Konstantin Zhigalov1, MD, PhD; Bastian Schmack1, MD, PhD; Arian Arjomani Rad2, MD; Robert Vardanyan2, MD; Daniel Wendt1, MD, PhD; Arjang Ruhparwar1, MD, PhD; Alexander Weymann1, MD, PhD
DOI:10.21470/1678-9741-2020-0393
摘 要
在经导管主动脉瓣植入术不断发展的时代,发展微创手术技术至关重要。 这些方法可以帮助术后快速康复,尤其是对于年老体弱的患者。 微创主动脉瓣置换术 (MIAVR) 通常通过胸骨上段正中小切口入路。 我们通过右侧肋间小切口报告了 MIAVR,它与创伤小、快速康复、输血率低和术后伤口感染风险低有关。 由于微创手术往往需要更长的手术时间,我们建议使用快速植入瓣膜假体来克服这一限制。 本说明侧重于技术方面和术前评估。
|
缩写 |
|
|
CPB |
= 心肺旁路 |
|
CT |
= 计算机断层扫描 |
|
ICU |
= 重症加护 |
|
MIAVR |
= 微创主动脉瓣置换术 |
|
RAT |
= 右前侧肋间切口 |
|
TAVI |
= 经导管主动脉瓣膜植入 |
|
TEE |
= 经食管超声心动图 |
关键词:经导管主动脉瓣置换术;主动脉瓣;开胸术;手术伤口感染;年老体弱;心脏瓣膜假体。
自 1996 年首次被报告[1]以来,微创主动脉瓣置换术 (MIAVR) 在心胸外科手术中越来越受欢迎。 由于其微创特性和更小的手术创伤以及出色的美容效果,患者和医生都更喜欢 MIAVR 而不是通过正中胸骨切开术进行的传统手术。 事实上,各种研究表明,与传统手术相比,MIAVR 的结果相当甚至更好[2]。 除了出色的美容效果外,许多研究报告说,MIAVR 后输血减少、重症监护病房 (ICU) 住院时间缩短、伤口感染率和术后疼痛降低,术后死亡率无差异[ 3]. 此外,保留胸骨的右前侧肋间切口 (RAT) 已被提议作为一种切口更小的MIAVR方法。 在这里,我们描述了我们使用免缝合主动脉瓣假体的 RAT 方法,以在不延长手术时间的情况下实现最佳的功能和美容的效果。 所有患者都同意接受手术并同意将他们的匿名数据用于未来的研究和发表。 数据资料可供查阅。 我们还提出了简化术前成像以实现最佳手术规划。
讨 论
在过去的二十年里,外科瓣膜手术的趋势正在迅速转向微创策略。 在经导管主动脉瓣植入术 (TAVI) 不断发展的时代,外科手术正受到更快速的康复的挑战、ICU 和住院时间更短以及 TAVI 提供的手术创伤更小的挑战。
虽然MIAVR通常与较长的手术和主动脉阻断时间相关,但它已被证明是一种可行且安全的手术,即使在高危和老年患者中也具有较低的术后死亡率[5,6]事实上,RAT不仅可以保持胸骨的稳定性,提供帮助快速康复,而且还可以防止术后出血,并提供较低的输血率和较短的ICU住院时间[7]。已知主动脉阻断时间是心脏手术中发病率和死亡率的独立预测因子。通过将RAT方法与免缝合瓣膜假体相结合,我们能够大大减少手术和主动脉阻断时间[8]。通过在大多数情况下采用标准的插管的传统中央插管,我们倾向于避免与腹股沟血管插管和长时间固定相关的腹股沟并发症。
在术前计划中,一些小组[9]使用胸部CT来绘制切口高度。随着我们使用RAT的经验越来越多,我们从这个概念转变为使用超声心动图和 X射线来规划胸腔通路。 仅在X射线或超声心动图显示任何可能使RAT通路复杂化的异常情况下才执行CT扫描。这个概念帮助我们节省时间并降低成本和辐射暴露。
此外,RAT 方法提供了出色的美容效果,疼痛更少,恢复工作更快,从而提高了患者的满意度(图3A和B)。尽管外科医生必须通过学习曲线才能通过RAT方法执行 MIAVR,但它仍然可以安全地进行手术,并且具有出色的血液动力学特性和较低的术后并发症发生率。
在现代心脏手术中,开发微创手术至关重要。 根据我们的经验,RAT方法与免缝合人工瓣膜相结合可提供出色的美容效果。手术和主动脉阻断时间、手术创伤、输血和ICU/住院时间保持在较低水平。术前影像学和仔细规划是MIAVR 成功的关键。此外,通过使用中央插管,可以轻松避免一些腹股沟并发症,而不会影响瓣膜的手术通路。卓越的美容效果可提高患者和医生的满意度。
(图1AB)
(图2AB)
(图3AB)
结 论
与任何MIAVR类似,与传统的手术主动脉瓣置换术相比,RAT方法在技术上更加复杂。然而,在完成学习曲线后,相信外科医生会优先为患者提供这种替代方法。
参考文献:
Cosgrove DM 3rd, Sabik JF. Minimally invasive approach for aortic valve
operations. Ann Thorac Surg. 1996;62(2):596-7.
Bowdish ME, Hui DS, Cleveland JD, Mack WJ, Sinha R, Ranjan R, et
al. A comparison of aortic valve replacement via an anterior right
minithoracotomy with standard sternotomy: a propensity score analysis
of 492 patients. Eur J Cardiothorac Surg. 2016;49(2):456-63. doi:10.1093/
ejcts/ezv038.
Stoliński J, Plicner D, Grudzień G, Wąsowicz M, Musiał R, Andres J,
et al. A comparison of minimally invasive and standard aortic valve
replacement. J Thorac Cardiovasc Surg. 2016;152(4):1030-9. doi:10.1016/j.
jtcvs.2016.06.012.
Mashhour A, Zhigalov K, Szczechowicz M, Mkalaluh S, Easo J, Eichstaedt
H, et al. Snugger method – the Oldenburg modification of perceval
implantation technique. World J Cardiol. 2018;10(9):119-22. doi:10.4330/
wjc.v10.i9.119.
Glauber M, Miceli A, Gilmanov D, Ferrarini M, Bevilacqua S, Farneti PA,
et al. Right anterior minithoracotomy versus conventional aortic valve
replacement: a propensity score matched study. J Thorac Cardiovasc
Surg. 2013;145(5):1222-6. doi:10.1016/j.jtcvs.2012.03.064.
Lamelas J, Sarria A, Santana O, Pineda AM, Lamas GA. Outcomes of
minimally invasive valve surgery versus median sternotomy in patients
age 75 years or greater. Ann Thorac Surg. 2011;91(1):79-84. doi:10.1016/j.
athoracsur.2010.09.019.
Sabry H, Baltabaeva A, Gkikas A, Valencia O, Sarri G, Mirsadraee S, et
al. Rapid deployment aortic valve replacement through anterior right
thoracotomy: clinical outcomes and haemodynamic performance. J
Card Surg. 2020;35(7):1420-4. doi:10.1111/jocs.14585.
Mashhour A, Zhigalov K, Mkalaluh S, Szczechowicz M, Easo J, Eichstaedt
HC, et al. Outcome of a modified perceval implantation technique.
Thorac Cardiovasc Surg. 2020;68(7):602-7. doi:10.1055/s-0039-1685512.
Van Praet KM, van Kampen A, Kofler M, Richter G, Sündermann SH,
Meyer A, et al. Minimally invasive surgical aortic valve replacement: the RALT approach. J Card Surg. 2020;35(9):2341-6. doi:10.1111/jocs.14756.
关于CORCYM恪心医疗
Corcym是一家全球性医疗设备公司,完全专注于提供最先进的手术解决方案来对抗结构性心脏病。Corcym在100多个国家/地区开展业务,拥有约900名员工,确保为全球患者、医疗保健专业人员和医疗保健系统提供强有力的持续支持。欲了解更多信息,请访问www.corcym.com



关键词:再次手术

Interact Cardiovasc Thorac Surg. 2022 May 2;34(5):921-923.
PMID:35170722
DOI:10.1093/icvts/ivab361
作者: Yumi Kakizawa , Hiroyuki Nishi , Takasumi Goto , Mutsunori Kitahara
1|摘 要
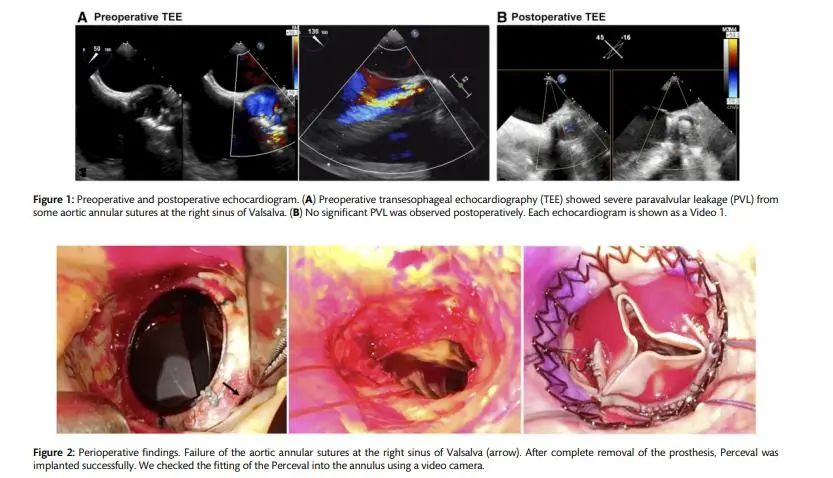
一名50岁男性因严重瓣周漏(PVL)需要主动脉瓣置换术(AVR)手术,前3次术后均伴有严重PVL复发。由于人工瓣膜与瓣环不匹配,PVL每次都会复发,因此使用自膨胀免缝合瓣膜进行了第四次主动脉瓣置换术。术后超声心动图显示无明显PVL。患者出院后没有任何并发症,不久便恢复正常工作。在我们患者这样的情况下,免缝合AVR可能是传统AVR的有力替代品。
2|概 要
最新技术的发展促进了免缝合主动脉瓣置换术(SU-AVR)这一技术成为了主动脉瓣置换的一种有吸引力的手术技术。由于SU-AVR简化了缝合并允许快速植入,可明显地缩短手术时间。此外,由于Perceval植入不需要任何环形缝合,使用Perceval的SU-AVR可能会为因瓣环缝合失败而导致瓣膜周漏(PVL)复发的患者提供额外的优势。在这里,我们报告了对于常规AVR后PVL的频繁复发的患者使用Perceval的第四次成功再次AVR的病例。
3|病例概述
一名50岁男子因呼吸困难来我们的机构手术治疗术后复发性严重PVL。患者之前接受过3次主动脉瓣置换术。最初的手术是于主动脉严重的反流于38年前行AVR治疗(Björk–Shiley,25 mm,Pfizer Inc.,USA)。第二次手术是34年前因为瓣环缝合结构失效再次进行了手术(Björk–Shiley,25mm,Pfizer Inc.,USA)。第三次AVR(ATS,25mm,Medical,Inc., USA)是在18年前完成的。
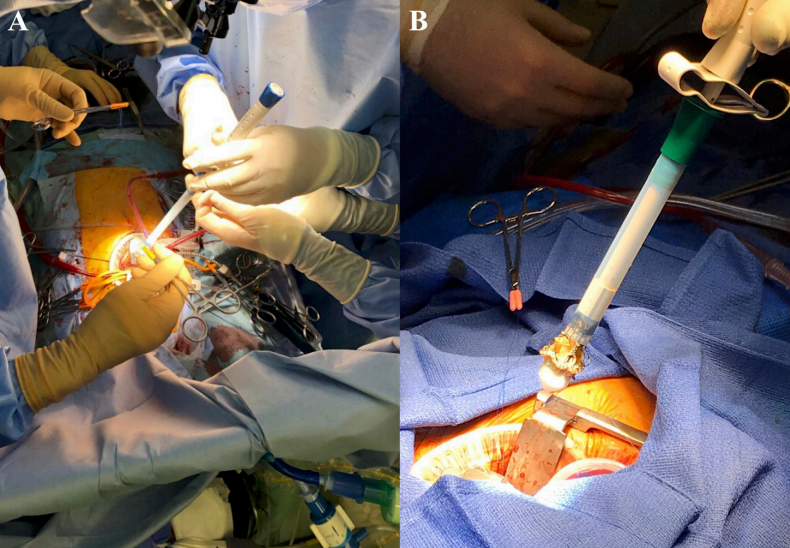
目前在超声心动图上,左心室射血分数为40%, 左心室舒张末期和收缩末期直径分别为62mm和50mm。超声心动图显示位于右冠窦的严重PVL(图1A)。因此,患者被诊断为PVL复发,由瓣环缝合失败引起。因为所有过去再次手术的AVR对于由瓣环缝合线脱离引起的PVL复发,使用常规瓣膜执行第四AVR的潜在风险可能更高。此外,由于粘连,再次AVR手术时间将比以前更长。因此,第四次计划使用Perceval再次AVR。由于第三次再次AVR人工心包片覆盖了心脏,在术前CT检查,胸骨和心脏右侧入路手术相对容易而没有紧密的粘。心脏停跳采取常规的心肺转流,温度正常。与之前相比,进行了更高的横向主动脉切口切开术主动脉切开术后,人工瓣膜暴露;有人工瓣膜和右冠窦之间的一些间隙。在完全移除假体后,L型号测瓣器不能轻易通过瓣环。所以使用3根引导线精确植入Perceval(大小M)引导线穿过每个瓣窦的最低点(图2)。术中TEE显示没有PVL的证据(图1B)。
手术过程无异常,术后超声心动图显示主动脉瓣面积为1.82 cm2平均压力梯度为12mmHg。患者出院后无任何并发症,不久之后,恢复正常工作。
4|讨 论
在本病例中,PVL因环形缝合复发3次。有些可能是患者有大动脉炎或白塞氏病。我们的病人没有这样的免疫学和组织学分析。由于初次AVR时患者为二叶瓣结构,因此可能导致主动脉瓣环组织脆弱。或者,可能在初次AVR时对瓣膜进行了过度切除。考虑到患者的病史,这个病例中PVL复发的潜在风险高于正常病例。由于环形缝合可能是PVL复发的危险因素,而Perceval是一种自膨胀瓣膜,使用Perceval可能比使用传统瓣膜再次AVR更合适。
此外,据报道,Perceval植入术后PVL的中期结果优于传统的AVR。据我们所知,我们的病例是第一个报告因环状缝线脱离而复发PVL使用SU-AVR再次手术的案例。生物瓣膜AVR的手术指征对于这个年轻患者仍然是存在争议的。Perceval的有效开口面积通常大于传统生物合成瓣膜,且后期可以进行瓣中瓣技术治疗。尽管到目前为止,该患者的主动脉瓣环的扩张并不显著,但未来可能会扩大,有可能导致PVL复发。使用传统的AVR或Intuity SU-AVR(EdwardsLifesciences,Irvine,CA, USA)进行AVR,后期无法进行经导管的瓣中瓣技术进行治疗。鉴于这些原因,Perceval可以在这种情况下是可接受的手术选择。
关于CORCYM恪心医疗
CORCYM是一家跨国医疗设备公司,全心专注于先进的结构性心脏病外科手术解决方案。CORCYM在100多个国家开展业务,拥有约850名员工,确保为世界各地的患者、医疗专业人士和医疗系统提供强有力的持续支持。如需了解更多信息,请访问www.corcym.com



关键词:与传统瓣膜对比

背景:
免缝合主动脉瓣已被证明可显着减少手术、心肺转流和体外循环时间,因而能够显着减少老年高危人群的死亡风险。在这项研究中,我们试图回顾我们的机构免缝合主动脉瓣置换术 (SU-AVR) 联合二尖瓣置换 (SMVR)的经验,并与联合传统外科主动脉瓣置换术 (SAVR)联合 SMVR作比较。
1|方法和材料
2018 年 3 月至 2022 年 7 月, 114 名患者在我们的机构接受了主动脉瓣和二尖瓣联合置换术。我们将患者按手术方式分为两组,1:2配对:第1组接受了联合传统SAVR 和 SMVR (n = 46),第 2 组包括联合植入Perceval 瓣膜的SU-AVR和SMVR (n = 23)。
2|结 果
术前特征无显着差异。SU-AVR 联合 SMVR 表现出色血液动力学性能,与 SAVR 联合 SMVR 相当,术后中位数第 1 组主动脉的跨瓣压差为 4 mmHg (IQR 3.0–4.0),第 2 组主动脉的跨瓣压差为 4 mmHg (IQR 3.0–4.0)(p = 0.67)。两组患者术后死亡、脑卒中、心肌梗死、肾衰竭等重大不良事件发生率比较,无明显差异。两组在永久性起搏器植入率、瓣周漏、瓣膜脱位等方面也无明显差异。我们也没有发现两组之间的术后死亡率有任何显著差异。
3|结论
在主动脉瓣和二尖瓣联合手术中,SU-AVR 已被证明是传统主动脉瓣的可靠替代品,并且提供更短的手术时间和出色的血液动力学。
关于CORCYM恪心医疗
CORCYM是一家跨国医疗设备公司,全心专注于先进的结构性心脏病外科手术解决方案。CORCYM在100多个国家开展业务,拥有约850名员工,确保为世界各地的患者、医疗专业人士和医疗系统提供强有力的持续支持。如需了解更多信息,请访问www.corcym.com


