医药 · 看点
《医疗器械监督管理条例(修订草案)》通过,《生物制品批签发管理办法》发布……12月21日~12月27日,医药行业的这些事情值得关注。
行业 · 政策动态
2.国家药监局发布《关于促进中药传承创新发展的实施意见》,对改革完善中药审评审批机制,促进中药传承创新发展进行整体规划。
3.国家市场监督管理总局发布《生物制品批签发管理办法》,明确了批签发豁免情形、检验项目和频次要求等,自2021年3月1日起施行。
4.国家药监局宣布于2018年9月30日发布的原《药物研发与技术审评沟通交流管理办法》废止。
5.国家药监局综合司就《执业药师注册管理办法(征求意见稿)》公开征求意见,征求意见截止时间为2021年1月6日。
6.国家药监局发布第三十三批、第三十四批仿制药参比制剂目录,《可重复使用医用防护服技术要求》以及电子上消化道内窥镜和眼底照相机2项注册技术审查指导原则。
7.国家医保局发布《关于加快落实医药价格和招采信用评价制度的通知》,提出各省级医疗保障局、集中采购机构务必于2020年底前建立医药价格和招采信用评价制度,制定印发相关政策文件,2021年2月底前,投标挂网企业书面承诺提交比例要达到80%以上。
8.财政部发布通知明确,自2021年1月1日起,对第二批抗癌药和罕见病药品原料、特殊患儿所需食品等实行零关税,降低人工心脏瓣膜、助听器等医疗器材以及乳清蛋白粉、乳铁蛋白等婴儿奶粉原料的进口关税。
9.国家药监局药审中心就第三十六批、第三十七批化学仿制药参比制剂目录公开征求意见。征求意见截止时间为2021年1月4日。
10.国家药监局药审中心发布《控制近视进展药物临床研究技术指导原则》以及《化学仿制药透皮贴剂药学研究技术指导原则(试行)》。
产品研发 · 上市信息
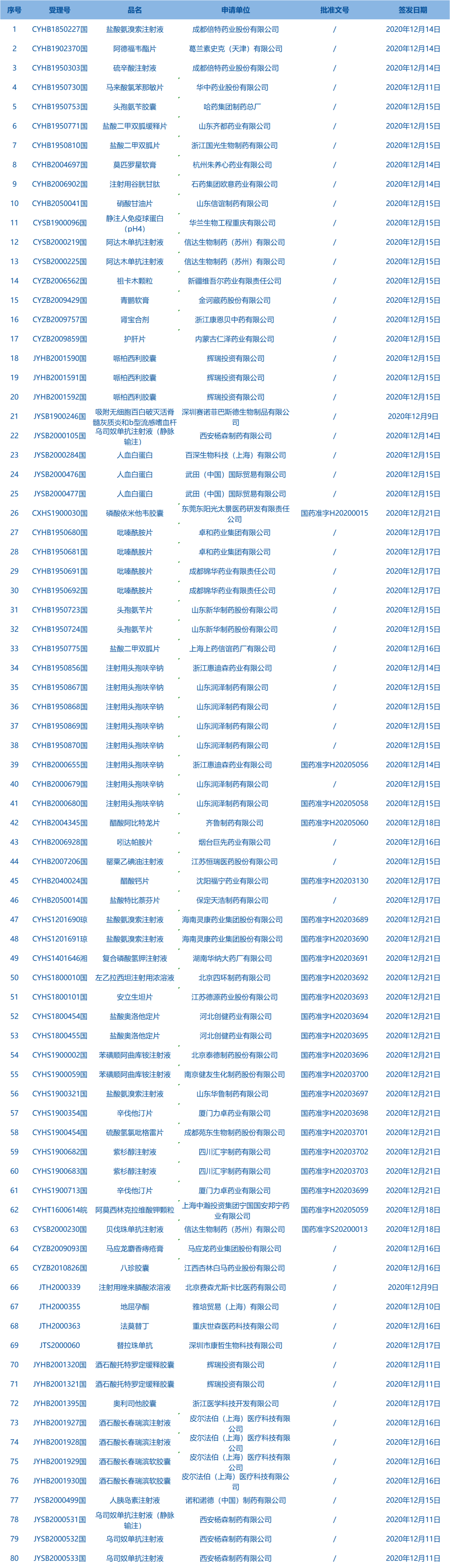
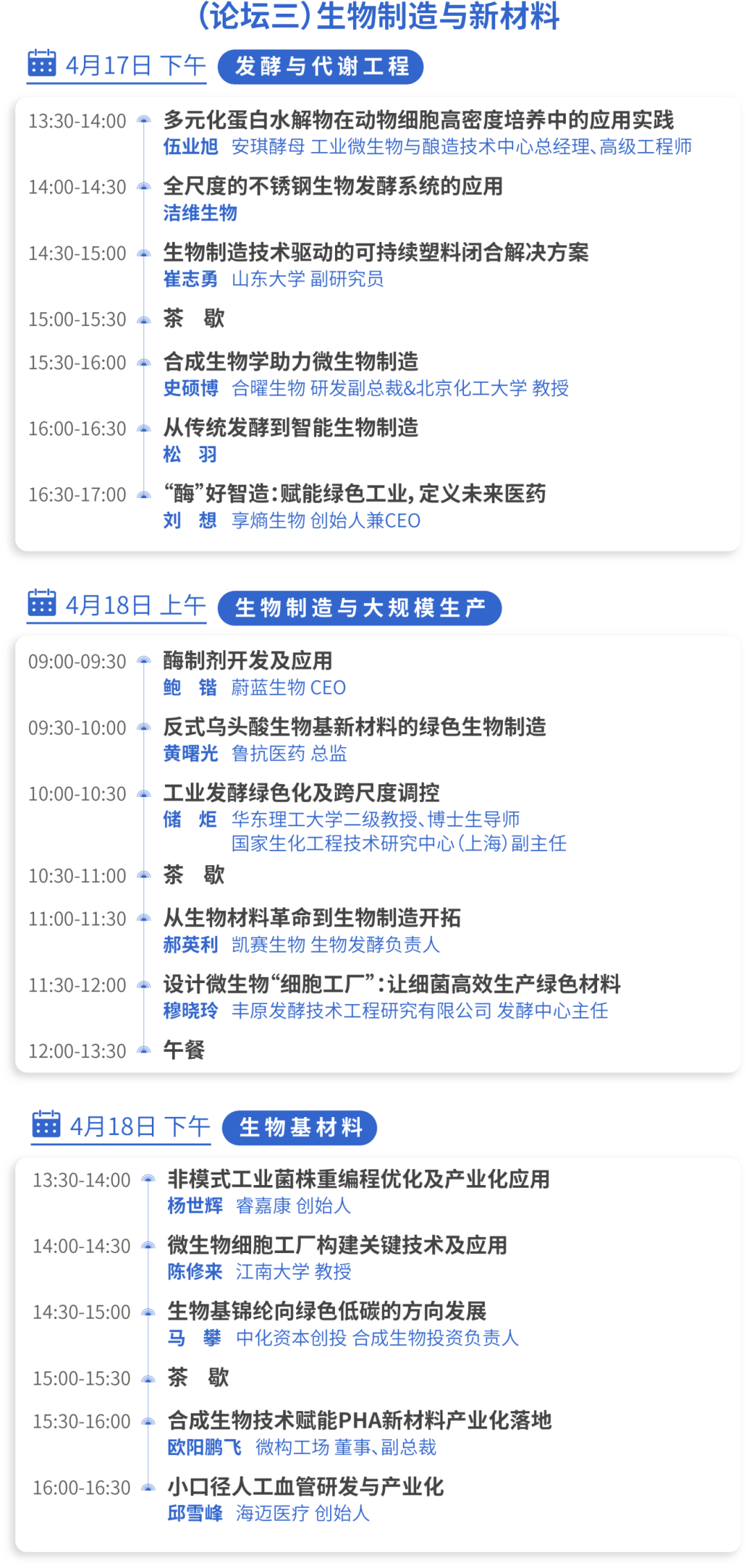
2.国家药监局发布3期医疗器械批准证明文件(准产)待领信息,共包括75个受理号,涉及深圳市爱康试剂有限公司等企业(截至12月25日)。
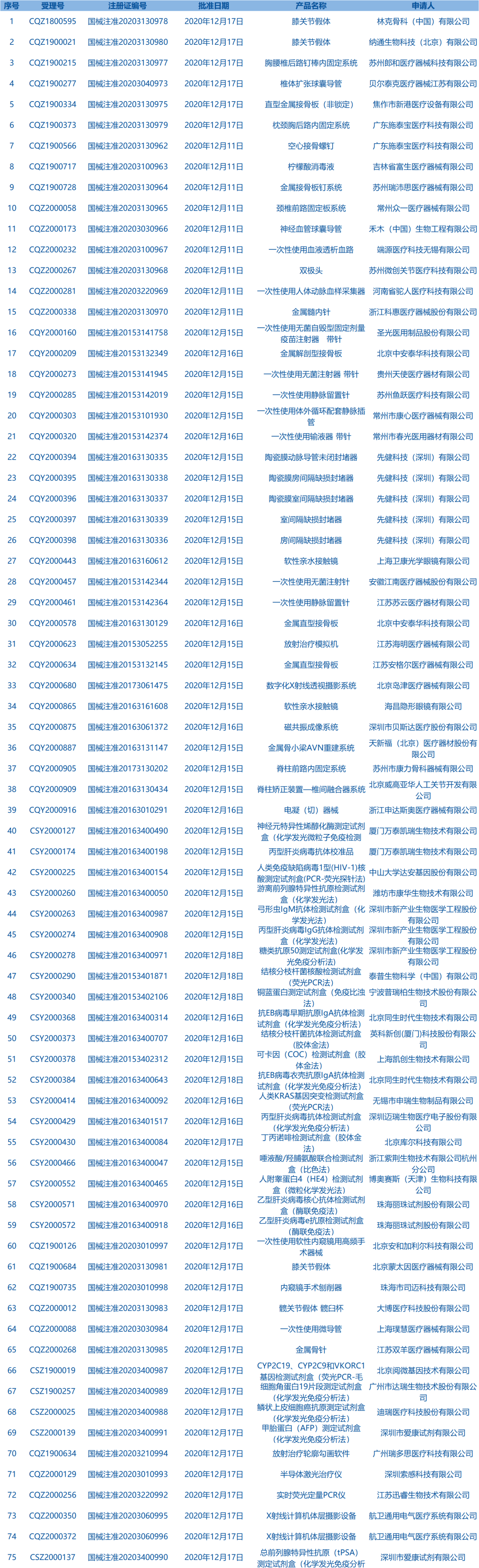
3.国家药监局通过优先审评审批程序附条件批准了北京诺诚健华医药的BTK抑制剂奥布替尼(Orelabrutinib)片(商品名:宜诺凯),用于既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)或慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)治疗。
4.国家药监局通过优先审评审批程序批准宜昌东阳光长江药业股份有限公司申报的1类创新药磷酸依米他韦胶囊(商品名:东卫恩)上市。该药为我国自主研发并拥有自主知识产权的创新药,磷酸依米他韦胶囊需与索磷布韦片联合,用于治疗成人基因1型非肝硬化慢性丙型肝炎。
5.国家药监局器审中心公示创新医疗器械特别审查申请审查结果,紫杉醇超声辅助球囊导管、穿戴式自动体外除颤器等两个申请项目拟进入特别审查程序。
6.CDE网站公示14个仿制药一致性评价任务,涉及布洛芬颗粒等药品(截至12月25日)。
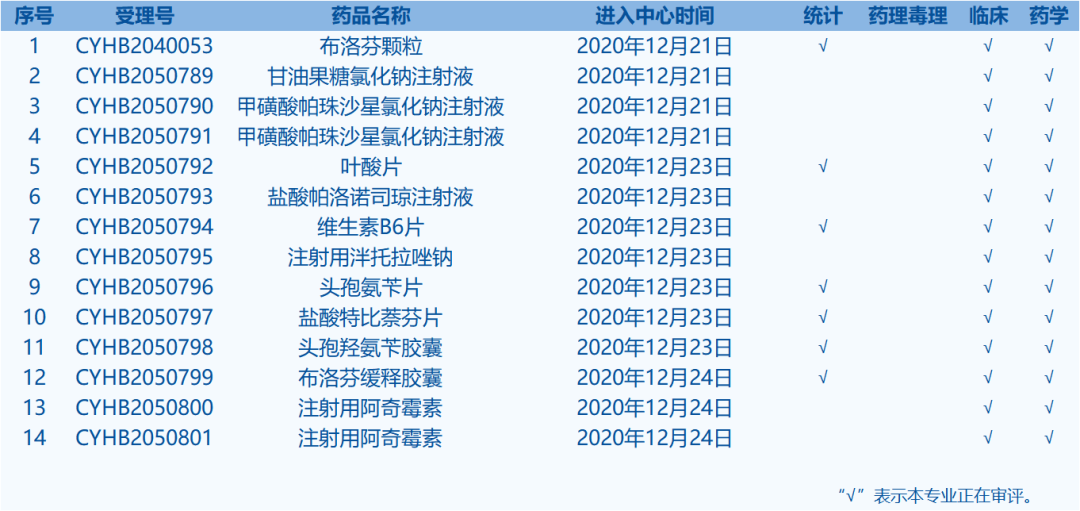
7.CDE承办受理20个新药上市申请,包括利妥昔单抗注射液等药品(截至12月25日)。
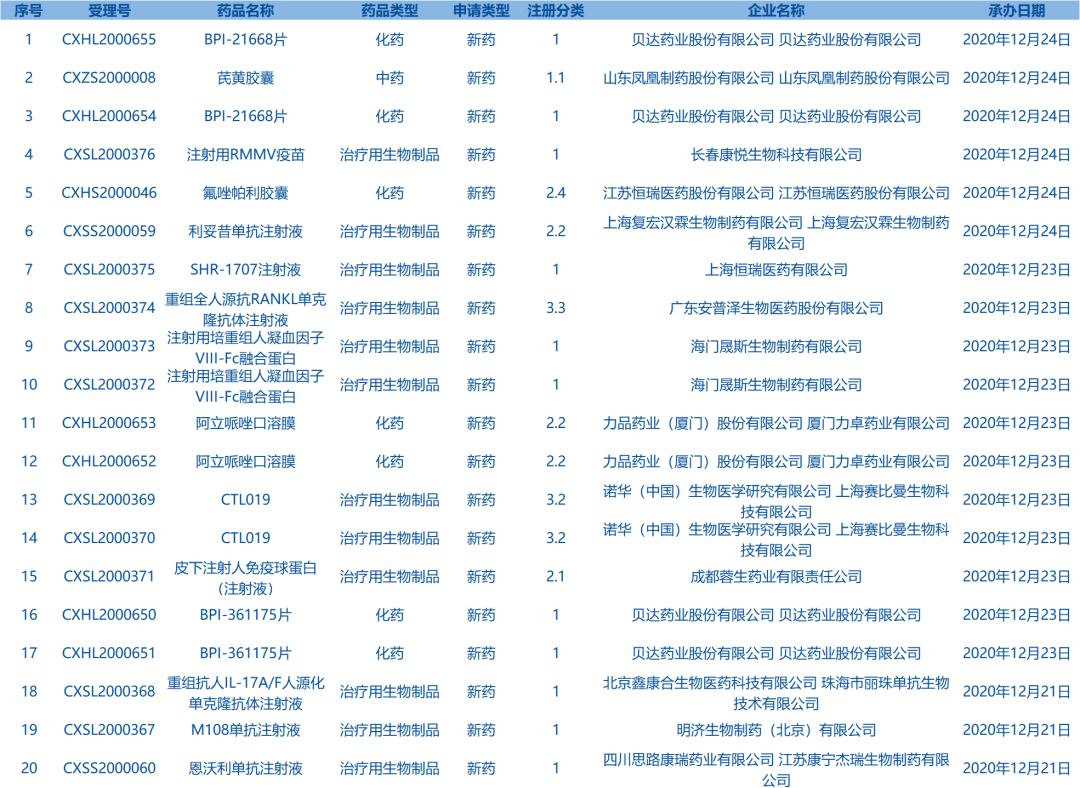
8.CDE网站信息显示,奥拉帕利片等6个药品拟进入优先审评审批程序。

医药企业观察
2.广州佳鉴生物技术有限公司宣布成功完成了1亿元人民币的B轮融资。本轮融资将用于进一步加强佳鉴生物旗下金圻睿生物在肿瘤伴随诊断、病原微生物、遗传性疾病等相关的多款基因检测产品的研发创新和引进转化等。
3.广州知易生物科技有限公司宣布完成1.1亿元人民币的B轮融资,本轮资金主要用于公司创新药的临床研究及新管线开发。
4.瑞派医疗宣布完成近亿元A轮融资。本轮融资由斯道资本领投,所筹资金将用于进一步巩固和扩大产品研发管线,加速推进自动化生产线,扩大品牌的市场投入等。
5.深圳惠泰医疗器械股份有限公司发布首次公开发行股票并在科创板上市发行公告,本次发行股票数量为1667万股,发行价格为74.46元/股。
6.东北制药与沈阳药科大学签订《战略合作框架协议》,双方将在药物研发项目、关键平台建设、开放式合作基地建设、人才培养与学术交流等方面开展合作。
药械集中采购
2.北京市医保局、天津市医保局、河北省医保局联合印发《京津冀药品联合带量采购工作意见》。意见明确,此次带量采购由京津冀所有公立医疗机构(含军队医疗机构)组成采购联盟,实施联合带量采购。鼓励医保定点社会办医疗机构、医保定点零售药店积极参与。
3.广东省发布通知明确,广东省落实国家组织药品集中采购和使用试点扩围中选品种首年采购期即将于2020年12月30日结束,现决定对采购期为一年的11个品种采购期满后续约一年,原中选企业按中选价格和2021年约定采购量供应全省(含广州、深圳),约定采购量完成后,超过部分中选企业仍按中选价继续供应。
温馨提示
近期微信公众平台调整了推送机制
订阅号的阅读列表不再按发布时间排序
请把微信公众号“中国医药报”设为星标
才会第一时间看到我们的文章
设星标,不迷路!
来源/中国医药报
中国医药报社版权所有,未经许可不得转载使用。


分享、在看与点赞,医药报爱你哦!