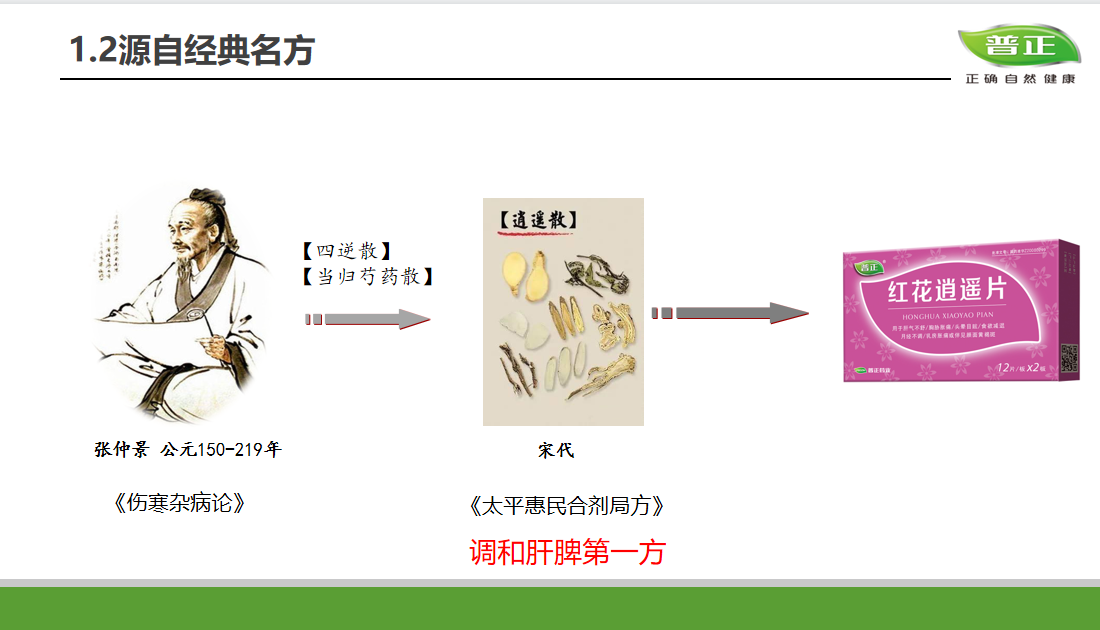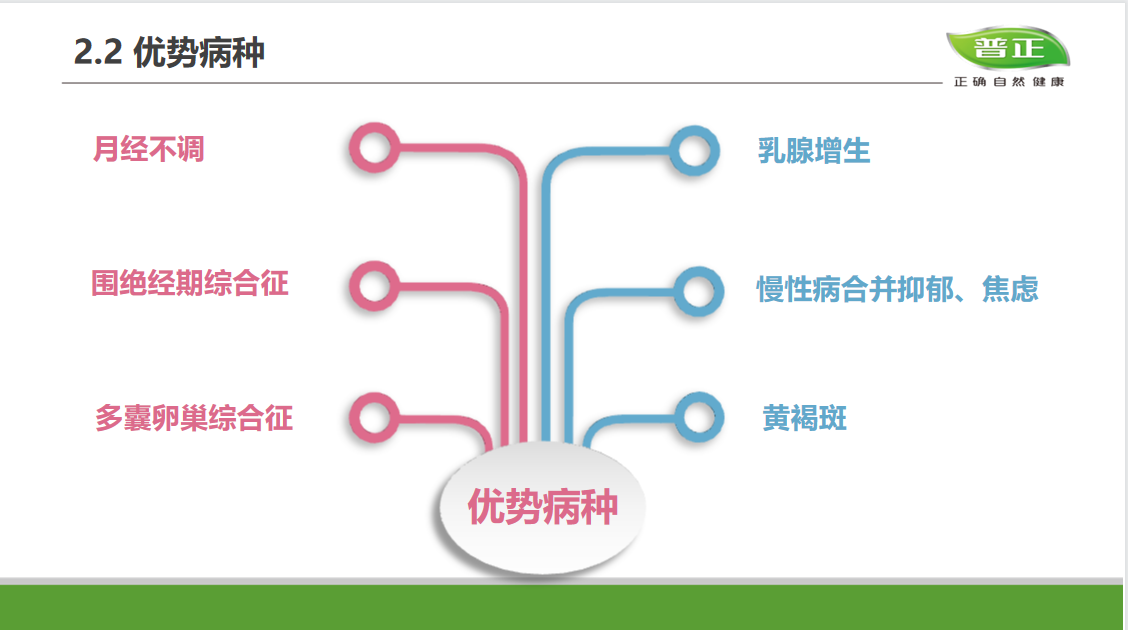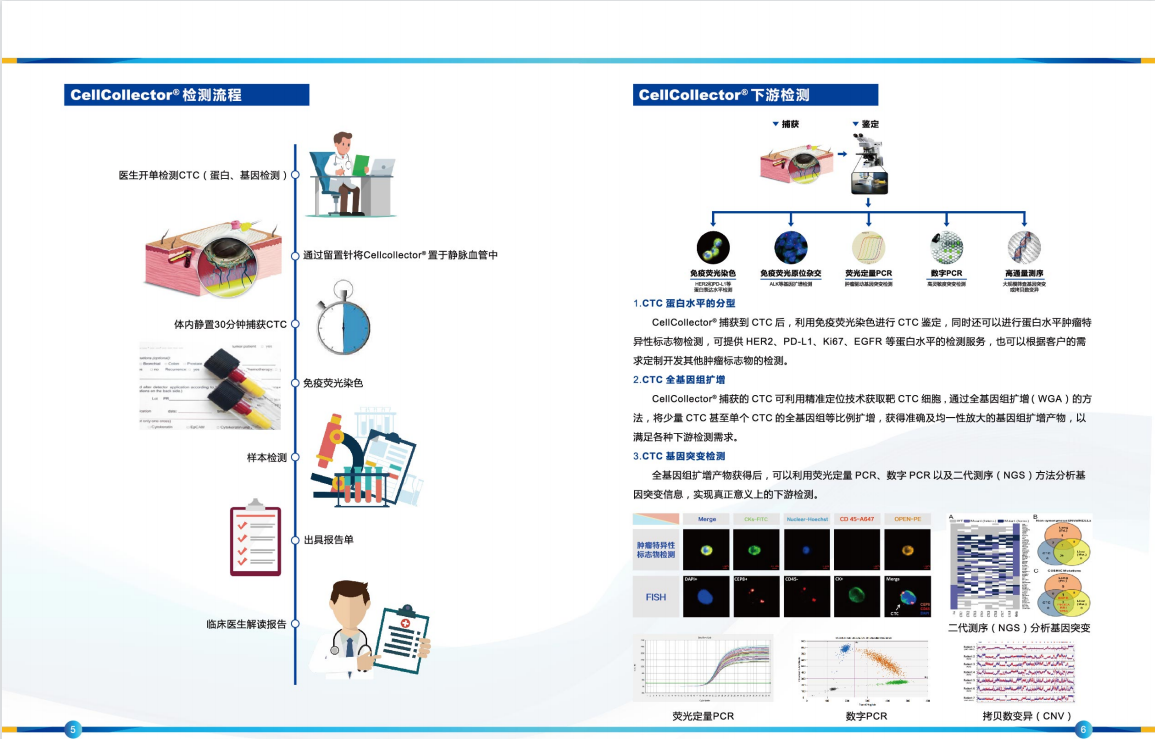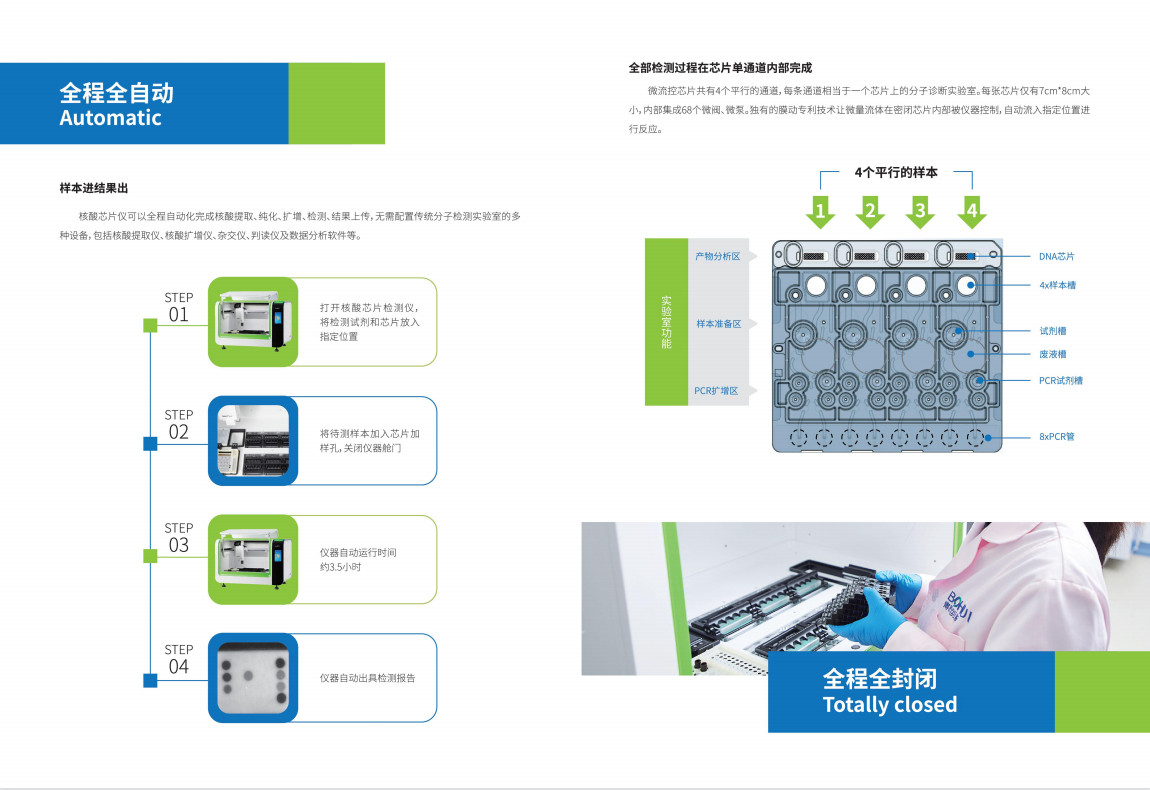
展厅的中央,钱佳华的作品均质地悬挂在仿佛墙壁、地板融为一体的灰色空间中。每幅画面由精确的线条和形体以及精致简约的色块组成,并使她在展览的一角具有整齐的装饰性。远看,这些具有同一属性的糖果色画作仿佛同胞手足,带动着我们的视线进入一个有节奏的序列中。它们看似井然有序、沉着冷静,完全顺从于对秩序和极简艺术的固有认知。而在一定程度上,这份表面上所获得的熟悉感足以让一部分观众止步于拍照留念后默默离开。
In the main gallery, Qian Jiahua' s band of laconic paintings hang uniformly in a spatial void of greyness that neutralises the divide between the walls and the floor. Each composition is made of clinically precise lines and forms with the most minimalist of palettes, making her corner of the exhibition tidily decorative. From afar, the candy-coloured canvas are like siblings, trailing our eyes into their rhythmic sequence. Indeed, they feel orderly and composed and appear in full compliance, which may be enough for a casual observer to whip out one's phone and begin screen tapping.

「视线 Sight Lines」展览现场

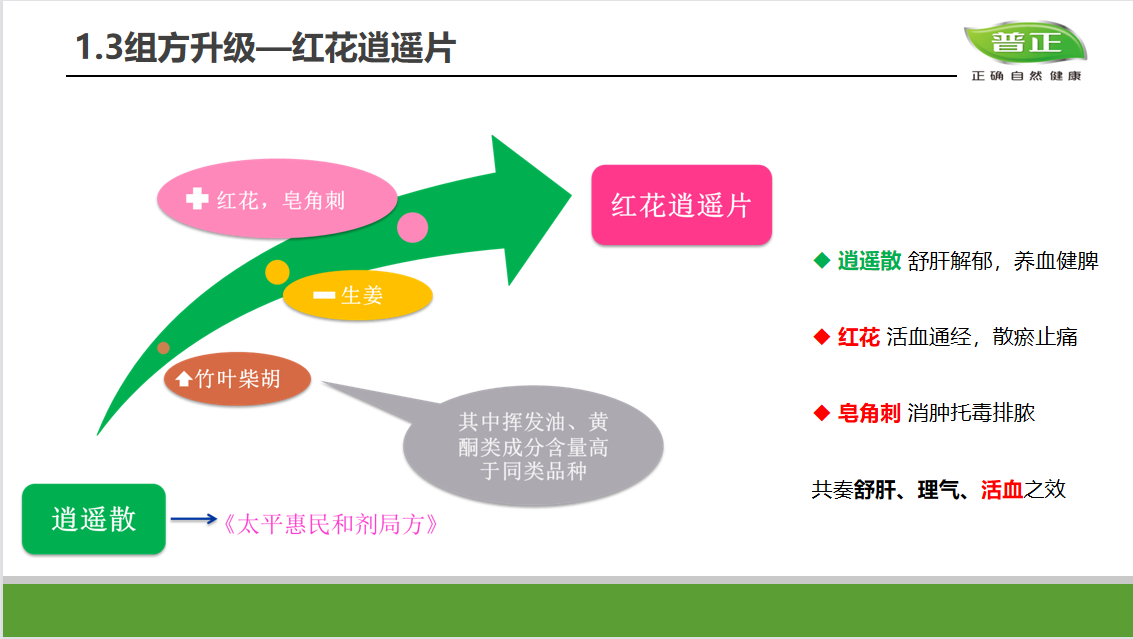
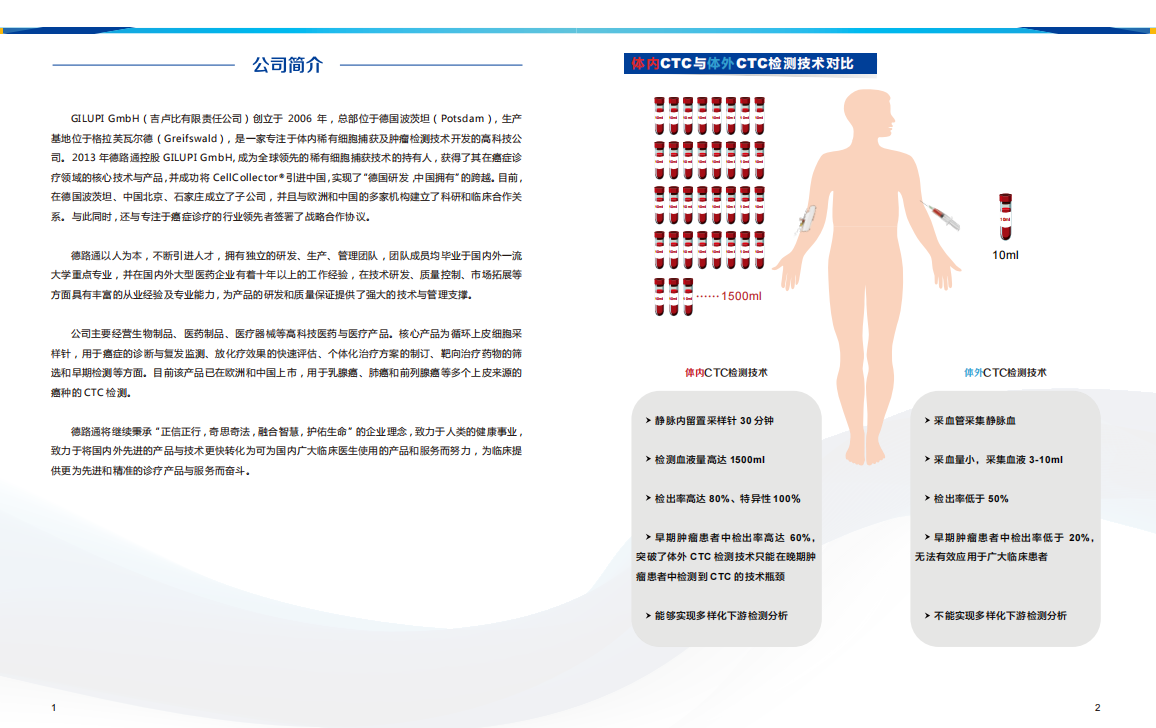
钱佳华 Qian Jiahua, 金牛锦 Taurus, 2022
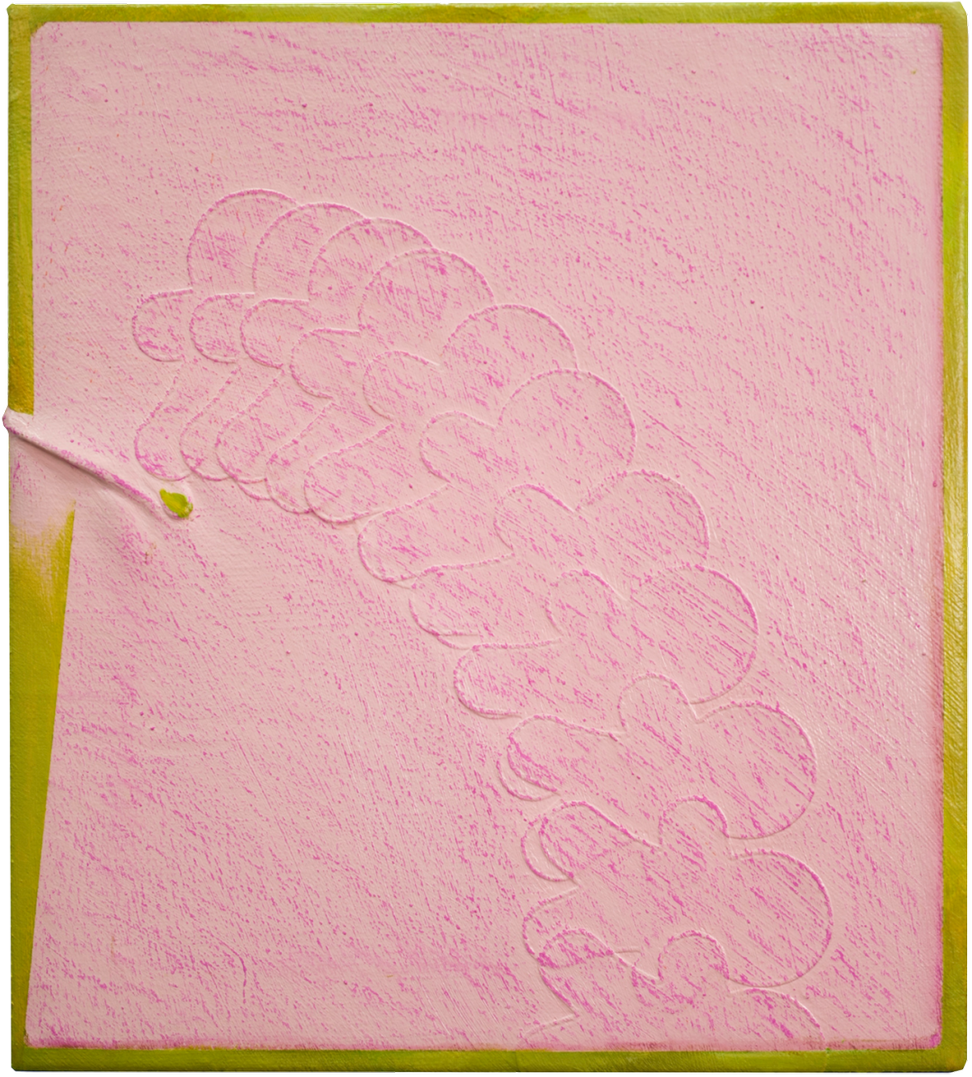
但对于专注的观众,这极致简单的画面显然是艺术家有意图为刻板解读而设置的陷阱。深入观察下,每幅画面都暗含一丝蹊跷或障碍,巧妙地刷新观众惯常的视觉感知——画面中形状的看似扭曲、面板角度的落差、画布的缝制,无一不展露着一种失重感。画布上所拓印的纹理图案似乎与作品难以捉摸的标题有关。画作上的线条除了是肢体“动态”痕迹,更是夹杂了那一念之下所产生的冲动感,仿佛实体化了思想的行动轨迹。
But for an attentive audience, that feels too easy and neat, almost an interpretative cul-de-sac decoy. Examining her art is a durational experience, where upon closer inspection, each painting reveals a little hiccup that cleverly throws its audience's perception off balance. The forms seem warped, the panel looks uneven, and her hand-sewn stitches feels taut across the canvas. From up close, every canvas is adorned with imprinted patterns that seemingly affiliate with the work's elusive title. Even lines illuminating her paintings are as much a gesture as they are the strike of an idea – if an idea were to have a mind of its own that could impulsively extend like a hand.

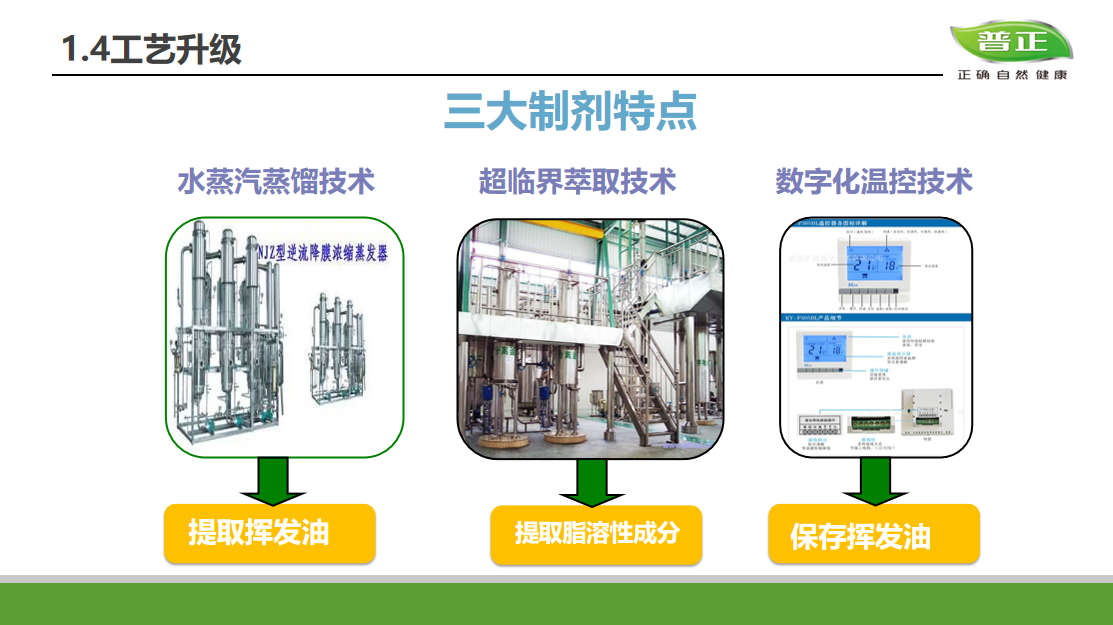
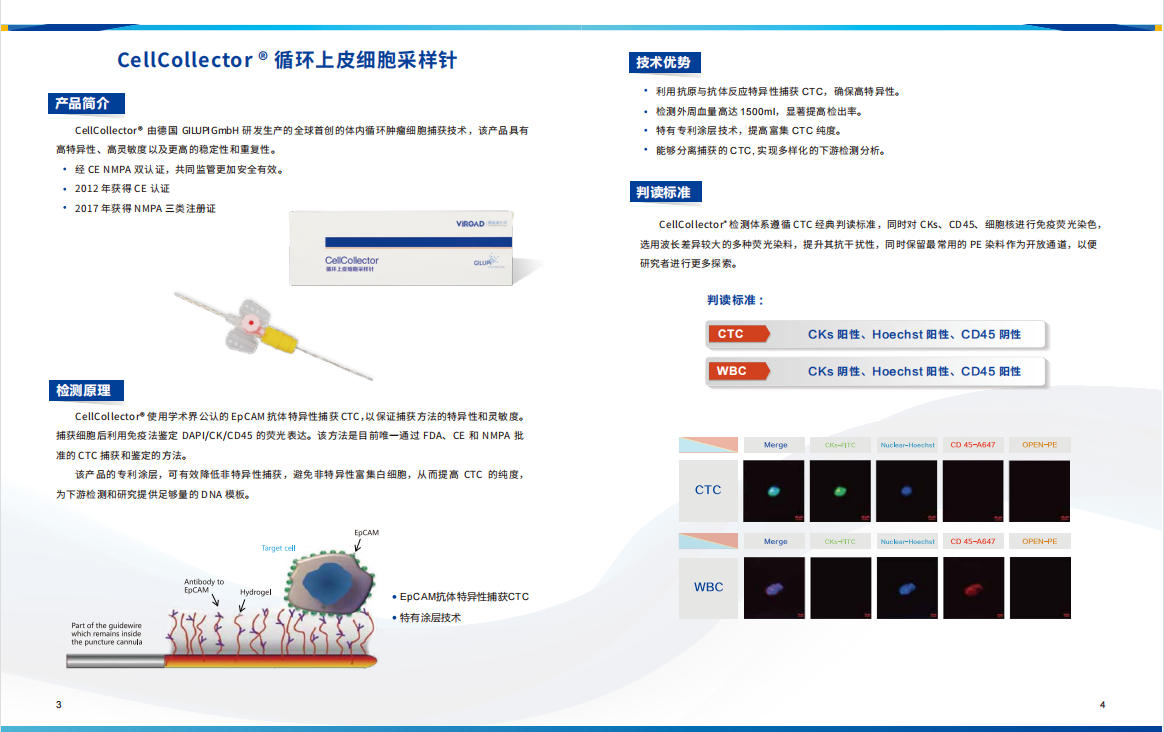
钱佳华 Qian Jiahua, 8:33, 2013

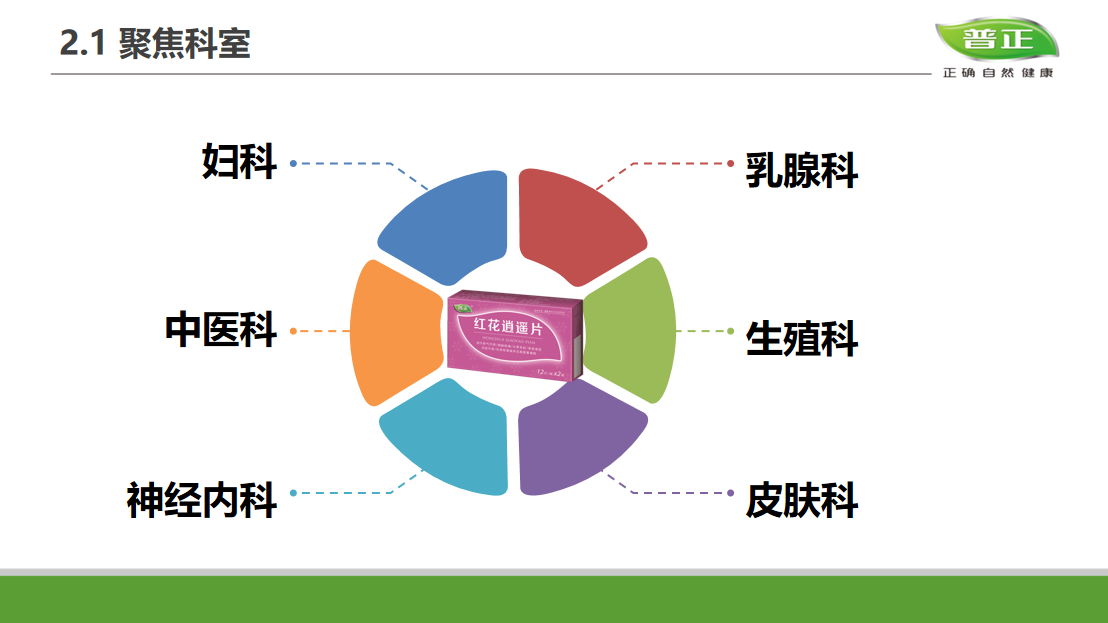
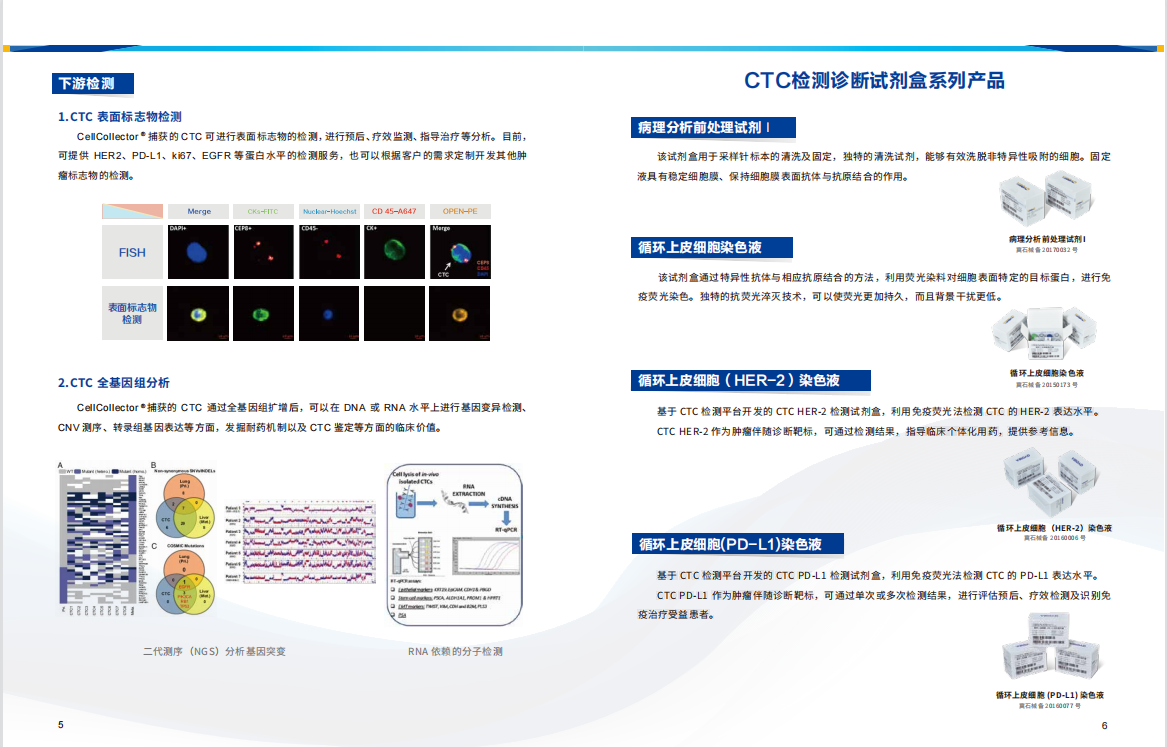
钱佳华 Qian Jiahua, 阿斯 Asse, 2023
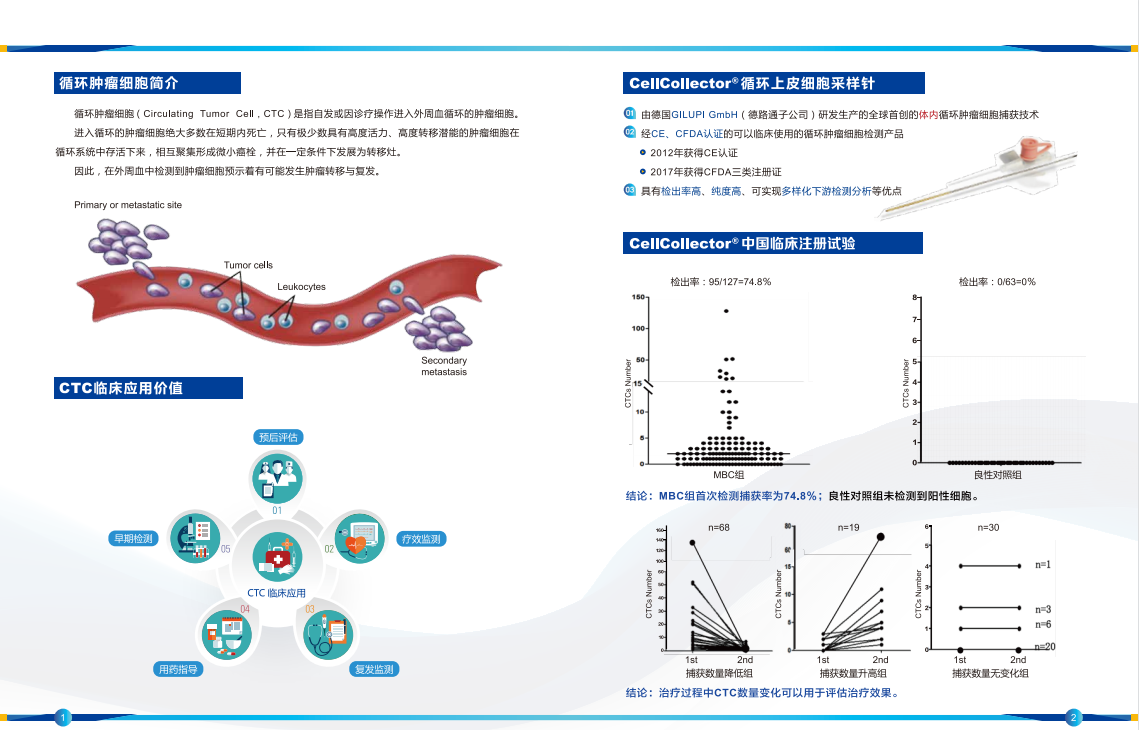
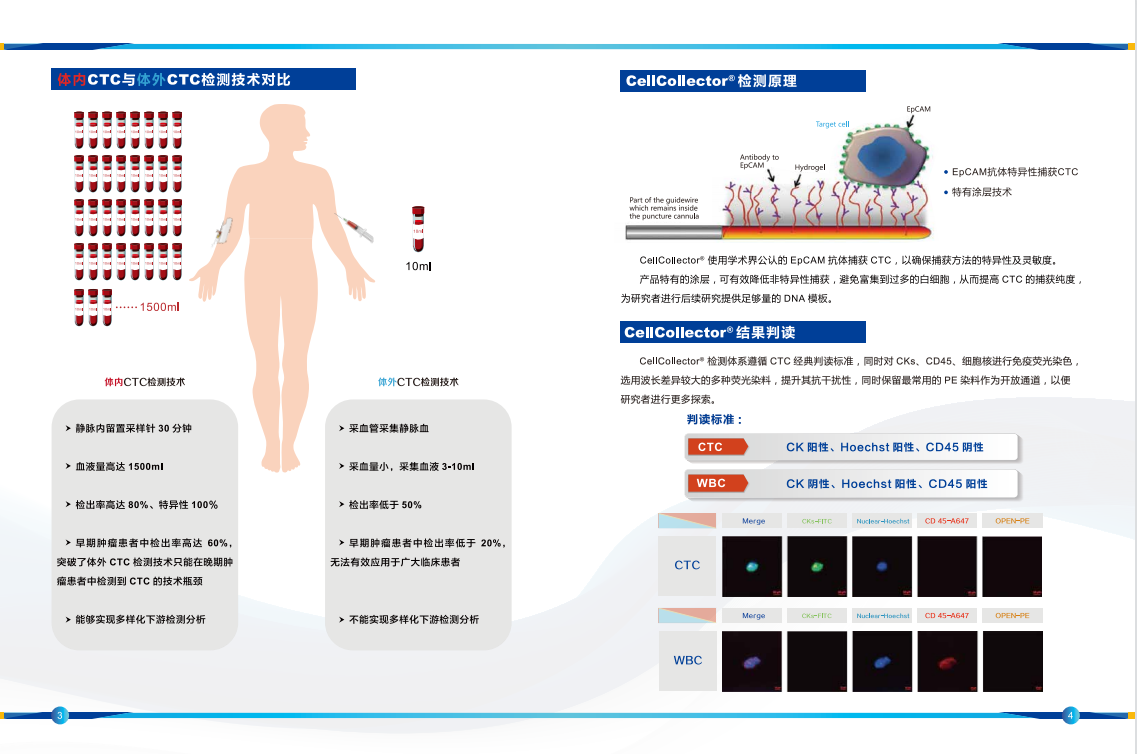
对于钱佳华的作品内容的理解,不得不提到植根于她十年艺术生涯中的几何形体、二维平面感和线性关系的绘画表达语言。这段时期无疑为她在抽象、即兴、色域和极简主义绘画的非表征性的力量艺术实践中提供了充足的变化空间。她的绘画装置作品整体构成严肃的纪律感,但往往是以即兴的方式展开,过程中透过表面的堆叠、分割和抛光形成整齐的色块层次。在近期的创作中,她通过拓印的方式将她的绘画表面肌理来扩展媒介的质属性。这些图案的模具源自艺术家日常环境中所收集的物品,其中包含了动物皮革、节日装饰的墙字、以及樱桃和鲜花等其他杂项形状。它们暗藏在画布中的色域背景中,只有通过我们肉眼的观察下才会显现。这堆叠出的塑形感进一步推动了她对媒介本质的探索。
Perhaps a clue to Qian's thinking could be traced to her 10-year aesthetic language rooted in geometric shapes, flat surfaces and linear relationships; the period certainly provided her practice with ample scope for variation within a compendium of nonrepresentational forces of simplicity and spontaneity, colour field and minimalist painting. She typically starts her canvas extemporaneous, and in the process, stacks, divides and polishes the surface in neat acrylic layers to construct a painting-installation. In her recent works, Qian expands on the medium's materiality by compressing a relief texture onto her painting surface. The patterns, moulded from objects the artist gathered from her daily environment, range from animal leather sourced by fashion houses, Chinese characters used for festival decors, to other miscellaneous shapes such as cherries and flowers. Together, they camouflage into her colour-field canvas, perceptible only when physically regarded by the eye, and builds a layer of plasticity that necessarily furthers the artist’s exploration on the material essence of medium.

钱佳华 Qian Jiahua, 羽 Plume, 2021-2022

约瑟夫·阿尔伯斯 Josef Albers, 向方形致敬的习作 Study for Homage to the Square, 1968
随机性是钱佳华实践的核心动力,有时她乐于借力偶然之下所产生的身体感知和原始冲动来塑造新鲜的火花。绘画有时是一场事故与冒险的实验性结合,而非严谨的构图方案。所以,当被问及她的画面经历了多少次破坏时,钱佳华诙谐地回复道:“数不胜数,而且都被我埋藏在画面底下了。” 也许艺术家她本人未觉察到,但正是她乐于享受这份由风险所构成的戏剧性瞬间 ,才使她创造的抽象作品跳脱出极简主义牢不可破的沉默与冷酷。
Spontaneity is the core motivator in her practice, but sometimes she lets chance takes over and impulsion run. As she explains, occasionally, spontaneity derives its spark from chance. In this respect, the paintings are made up of accidents and adventures of human embodiment, unmoored from any pre-planned compositional schema. When questioned about how many mishaps her paintings have endured, Qian answers: Countless; in fact, they are all fossilised under the acrylic layers we're witnessing right now. Exuding the same minty-ness into her pieces, she tramps over the unbreachable solitude often alluded to minimalism, like a litter of feral kittens.

钱佳华 Qian Jiahua, 小心脚下 Slippery, 2022 | 背 Back, 2022
值得庆幸的是,艺术家也乐于与我们分享在她精确而俏皮的作品中的一些谜团和浅浅的幽默——比如,在「天秤少女」中,画板左右的角度落差虽然肉眼可见,却在镜头下永远无法明确显现;另一方面,在她受色彩大师约瑟夫·阿尔伯斯启发的作品「羽」中,由于创作过程过于顺利,艺术家通过擦洗和抛光对原始的图层制造破坏,以对抗其中所产生的倦怠感。这种异想天开的玩笑延续到画作的命名,例如「小心脚下」中恰如其分地描述了姜饼人从斜坡上失足滑落的场面,以及作品「背」中既像人体背部,又让人不禁联想到屁股的线条;等等。在她的画笔下,简洁的抽象画面固呈现出了一种特有生动力,并为观看的人注入了一种主动探索趣味的别样专注力。她作品中富有的灵动和新鲜感,让我们早已忘记画面中的极简性。但如同艺术家俏皮的思绪,她将探寻一切的选择留给了我们。
Thankfully Qian shares some enigmas and would-be private jokes with us in her precise but playful pieces – for example, in “Libra Girl”, 2021, she orchestrated a visual trick with the planar level of her painting panel so that the work remains forever warped when photographed; whereas in “Plume”, 2021-2022,she created havoc by scrubbing and buffing way the original layers to fight off the boredom derived from the smooth-sailing progress of her Josef Albers-inspired painting. Such whimsical mischief continues to the way she titled her paintings, from “Slippery”, 2022, which befittingly describes the scenario of a gingerbread man slipping off a slope in her painting, to "Back” , 2022, which quite honestly resembles a pair of buttocks; the fun is endless. Here, the dialectical terseness of abstract art is wonderfully upbeat. And by themselves, the works brim with character that none would regard minimal. But with the same playfulness Qian injects into the austerity of art, she leaves the chance of discovery to us.
©文章版权归属原创作者,如有侵权请后台联系删除