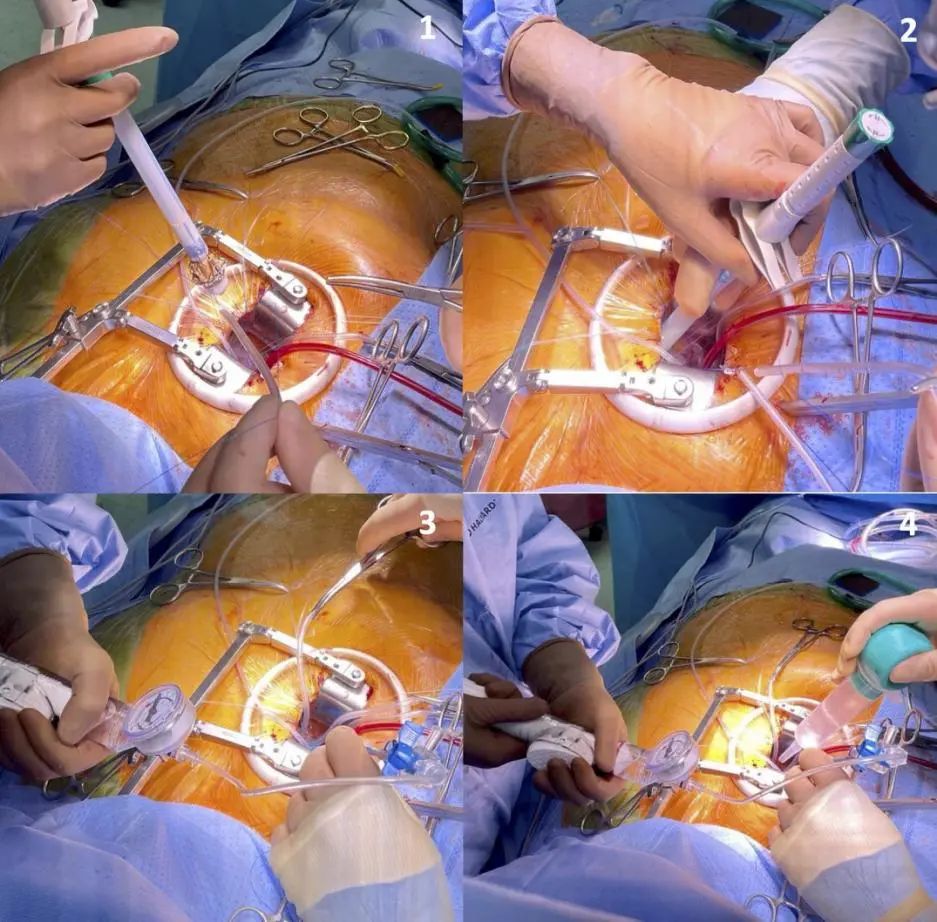
参考文献:
24. Vasanthan V, Kent W, Gregory A, et al. Perceval valve implantation: technical details and echocardiographic assessment. Ann Thorac Surg 2019; 107: e223–e225.
25. Poltak J. 2021 and 2022 Sutureless Summit – Portland, Maine: presentation on echocardiographic insight,https://vimeo.com/351623957/ee081c00c9?share=copy (2022, accessed 23 May 2023).
26.Badia S, Berastegui E, Camara ML, et al. Perceval S and coronary artery bypass grafting, contradiction or full harmony? J Clin Exp
27. Thalji NM, Suri RM, Daly RC, et al. The prognostic impact of concomitant coronary artery bypass grafting during aortic valve surgery: implications for revascularization in the transcatheter era. J Thorac Cardiovasc Surg 2015; 149: 451–460.Cardiol 2016; 7(11_Suppl): 26.
28.Lamberigts M, Szecel D, Rega F, et al. Sutureless aortic valves in isolated and combined procedures: thirteen years of experience in 784 patients. J Thorac Cardiovasc Surg. Epub ahead of print 06 October 2022. DOI: 10.1016/j.jtcvs.2022.09.053.
29.Santarpino G, Berretta P, Kappert U, et al. Minimally invasive redo aortic valve replacement: results from a multicentric registry (SURD-IR). Ann Thorac Surg 2020; 110: 553–557.
30.Solinas M, Bianchi G, Chiaramonti F, et al. Right anterior mini thoracotomy and sutureless valves: the perfect marriage. Ann Cardiothorac Surg 2020; 9: 305–313.
31. Andreas M, Berretta P, Solinas M, et al. Minimally invasive access type related to outcomes of sutureless and rapid deploy ment valves. Eur J Cardiothorac Surg 2020; 58: 1063–1071.
32. Di Bacco L, Miceli A and Glauber M. Minimally invasive aortic valve surgery. J Thorac Dis 2021; 13: 1945–1959.
33. Jug J, Štor Z and Geršak B. Anatomical circumstances and aortic cross-clamp time in minimally invasive aortic valve replacement.Interact Cardiovasc Thorac Surg 2021; 32: 204–212.
34.Lio A, Miceli A, Ferrarini M, et al. Mitral valve repair and aor tic valve replacement with sutureless prosthesis implantation through a right minithoracotomy. Multimed Man Cardiothorac Surg 2017: 2017.
35. Minh TH, Mazine A, Bouhout I, et al. Expanding the indication for sutureless aortic valve replacement to patients with mitral dis ease. J Thorac Cardiovasc Surg 2014; 148: 1354–1359.
36. Lio A, Miceli A, Ferrarini M, et al. Minimally invasive approach for aortic and mitral valve surgery. Eur J Cardiothorac Surg 2016; 50: 1204–1205.
37.Mazine A, Minh TH, Bouchard D, et al. Sutureless aortic valve replacement in the presence of a mechanical mitral prosthesis. J Thorac Cardiovasc Surg 2013; 146: e27–e28.
38.Baghai M, Glauber M, Fontaine R, et al. Clinical outcomes after implantation of a sutureless aortic bioprosthesis with concomitant mitral valve surgery: the SURE-AVR registry. J Cardiothorac Surg 2021; 16: 154.
39. Mazine A, Vistarini N, El-Hamamsy I, et al. Sutureless aortic valve replacement in the setting of triple-valve surgery.Innovations 2015; 10: 291–293.
40.Lio A, Miceli A, Ferrarini M, et al. Perceval S valve solution for degenerated freestyle root in the presence of chronic aortic dis section. Ann Thorac Surg 2016; 101: 2365–2367.
41. Concistrè G, Farneti P, Miceli A, et al. Sutureless aortic biopros thesis in severe aortic root calcification: an innovative approach. Interact Cardiovasc Thorac Surg 2012; 14: 670–672.
42. Schaefer AK, Oeser C, Kocher A, et al. Implantation of a suture less bioprosthesis without guiding sutures in a heavily calcified aortic root. J Card Surg 2018; 33: 103–104.
43.Gilmanov DSh, Solinas M, Kallushi E, et al. Sutureless aortic valve replacement for aortic incompetence. J Card Surg 2015;30: 391–395.
44.Glauber M, Kent WDT, Asimakopoulos G, et al. Sutureless valve in repeated aortic valve replacement: results from an international prospective registry. Innovations 2021; 16: 273–279.
45. Lio A, Miceli A, Solinas M, et al. Initial experience with suturelessSorin Perceval S aortic prosthesis for the treatment of prosthetic valve endocarditis. Thorac Cardiovasc Surg 2015; 63: 501–503.
46.Murzi M, Cerillo AG, Gilmanov D, et al. Exploring the learning curve for minimally invasive sutureless aortic valve replacement. J Thorac Cardiovasc Surg 2016; 152: 1537–1546.
47. Glauber M, Moten SC, Quaini E, et al. International expert con sensus on sutureless and rapid deployment valves in aortic valve replacement using minimally invasive approaches. Innovations 2016; 11: 165–173.
48. Szecel D and Meuris B. Long-term outcome with sutureless
valves: 12 years of Perceval experience. Ann Cardiothorac Surg 2020; 9: 322–324.
49. Suri RM, Javadikasgari H, Heimansohn DA, et al. Prospective US investigational device exemption trial of a sutureless aortic bioprosthesis: one-year outcomes. J Thorac Cardiovasc Surg 2019; 157: 1773–1782.
50. Fischlein T, Folliguet T, Meuris B, et al. Sutureless versus conven tional bioprostheses for aortic valve replacement in severe symp tomatic aortic valve stenosis. J Thorac Cardiovasc Surg 2021; 161:920–932.
51.Dokollari A, Ramlawi B, Torregrossa G, et al. Benefits and pit falls of the Perceval sutureless bioprosthesis. Front Cardiovasc Med 2022; 8: 789392.