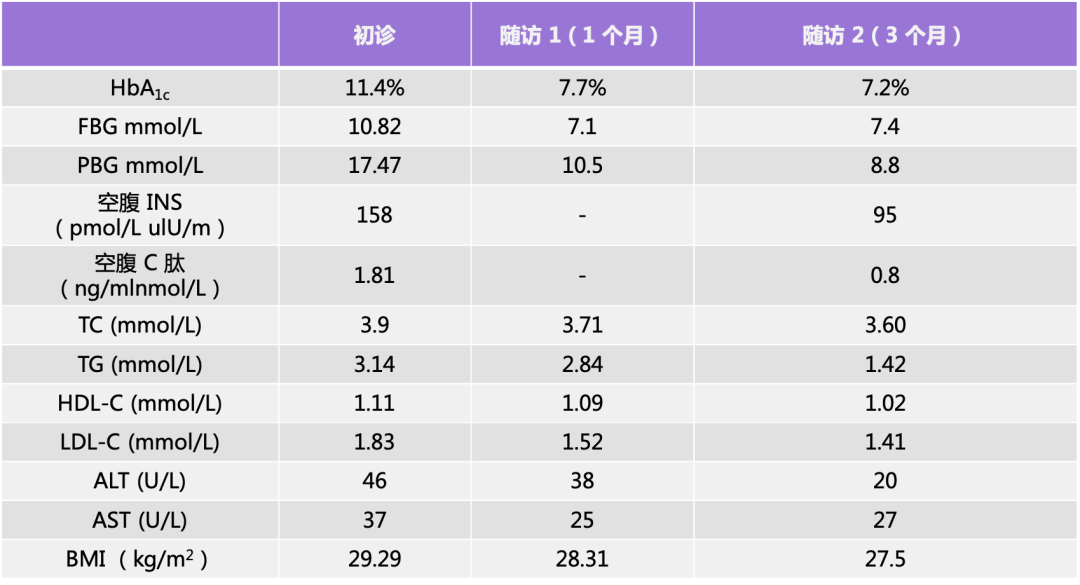
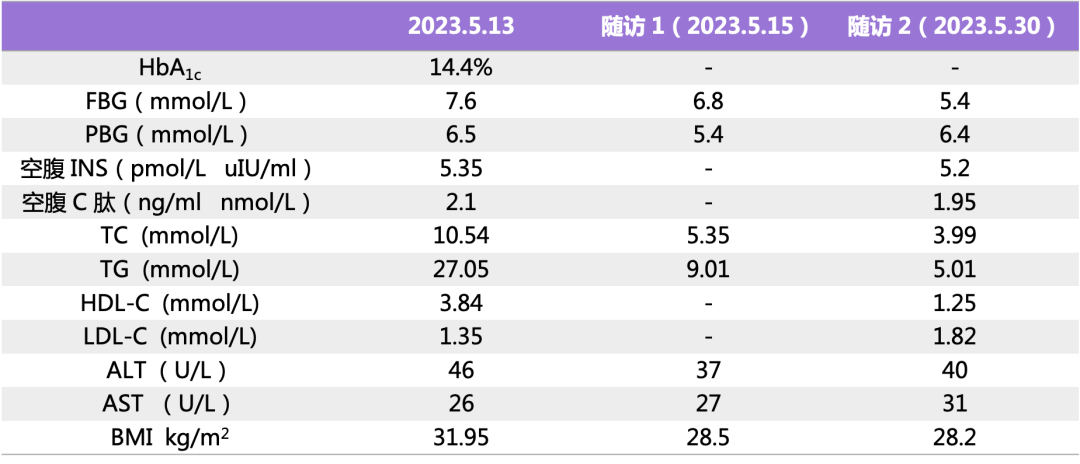
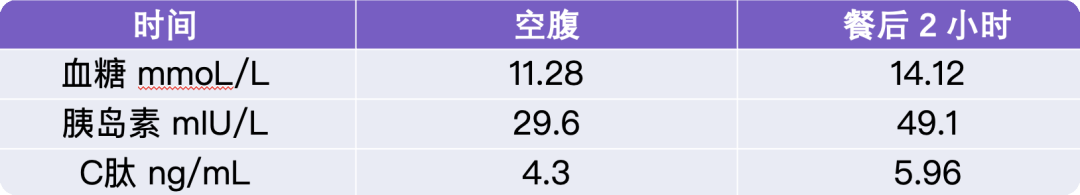
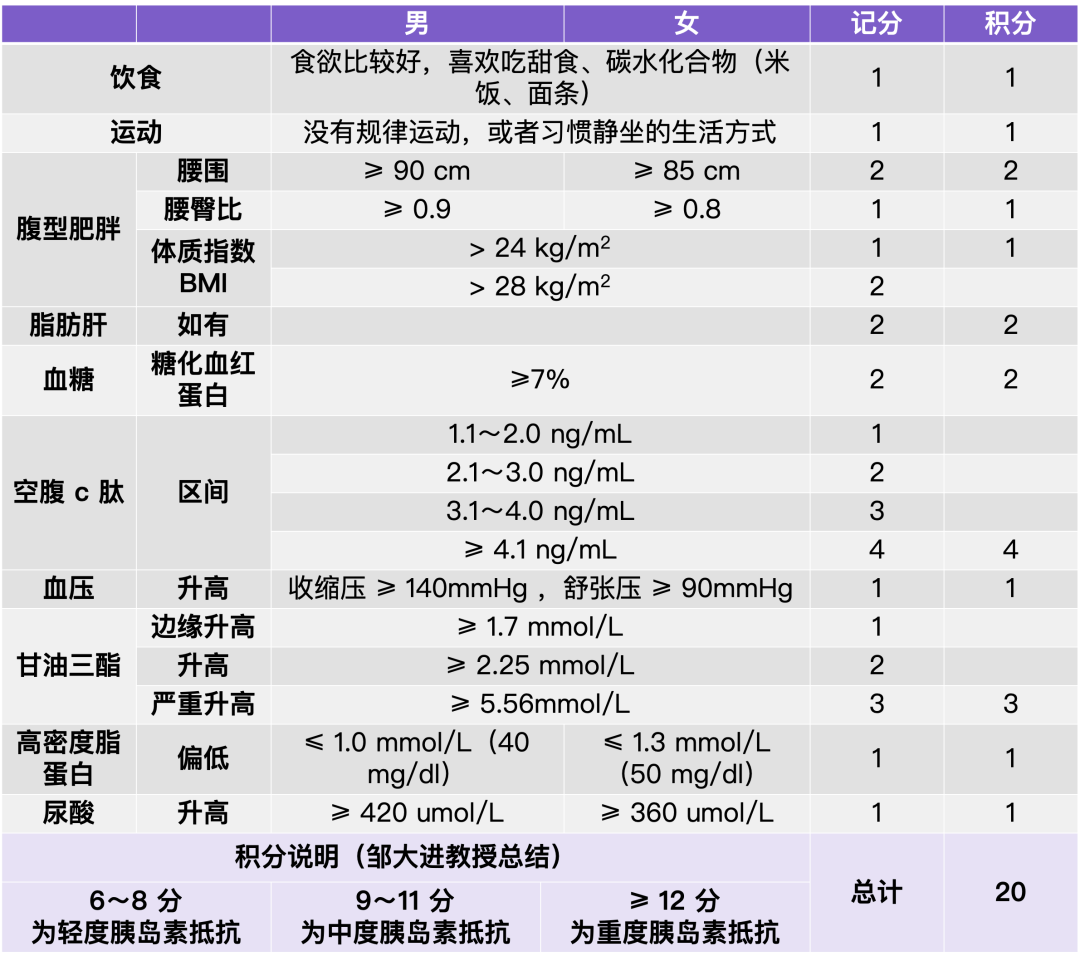
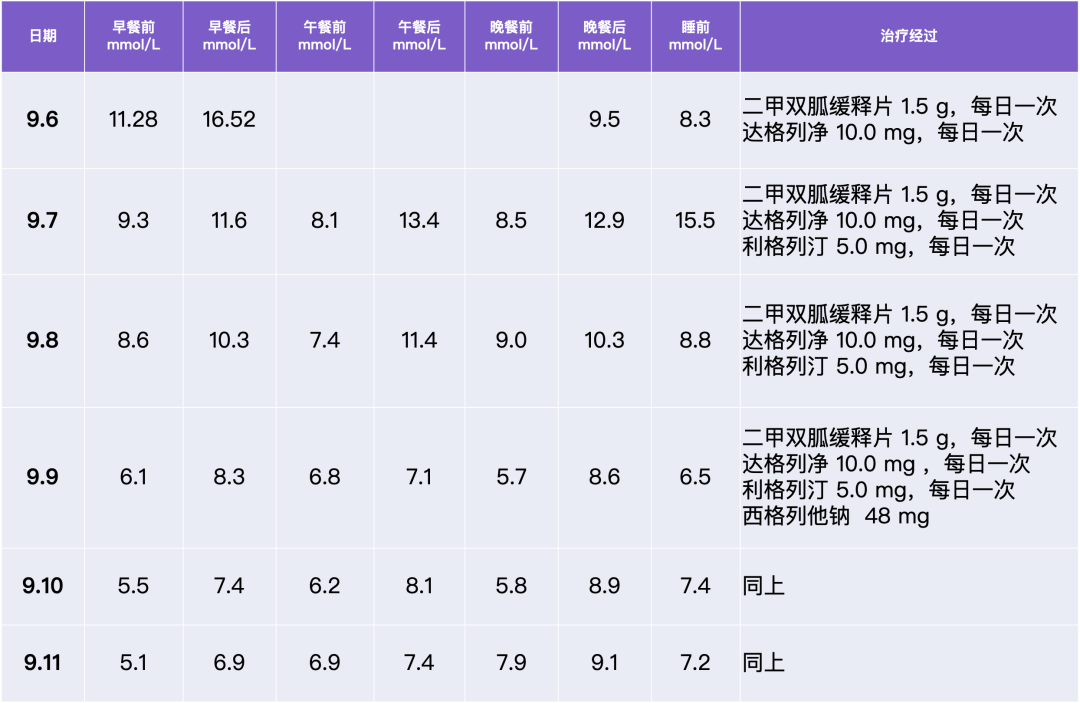
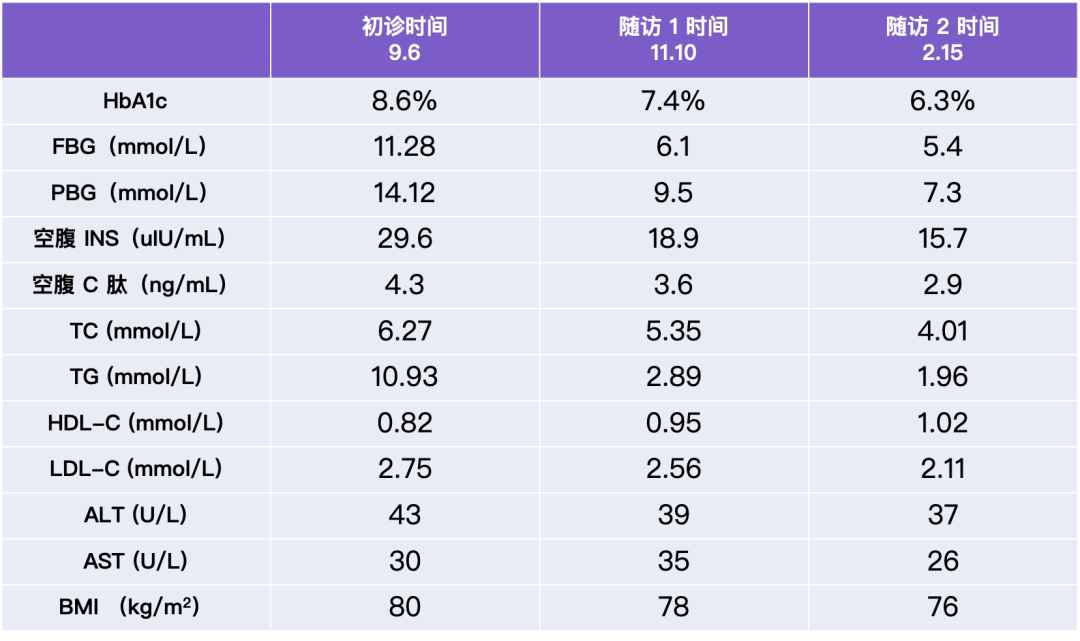
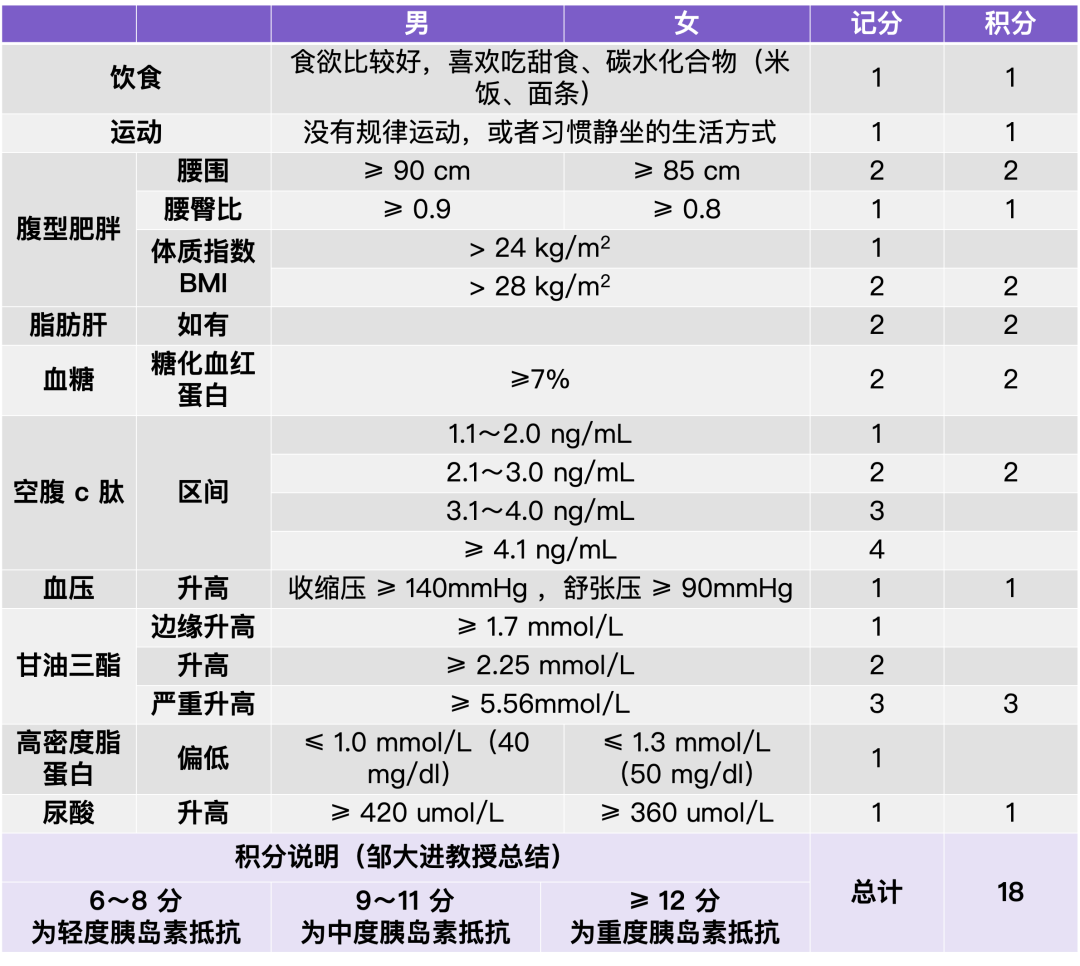
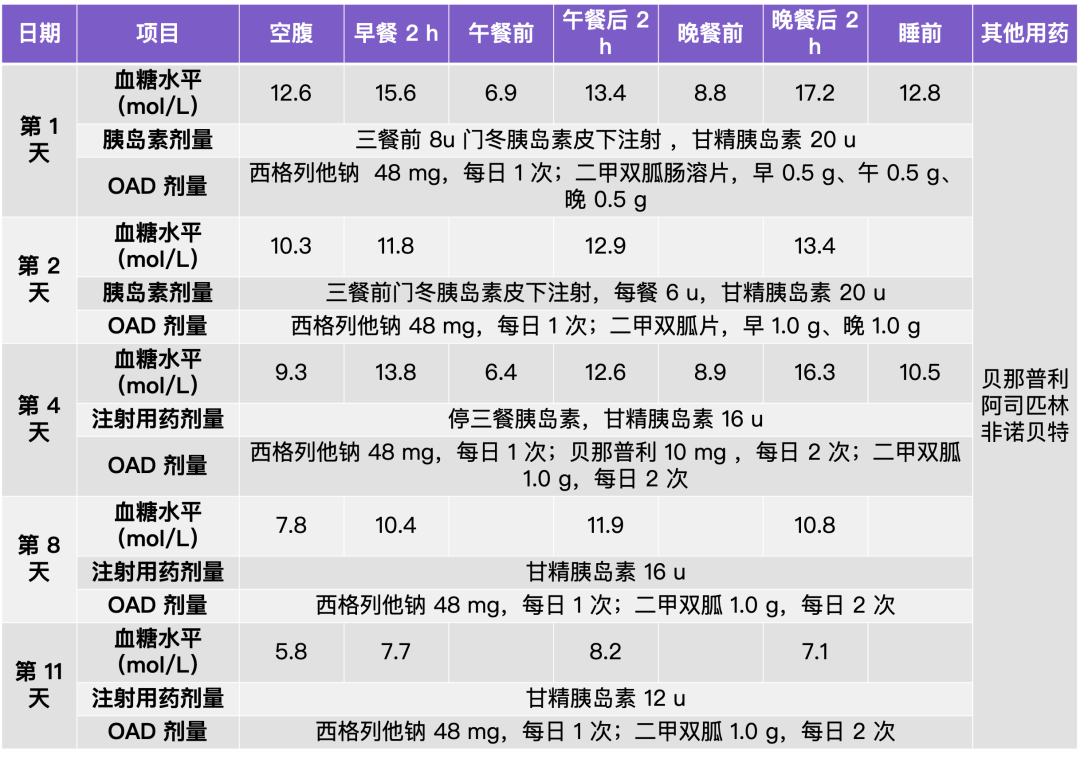
梦与叶 —— 张健君&芭芭拉·爱德斯坦
Leaves of Dreams
Zhang Jian-Jun & Barbara Edelstein
上海狮語画廊 Leo Gallery Shanghai
艺术家|Artists
张健君 Zhang Jian-Jun
芭芭拉·爱德斯坦 Barbara Edelstein
策展人|Curator
沈奇岚博士 Dr. Shen Qilan
展期|Duration
2023.11.04-2024.1.07
地点|Venue
武康庭|上海徐汇区武康路376号,狮語画廊
Ferguson Lane|Leo Gallery, 376 Wu Kang Road, Xuhui District, ShanghaiXuhui District, Shanghai
对话艺术家 |芭芭拉·爱德斯坦
沈奇岚博士:您能向观众介绍一下自己吗?因为我只知道您来自加利福尼亚。
芭芭拉:我来自加利福尼亚州的洛杉矶,后来搬到纽约居住,在隶属于纽约现代美术馆(MoMA)的 P.S.1 工作室的创作。我成长于一个艺术家庭,但我学习的是艺术、生物和舞蹈。我一生都在从事艺术。我认为艺术是我生命的一部分。

芭芭拉·爱德斯坦在工作室
沈奇岚博士:据我所知,您特别喜欢自然,您对自然的迷恋是如何开始的呢?
芭芭拉:我是在加利福尼亚州的好莱坞山丘里长大的,山是我生活需要的一部分。我发现自然其实就是这个世界,我们生长在自然中,所以我们没有办法远离自然。所以对我来说,这就是与世界的联系。当我看着大自然,看着树木、树叶、岩石的时候,我就会想到森林。森林就是世界,是一个微观世界,也是宇宙宏观世界的一部分。这是我与我们有生命的星球、有生命的宇宙和世界能量的联系。
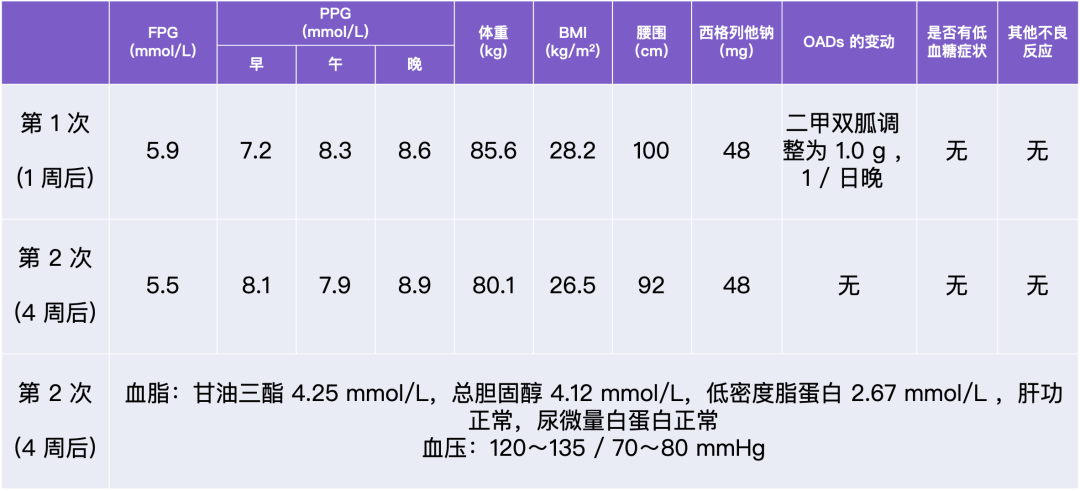
芭芭拉·爱德斯坦
《空气中的叶 (系列)》,2020
宣纸水墨
70 x 69cm
沈奇岚博士:在这次展览中,您带来了两个美丽的系列作品,能给我们详细介绍一下吗?《神秘花园》 和《空气中的叶》?
芭芭拉:我这辈子一直在做雕塑。在这一点上,我观察叶子和树木已经观察了很久,有点像我在看它们,但它们也在看我,我们已经成为一个整体,没有分别,这是一种不可分割的联系。当我做雕塑或绘画时,我的整个存在和意识都在将它们表达出来。我在创作新的树叶,创作树,我创造的这些形式和在大自然里发现的一样,都是自然的产物。
我画的叶子来自我的内心世界,也是我如何看待世界的自我表达。这是我的艺术家的眼光,关于我是如何看待世界,如何与世界沟通。

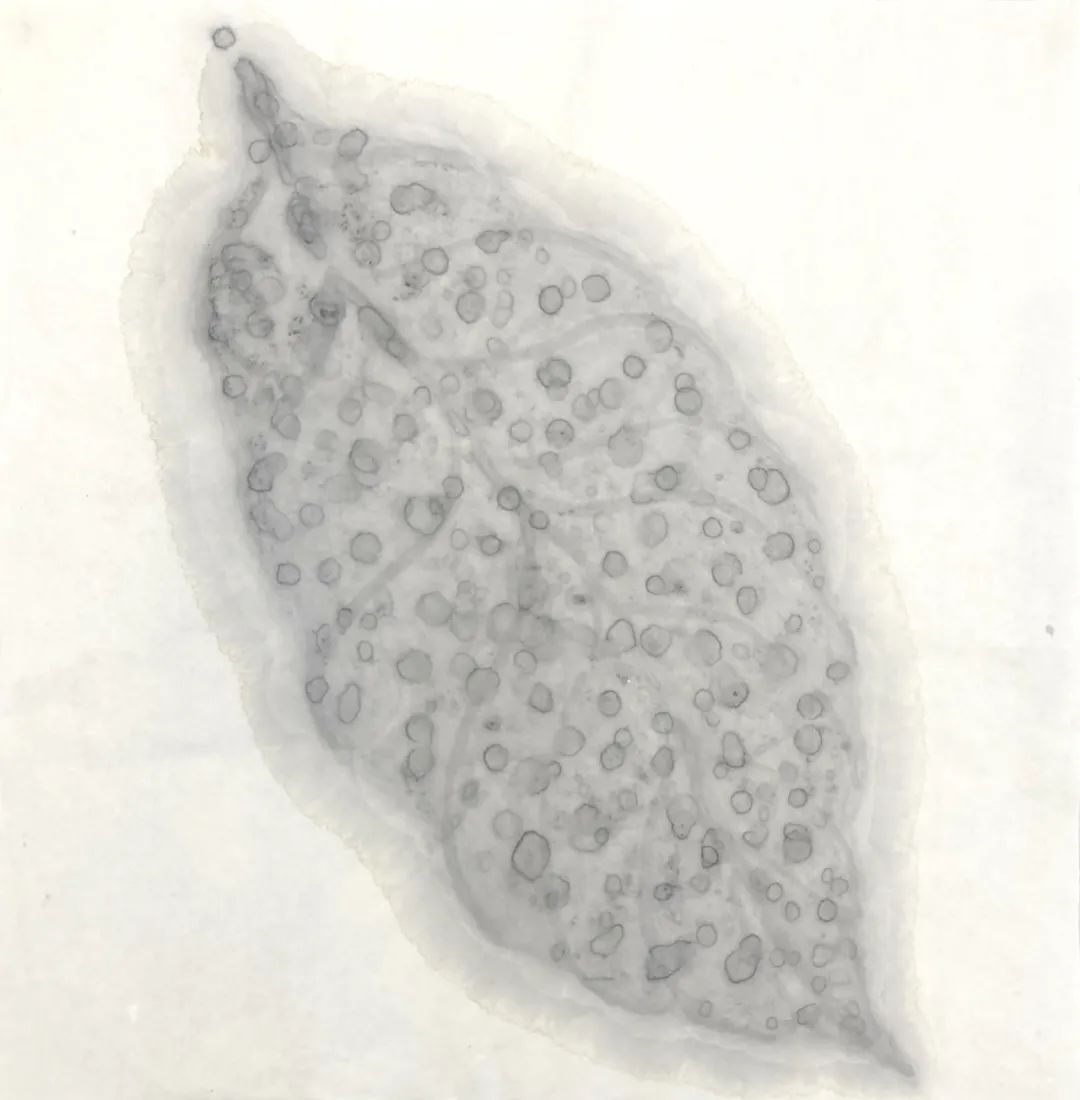
芭芭拉·爱德斯坦
《空气中的叶 (系列)》,2021
宣纸水墨
164 x 124cm
沈奇岚博士:看你身后的这幅《空气中的叶》,我想在自然界中是没有这样的树叶的。所以你并不是想去传达一种自然界的树叶是吗?
芭芭拉:对,我并不是想去直接复刻自然中的树叶。就像我说的,我和叶紧密联系在一起,我创作这些叶子、它们生长开花的样子,创作这些树、这些雕塑、这些形态,这些都是处于我的视角,是我看世界的方式。这是一个过程,就像我在旅行时,无论在哪里我都会观察周围的事物,看到不同的东西。这些东西进入我的大脑,然后经过处理,进入我的意识,最后其中的某些东西就会留存并生长。这就是我的表达方式。在这一点上,这是我对世界的表达。

芭芭拉·爱德斯坦
《神秘花园 (系列)》,2023
铝合金
170 x 65 x 21cm
沈奇岚博士:在你的创作表达中,你是如何发展出这样的线条语言、表达方式以及叶子的形态的?你曾说过在身体中、跳舞的动作中都会有一些东西。
芭芭拉:我的创作和舞动有很大关联。我不仅是学艺术长大的,也是跳舞长大的。我曾是一名舞者,这影响了我的行为方式,以及我对这个世界的看法。这个世界上其实有很多的能量,在物理上,我们的躯体和视觉感官联系在一起,也和运动与声音相连,我们所有的感官都是我与世界互动的方式。
因此,当我做雕塑时,当我看一棵树时,当我画画时,都包含着世界能量的舞蹈,也是我们身体运动的舞蹈。这是非常重要的。我们是有形的生命,是有生命的生物。因此,这种舞蹈、这种摇摆是舞者的一种运动方式,它是身体的运动,也是树叶在风中的运动。风是来自世界的能量,当树叶摇动时,就是这种能量的体现。
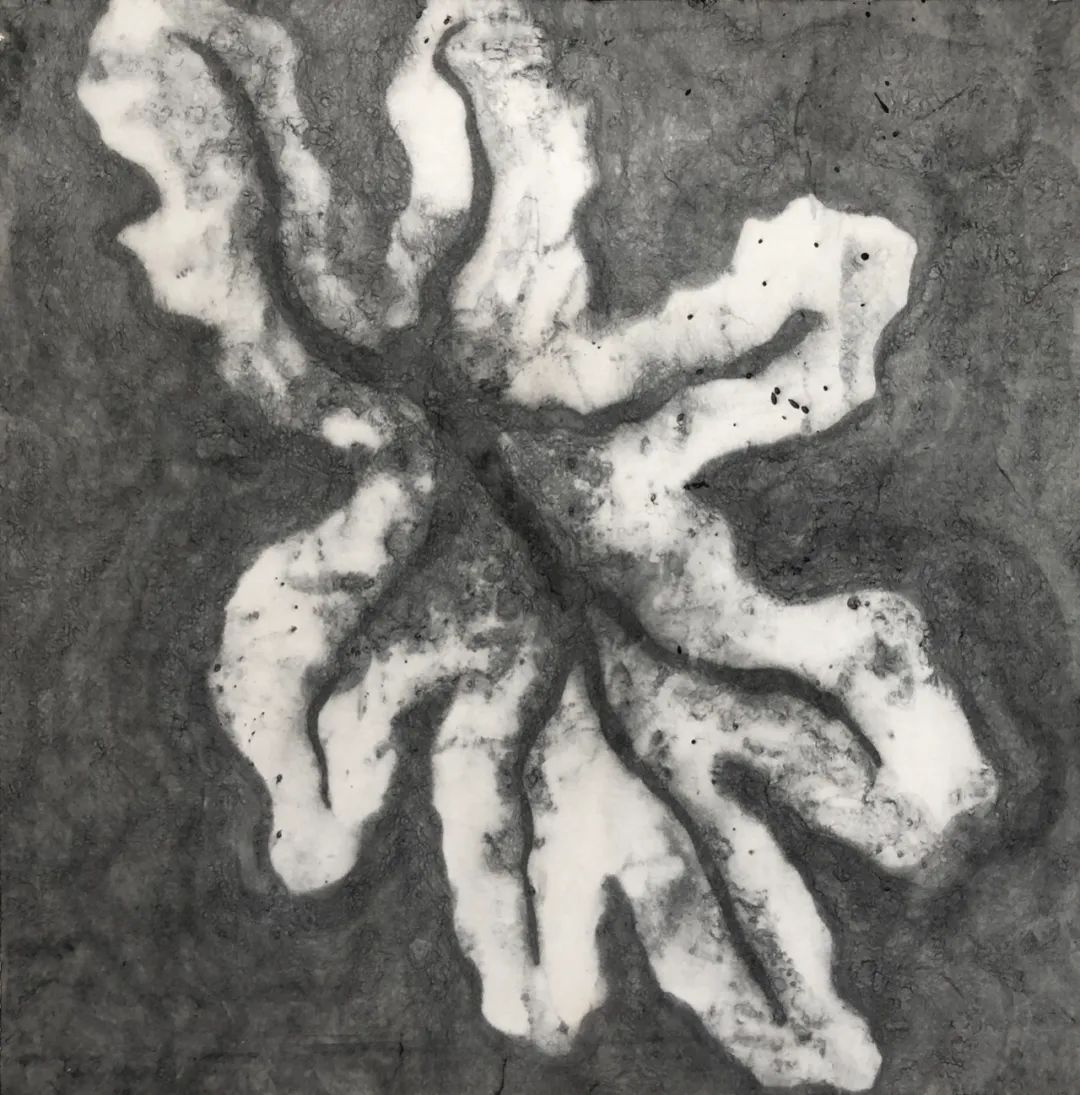
芭芭拉·爱德斯坦
《空气中的叶 (系列)》,2020
宣纸水墨
69.5 x 69.5cm
沈奇岚博士:回到您自己的故事,您从什么时候开始如此喜欢中国文化,并受到东方哲学和文化的影响?
芭芭拉:在我出生之前,加利福尼亚曾经的“垮掉派”和诗人都非常喜欢禅宗。因此,禅宗和道家思想对加州产生了巨大的影响。加州地处环太平洋地区,因此亚洲文化在加州非常盛行,这也是我在成长过程中受到的影响。
我会看中国画和日本的园林,13岁时我读了一本书叫《箭术与禅心》,书中讲述了如何在数年中研究某件事情,直至其转化为生命中不可分割的一部分,行动成为你无意识存在的一部分。那本书是关于研习箭术的,但也可以是其他任何研究,这一概念对我的影响很大。高中时,我学习了禅宗,我有信仰禅宗的表兄妹,他们是僧侣,还有一位禅师,这些都是加州文化的一部分。最终我遇到了健君,他把我带到了中国,让我有了更多的探索机会。
作为一名艺术家,我一直都在使用水墨作画。而当我来到中国后,水墨就更多的成为我的一种探索。我了解到了八大山人,我觉得他的构图方式、空间布局都很棒。画面空白之处不是空的,而是留白,这与西方人将其称为 "负 "空间的观点不同。

展览现场
沈奇岚博士:除了八大山人,还有其他你觉得非常有趣的艺术家吗?
芭芭拉:还有写草书的书法家,怀素和张旭。草书对我来说就像是舞蹈一样,这也是我非常希望能够这样做的原因。我也试着学习了一些书法,因为书法的动作和能量就是通过毛笔传递的,这真的令人惊叹。这是一种全身的能量,然后通过笔尖和墨水表现出来。墨也是水,水对我的作品非常重要,它也是世界的能量。它是我们的生命之源。
在发掘亚洲文化、中国文化和哲学的过程中,还有一部分是关于能量的概念。当你看到树叶和风的运动时,风就是能量,树叶随风而动,这就是这种无形力量的体现。你看到的是这股能量,是这个“气”的能量,是这个世界的“气”。我希望在绘画、雕塑、视频以及所有作品中表达的,正是世界的能量。它们如此重要,一直普遍存在于我们身边,但我们却不以为然,我想让人们意识到这一点。

展览现场
沈奇岚博士:是否有其他艺术家对您的创作产生过影响?
芭芭拉:作为一名女性,雕塑家和雕塑历来以男性为主导。但是像克莱尔·法尔肯斯坦(Claire Falkenstein)、路易丝·尼维尔森(Louise Nevelson)和路易丝·布尔乔亚(Louise Bourgeois),她们不是我的导师,但却是我的偶像。她们比我更早进入这个领域,作为女性,她们不得不更加努力。我从她们的作品中学到了很多,雕塑可以非常精致,也可以非常坚固。
很多人对女性创作的看法是她们的作品很精致,意味着脆弱,但女性的作品并非如此。女性可以很坚强,女性可以既细致又坚强,这些并不相互排斥。我做过很多装置作品,有一次我用弯曲生锈的旧钢筋、熔岩石和流水创作了一幅风景画。一位男性画廊经纪人看了这件装置作品后,并不知道是我做的,他觉得这一定是一个大男子主义者做的,因为它很有力量。后来他才知道是我做的,而我绝对不是大男子主义者。社会对女性所能做的事情的看法正在发生变化,但并没有改变。
沈奇岚博士:回到我们的展览。你对这次展览有什么期待吗?您如何看待《梦与叶》?
芭芭拉:这个展览真的很奇妙。我觉得它像是一个幻境,一个梦想,是我们能够想象,我们能够梦想的,我们能够通过我们接收到的所有印象进行探索和创造。这就是这个标题所要表达的。

展览现场
沈奇岚博士:您如何看待这次展览中与张健君的对话?
芭芭拉:我认为我们都非常关注宏观的宇宙,也就是微观世界和宏观世界的关系。我们都关注能量、宇宙宏观和身体感觉。我认为这是世界的能量,那种自然的运动。这是一种看待自然的不同方式,但它们在某种程度上都是抽象的,有的比较抽象,有的不那么抽象。我认为我们的对话始终是关于宇宙和物理世界、形而下与形而上之间的联系。
沈奇岚博士:你们是否也经常互相启发对方?
芭芭拉:是的,非常多。我们在工作中总是会有对话。我们各自工作,但也有合作,通常是各自工作,但总是会交流彼此的创作。我们有相似的审美,因此,我们的合作非常愉快。我们相互信任,或者说相互批评。我们可能会有不同意见,但我们彼此信任。

芭芭拉·爱德斯坦在工作室
沈奇岚博士:你说你们有相似或相同的审美,这是一种什么样的相似性呢?
芭芭拉:我认为这是一种评判艺术作品的方式,一种审视艺术和作品的方式。它是否有深度,它是否有灵魂,以及艺术作品应具有的审美意识。我认为作品应该来源于我们每个人的意识、灵魂、强烈的兴趣,就像健君,他关注宇宙、天空、行星,我自己则关注地球和生长着的事物,而不太关心商业世界。

展览现场
沈奇岚博士:你们两都会关心世界的未来,那你们对未来、对世界的愿景是什么?
芭芭拉:我希望会有和平吧。因为人们现在在这方面并不令人乐观,希望我的创作能给世界带来一些和平,让人们认识到我们不应该破坏世界。我们不应该互相伤害。我觉得现在这个世界并不是那么美好,而是很艰难。这个世界上有欢乐,也有悲剧,希望我们能有足够的觉悟,减少悲剧的发生。
沈奇岚博士:这就是我们举办这次展览的原因。这就是《梦与叶》。也许有一天,这个梦想会变成现实。
芭芭拉:也许吧。但我知道,在很多哲学中都会提到,你来到这个世界上就是要让这个世界比你来的时候更好。这一直是一个非常重要的观念,希望我能通过为世界增添美感,让世界变得更美好,这就是我作为艺术家对世界作出贡献的方式。其他人有其他的方式,但这是我作为艺术家的方式。让世界变得更美,为这个世界创造美,并意识到美的存在。
©文章版权归属原创作者,如有侵权请后台联系删除