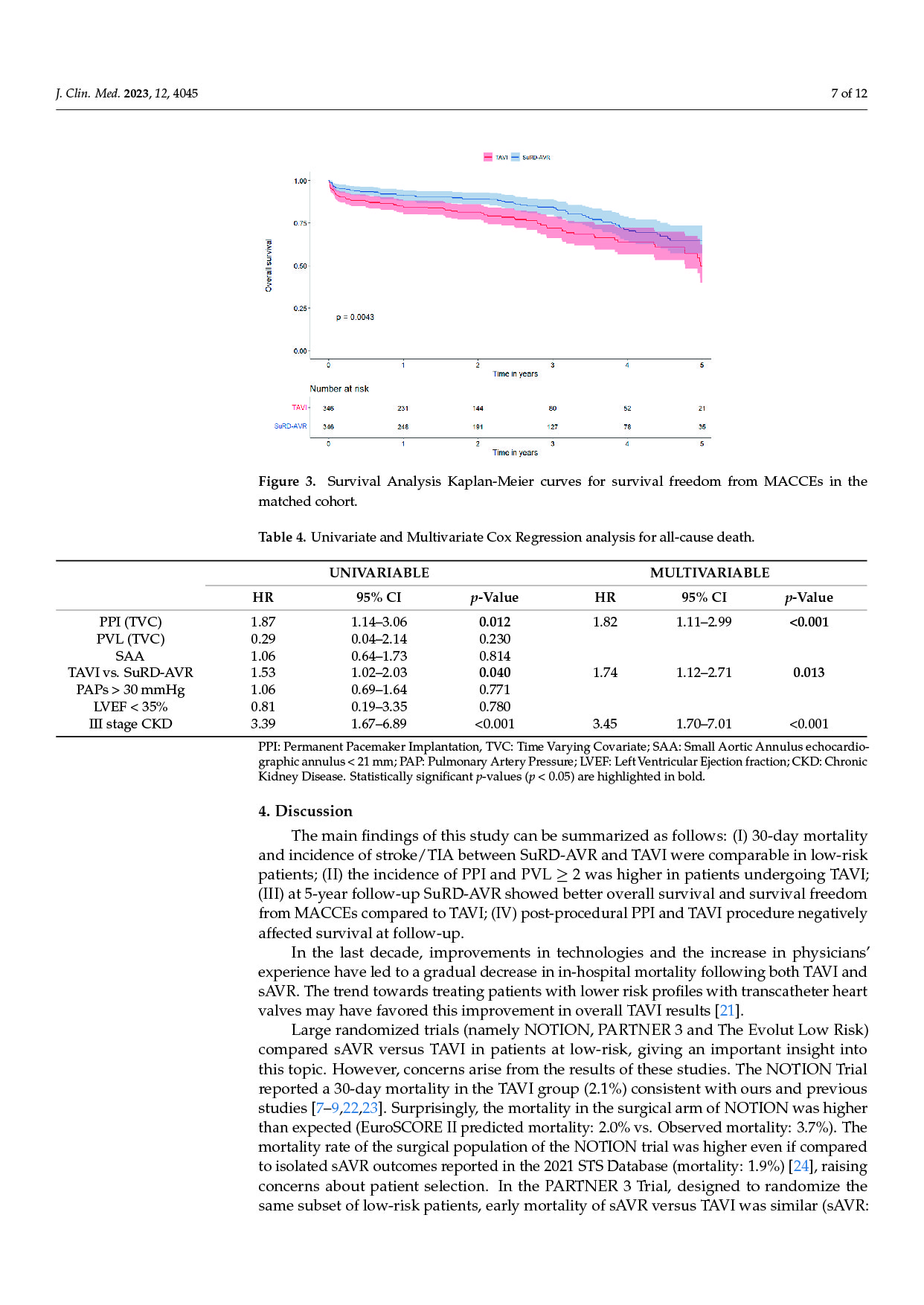
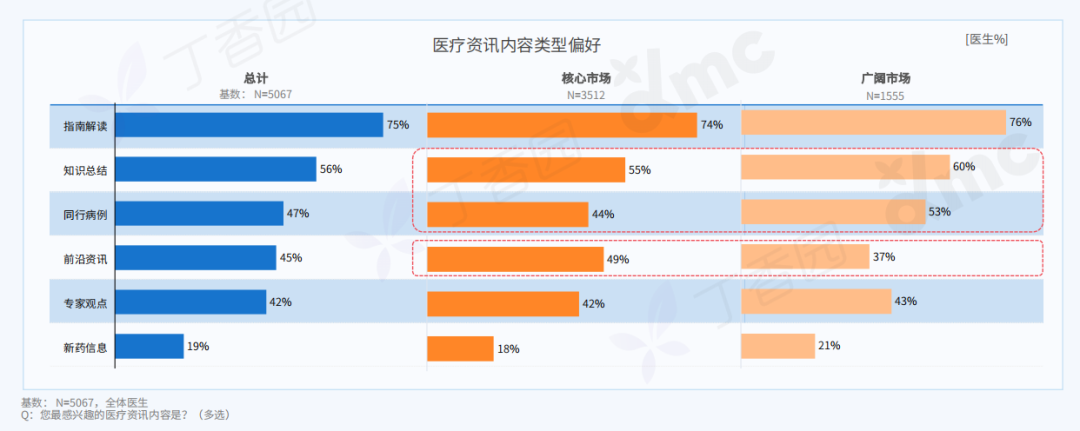
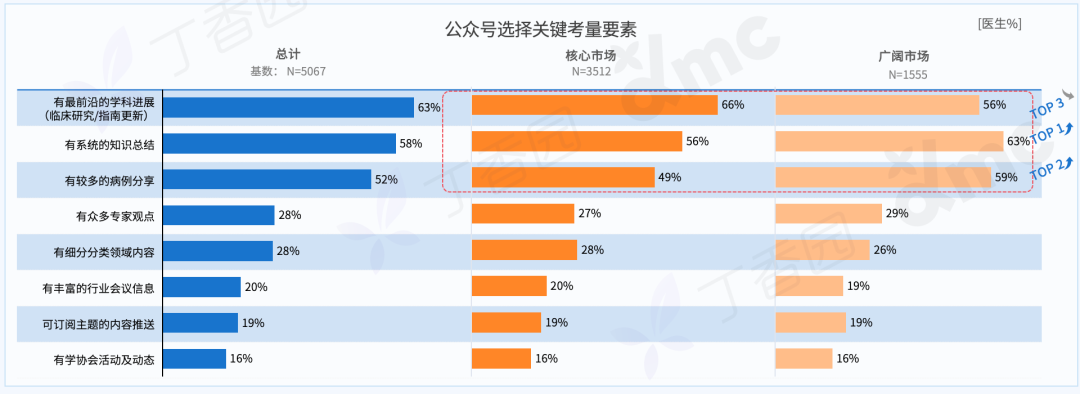
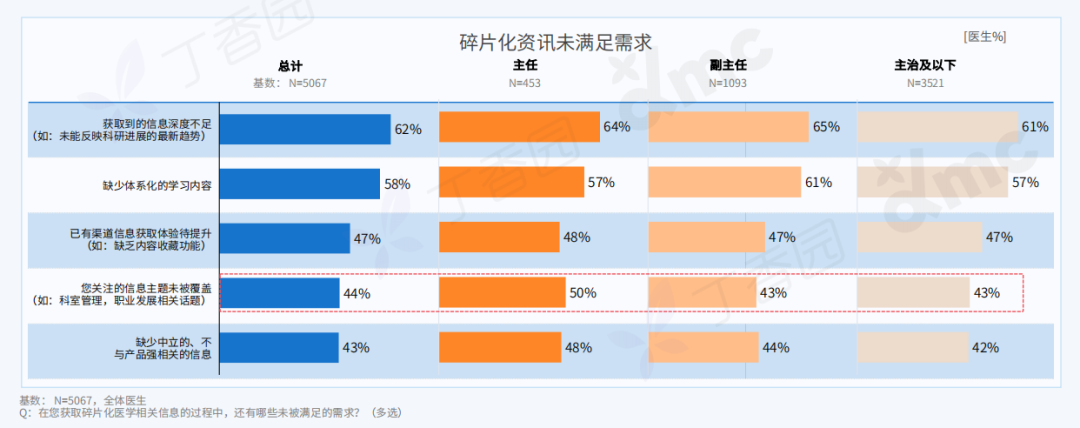
刘成瑞个展“终极社畜”正在没顶画廊展出,不间断地呈现现场行为表演,并以此串联起展出的文本、影像、摄影和绘画作品。在与画廊进行的如下对谈中,刘成瑞具体阐释了他通过作品所探寻的精神和现实的冲突,以及两者必须和解的复杂现实。

行为现场,刘成瑞《终极社畜》2023,行为,综合媒介
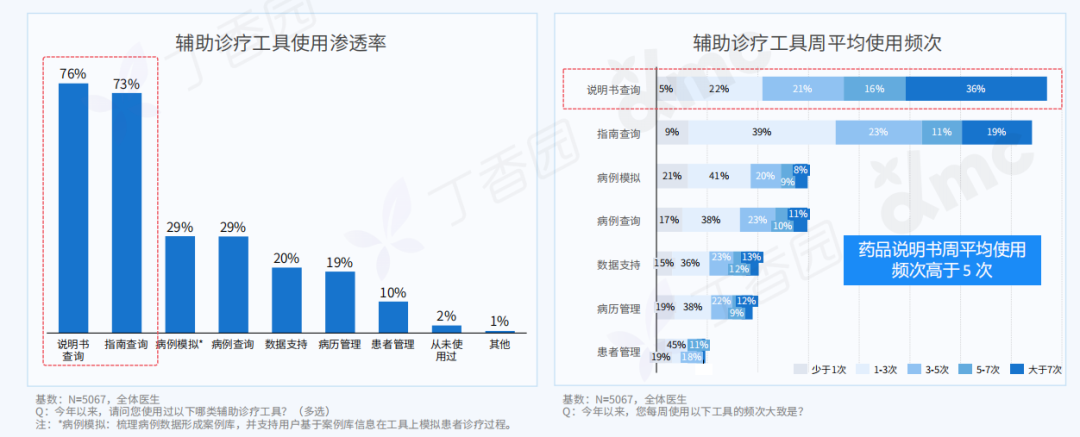
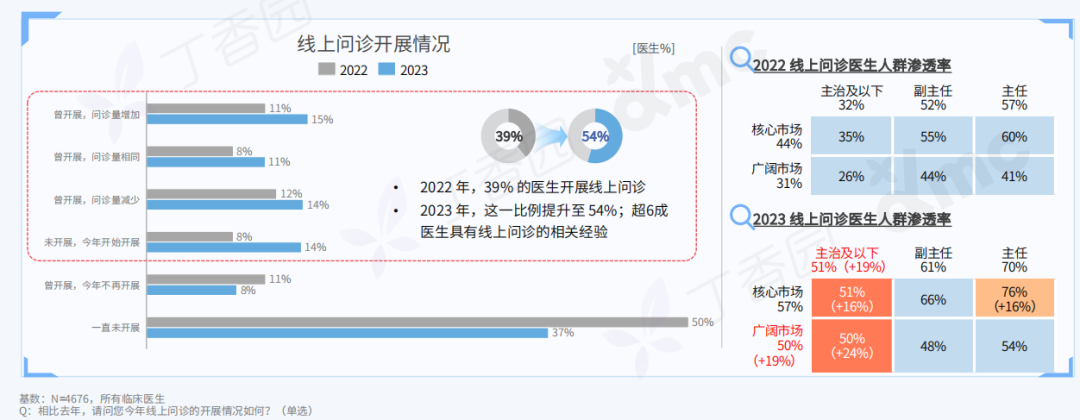
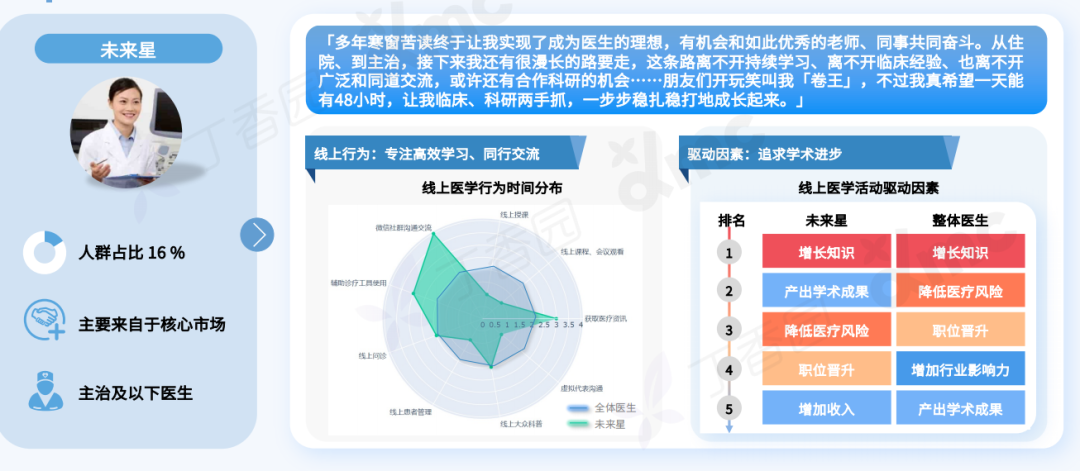
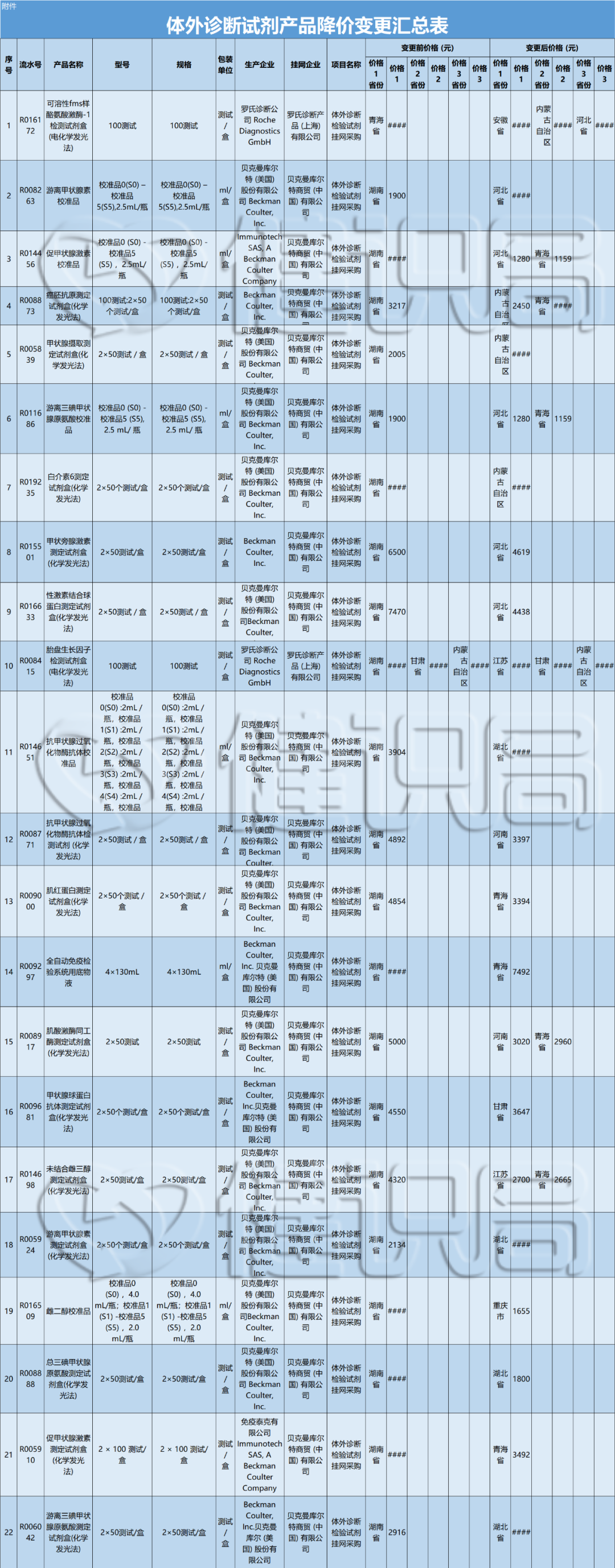
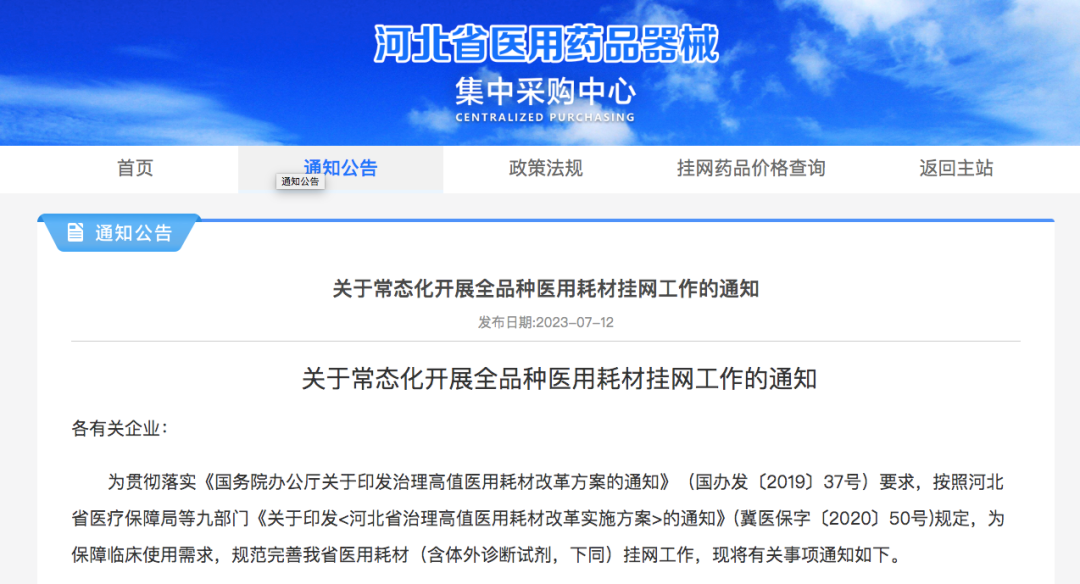
Q: 可否简单介绍下这次的展览和全新行为作品《终极社畜》?
A:这次行为的表演场地是一个红色的逗号型展台,将持续一个多月。逗号的造型意味着永远的进⾏时,也暗示着我的创作中写作的重要性。行为的第一部分是将⽪⽑形象的巨大柱体推倒,扶起来,然后⾛到逗号最⾼处缓缓举起右⼿,以宣告一次行动的完成。第⼆部分,“社畜”听到到账提示即被唤“醒”,将绿⾊丝带解下,换上红⾊丝带⾛下展台,与观众交流或为其服务。

图片展览现场,“刘成瑞:终极社畜”,没顶画廊,上海,2023
同时,我的其他代表性作品《春天进⾏曲》、《悲伤》、《一轮红日》会以摄影、文本、影像等形式在现场呈现,以及三张肖像画。这样,仪式化的行为表演与交流和交易结合,并将过往作品带到此次⾏为现场。

展览现场,刘成瑞《悲伤》2016,行为,收藏级无酸相纸、铝塑板背板、实木边框

刘成瑞《诗人》2017,布面油画,105 x 89.5 cm
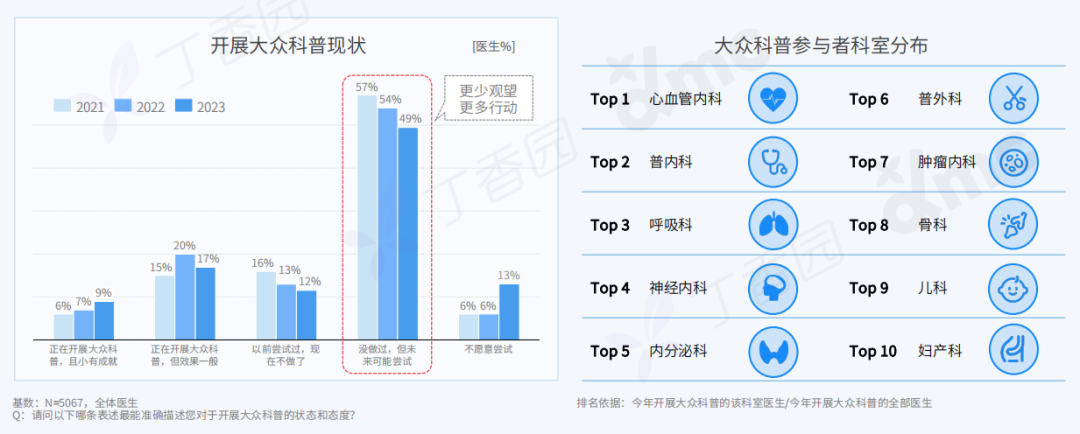
Q: 您在这次展览中最核心的兴趣点是什么?
A:精神和现实的冲突,以及两者必须和解的复杂现实。
行为表演中举起手的部分就是用同意的方式表示抵抗,其对象是资本、人的工具性或工具化,以及人不得不进入已知的有剥削存在的社会机器中这一现实。从另一方面来说,选择“社畜”和选择“躺平”是一样普通的,在“社畜”或“躺平”的同时追求抵抗和自由是难的。

行为现场,刘成瑞《终极社畜》2023,行为,综合媒介
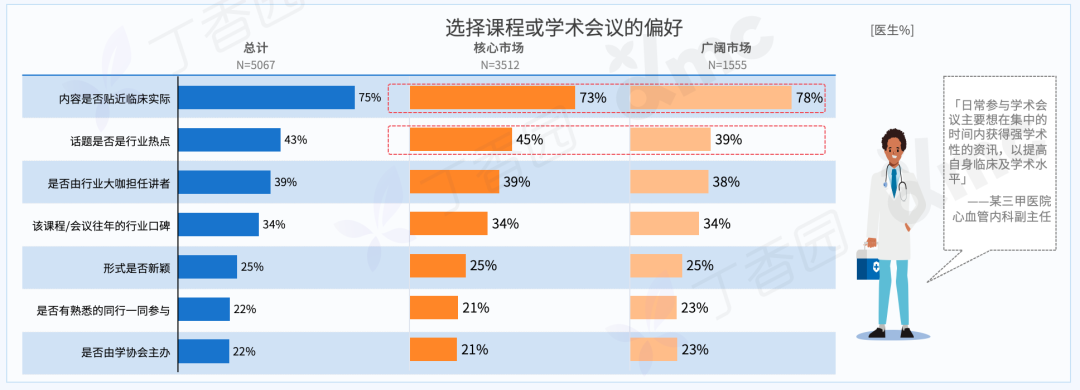
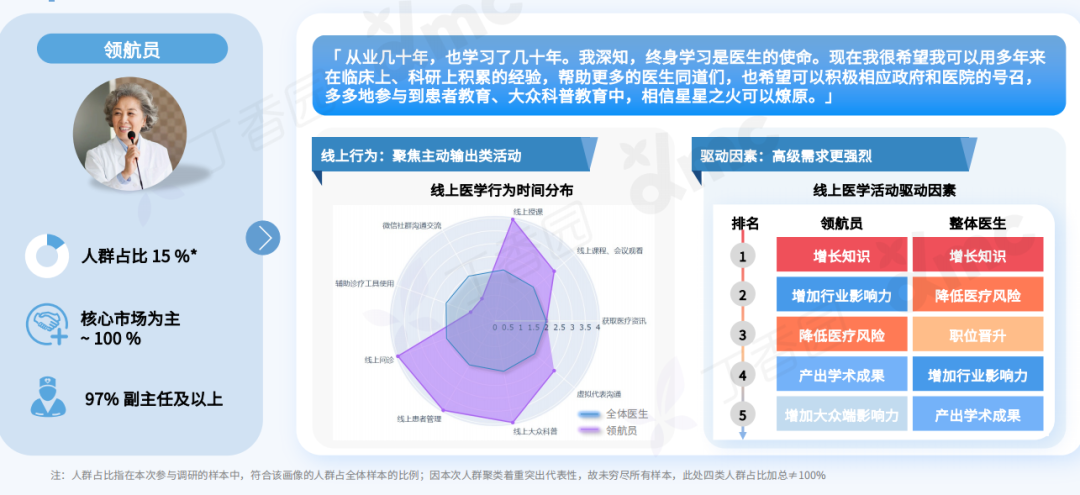
Q: 这次展览中,为什么要设置观众消费、与观众交流的环节?
A:设置收费环节是“社畜”的特性,所有的交流都是为了工作,哪怕是日常的,关乎情感的。我希望将消费的权利赋予每一个个体,任何人(观众/网友)都可以通过扫码参与到这一作品,达成交流或互动。观众消费后,我会听到微信或支付宝的收款提示音,将国内普遍的消费日常挪到作品现场中。
用仪式感反仪式感,用原教旨的方法论反原教旨,用消费反消费。因为普遍的现实是这样,而不是借艺术之名,树立一个超越于普通人的形象或一个纯化的精神现场。今年5月,在没顶美术馆的“虎口见笑”是我第一次在行为现场与观众日常交流,这次作品中我沿用这种方式,再撕裂一点,争取达到现代⼈极端分裂的精神现实。


行为现场,刘成瑞《终极社畜》2023,行为,综合媒介
消费是这件作品中最具有仪式感和痛感的环节,只有参与消费才能达成理解,没有买卖就有伤害。抵制消费也是消费,比如无偿占有,不参与价值输出。展览中的观众消费交流环节就是敞开这一通道,至少能传达这样一种信息:仪式感、痛感、意志力、艺术等等都可以通过消费消解,并获得“产品”和快感。肉身因此并不沉重,只是普通,承受所能承受的,享受所能享受的,与世界密切联系,又在孤独中自嘲自洽。没有古典主义中的牺牲和崇高,也没有后现代叛逆、解构之类能获得的成就感,只有悲伤在所难免。

展览现场,“刘成瑞:终极社畜”,没顶画廊,上海,2023

展览现场,刘成瑞《一轮红日》2015,行为,高清影像,3分27秒
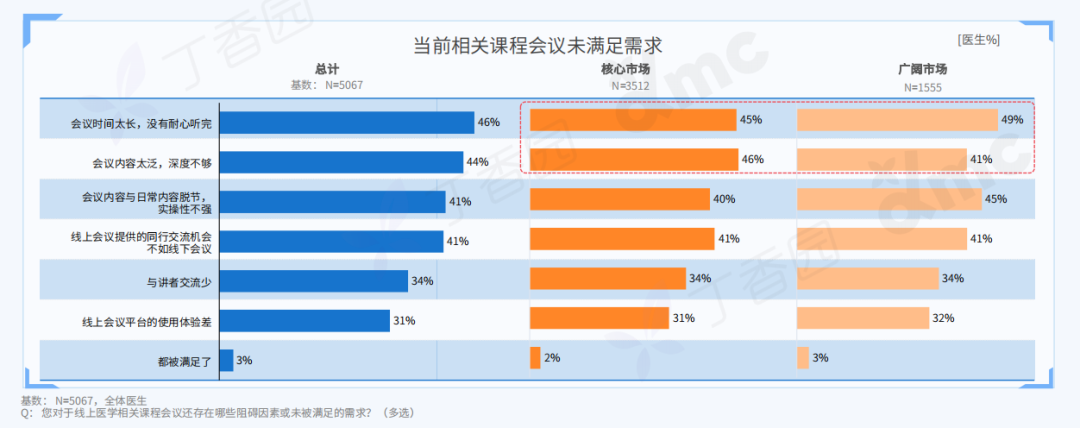
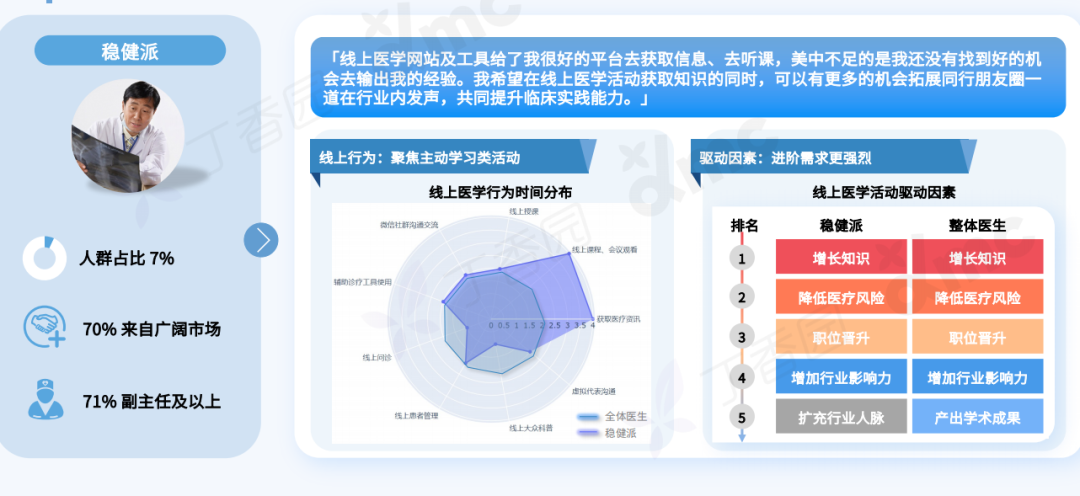
Q: 您认为这次的作品对于行为艺术史有哪些突破或创新?
A:对一门艺术语言来说,唯一能称为贡献的就是对语言边界的开拓。从克莱因到阿布拉莫维奇;谢德庆和提诺-赛格尔共存的“行为艺术”的现实语境中,不管是表演还是行动,都是极为仪式化的,秉承着艺术来自巫术,只有仪式化才能被人相信。
《终极社畜》将仪式化通过“消费”的方式拉到日常,将日常、消费和仪式化连接在同一现场,将表演中的身体分裂成不同的“人格”——这一点挺让我兴奋的。行为艺术有着非常复杂的语言体系,语言即观念。


行为现场,刘成瑞《终极社畜》2023,行为,综合媒介
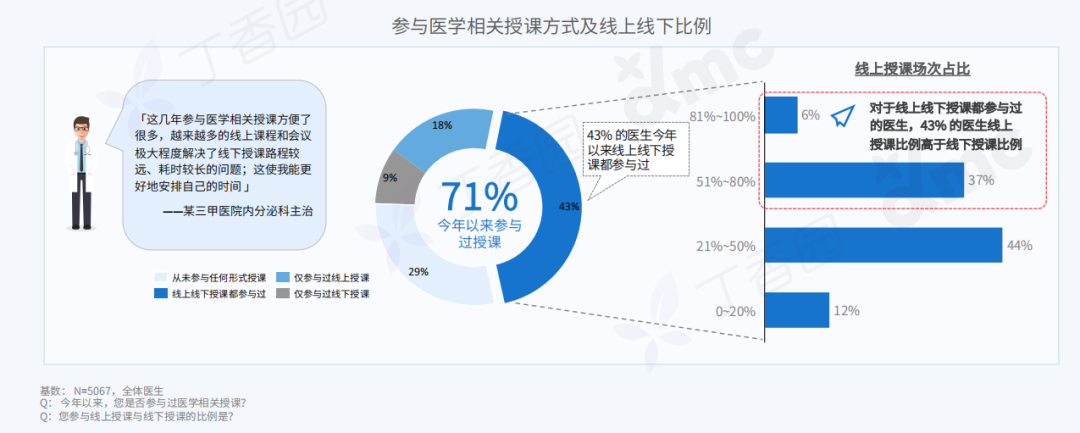
Q: 您的成长经历和文化背景,在何种程度上影响了目前创作中的身份政治叙事?
A:这个有点复杂。在当下这个带有政治文化隐喻的环境中用中文写作、穿西服表演,本身就带有一定的象征意义。回到自身,我出生在昆仑山支脉青沙山下,青海最古老的寺院之一夏琼寺就离我们村不远,儿时还在隔壁村看过班禅坐床典礼,但我小时候听到印象最深的故事却是孟姜女、薛家将,济公传奇这类。家中也是佛教和中国传统礼仪融合的,没有单一的信仰,比如,爷爷修行藏传佛教密宗,父亲是共产党员干部,伯伯是牧民又什么都不信仰。而我自己,家从农村搬到县城后看的第一本课外书是卡耐基,那时候是初中。然后从《牛虻》开始,《悲惨世界》《废都》《罪与罚》、路遥、《简爱》还有席慕容、狄金森、棉棉、巴金、下半身诗歌,哲学,尤瑟纳尔,传记……什么都读,唯独古典文化的书读的很少。我现在觉得西方著作中潜藏的基督教文化对我影响比较大,比如对“灵魂”的反复强调,以及“悲悯”的力量。



展览现场,刘成瑞《春天进行曲》2022,行为,视频、诗歌 (1001首)、铡刀、布、血稿等,尺寸可变
如果谈身份政治,我作为人肯定是站在拼搏在生存第一现场的普通人这一边的,只是我的少数民族基因和成长的地貌带给我另外一种气质,以前我有意识地回避这一点,现在我会更辩证地看待这个问题。因为我发现创作到一定阶段时,自己不是个体,而是一个群体的集合。我部分作品中对痛感的需要是为了到达人绝望感的、清脆又诗性的,不管你是否正视都存在的那一部分现实,而且是以示弱的方式,不是英雄主义的。简单来说,如果拿我的类似“付出”不跟艺术系统比,跟现实比,依然是表演。因为这一切由方案产生,有记录,有海报,有现实中的个体并没有的庆典。在这种情况下,我如果想诚恳地面对当代,只能面对复杂性,来自文化的,身份的,以及国际的。

刘成瑞《Y-Youth》2020,行为,图片,收藏级相纸艺术微喷,150 x 120 cm
©文章版权归属原创作者,如有侵权请后台联系删除