9月4日,上海医药公告,根据上海市监察委员会官网于近日公示消息,公司原副总裁潘德青,下属子公司上海上药第一生化药业有限公司原总经理陈彬华,下属子公司上海上柯医药有限公司原总经理李平涉嫌严重违纪违法,正在接受上海市闵行区纪委监委纪律审查和监察调查;上药第一生化原副总经理黄臻辉涉嫌严重违法,正在接受上海市闵行区监察委员会监察调查。公司目前尚不知悉前述人员被调查的具体原因。截至本公告披露日,上述人员均已不在公司任职。


又一个WordPress站点
9月4日,上海医药公告,根据上海市监察委员会官网于近日公示消息,公司原副总裁潘德青,下属子公司上海上药第一生化药业有限公司原总经理陈彬华,下属子公司上海上柯医药有限公司原总经理李平涉嫌严重违纪违法,正在接受上海市闵行区纪委监委纪律审查和监察调查;上药第一生化原副总经理黄臻辉涉嫌严重违法,正在接受上海市闵行区监察委员会监察调查。公司目前尚不知悉前述人员被调查的具体原因。截至本公告披露日,上述人员均已不在公司任职。


该来的总会来,附条件批准的另一只靴子落地。附条件批准绝不是降低标准!而是对此类产品需要更多的监管和科学评价。
“一切都变得明晰起来”,“非常赞赏我国药监部门与时俱进、科学监管的水平”,“感觉比预期的更快一些”,“卡得这么快、这么严,超过了预期”……
近日,国家药监局发布《药品附条件批准上市申请审评审批工作程序(试行)(修订稿征求意见稿)》,其中明确附条件批准前就要开启确证性研究,4年内完成确证性研究,某药品获附条件批准上市后,原则上不再同意其他同机制、同靶点、同适应症的同类药品开展相似的以附条件上市为目标的临床试验申请……不少业内人士在赞赏监管部门科学监管效率大幅提升、进一步支持差异化创新的同时,也担心部分企业尚未做好适应新准则的准备。
曾经因花钱少,上市快等利好,被不少企业利用的得心应手的附条件加速通道,当要求提高、路口变窄,甚至有可能在同机制、同靶点、同适应症的同类药品只有一家企业能够享受到该政策福利的时候,一个时代结束了。
“花钱少,上市快”的最佳通道
旨在缩短临床药物试验时间,使重大疾病患者获得最新治疗药物的附条件批准,由于可以基于替代终点、中间临床终点或早期临床试验数据等申请附条件批准上市;以及只要审评通过附条件批准药品上市的,便能获得药品注册证书,这个差不多可以省“1-2个三期的钱和时间”的最佳通道,自一开通,便备受企业青睐。
一定程度上,附条件批准加速了我国医药领域创新浪潮的到来。
从2014年西达本胺开始,到2019年帕博利珠单抗注射液、特瑞普利单抗注射液、信迪利单抗注射液、注射用卡瑞利珠单抗、替雷利珠单抗注射液,均获得过附条件批准通道。至2020年7月,随着新药品管理法的出台,设立突破性治疗药物、附条件批准、优先审评审批、特别审批4个加速通道,并明确了可以申请附条件批准的3种情形。自此,附条件批准开始更快的运转起来。
回看该程序正式运营的3年,也是我国创新药项目大爆发的3年,期间我国共上市了145款创新药,尤其是在些急需用药方面,让我国快速拉平了与国外药物的供应。
据不完全统计,至2022年我国共有84款药物(含适应证)获得了附条件批准。其中不乏国内知名Biotech公司的重磅产品。例如,贝达的盐酸恩沙替尼胶囊,百济神州的泽布替尼胶囊,艾力斯的甲磺酸伏美替尼片,荣昌生物的泰它西普,康方生物的卡度尼利单抗注射液等都悉数在列。
而这用“快”可以代表了一切的3年,问题也层出不穷。
一方面,附条件批准产品的治疗领域分布较为集中。肿瘤领域占据了大半达66.79%,其它分布在血液系统疾病、新冠、抗感染、内分泌以及免疫领域。
如果除去肿瘤药天然更符合附条件批准的宗旨要求这一影响因素外,让业内颇为诟病的是,肿瘤领域涌现了不少同靶点、同适应症的项目纷纷通过这一通路上市,不仅占用大量的临床资源,也浪费了药企资金。
如此前以PD-1为代表的热门靶点,吸引了上百项临床试验,同质化的临床项目和研发一度被业内人士吐槽“PD-1未来可以洗澡了”。再如KRASG12C突变,国内该靶点已有超过12款管线进入临床阶段,而携带该靶点的国内患者每年仅新发约3-4万人,可以明显的预见排序靠后管线的注册和商业化前景很难如愿。
但是对于身处创新加速浪潮中的企业而言,一旦看到同行开始加速,便会想尽办法跑得更快。
设计简单易行,患者入组少,临床费用低,较随机对照试验相比平均可缩短2年上市时间的单臂试验注册开始大量涌现。同时,由于没有明确确证性试验完成的时间节点,一种令人担忧的风气正在形成,部分企业将“附条件批准”视同完全批准,后期的确证性研究止步不前。一名资深注册人员透露,“虽然企业知道迟早有一天关于确证性研究需要做,但不排除一些企业不想投入大成本去做,想利用相关条款钻空子,消极拖延”。
明确而坚定的支持差异化创新
不过该来的总会来。“附条件批准的另一只靴子落地了”,一位资深注册人员在接受E药经理人采访时感慨道。
“其实根据CDE相关工作人员发表的关于附条件批准的研究文章,以及CDE发布单臂适应性指导原则的出台,都透露出国家监管部门将对附条件批准开始逐渐‘收紧’的信号。随着第一批附条件批准交作业时间逼近业内已经开始讨论确证性试验到期该如何应对的话题” 附条件批准所面临的挑战,不只是我国,其他国家也有,比如美国。我国此次发布的意见稿的内容综合了FDA和欧盟的经验,非常期待意见内容践行落地。
令不少注册人员欣喜和赞赏的是,意见稿的出台让一切开始变得明确、清晰、规范起来。
例如此次意见稿明确提出,确证性试验在附条件批准前已经启动(以首例受试者入组为标准),并强调确定性试验完成时间为4年,这就相当于杜绝了企业拖延确证性试验思潮的蔓延。同时,此项规定也有望进一步避免临床不佳的药品被持续性使用的现象,减少了部分项目在获得附条件批准后,因入排标准设定较高,或者竞品太多,无法招募患者等因素,确证性试验耗时超过原定期限而无奈撤回的情况。
意见也回答了无法按期完成所附条件研究的,可以申请继续开展研究的情况。意见明确提出,所附条件的药物临床试验至少已完成全部受试者入组。“这样明确的要求从监管和行业来讲都很高效,不存在彼此的理解不同进而花更多资源去沟通,行业也会基于要求合理安排好所有计划。”武田大中华区注册事务负责人副总裁刘艳玮分析道。
更为重要的是,意见稿提高药品附条件批准门槛,让行业看到国家药监部门,鼓励差异化创新的决心。
如果将2021年CDE发布的《以临床价值为导向的抗肿瘤药物临床研发指导原则》是国家是药监机构开始呼吁研发同质化减速的开始,那么这次意见稿的发布则可谓是遏制研发同质化的又一次刹车,是一个行业发展的又一个里程碑。
此次意见稿中提出,某药品获附条件批准上市后,原则上不再同意其他同机制、同靶点、同适应症的同类药品开展相似的以附条件上市为目标的临床试验申请。
这条内容成为业内人士争论最多,也被视为对当下热门靶点研发企业杀伤力最大的一条。不少业内人士呼吁,只有一家获得资格太过严苛,“不要一棒子打死,至少3家还差不多,毕竟先获得的并非是最好的”。但是无论如何,追求低风险的追随式同质化创新红利窗口已经关闭,曾经信迪利单抗注射液、注射用卡瑞利珠单抗、替雷利珠单抗注射液都能在针对至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤这一适应症上获得附条件批准的时代一去不复返了,争第一成为寄希望于附条件批准的企业接下来努力的目标。
比拼硬实力的时代来临
对于企业而言,比拼硬实力的时代加速来临。
当附条件批准的含金量进一步提升,这个产品研发耗资少、上市快的最佳通道今后只有一家企业能够享受到,那么也将倒逼企业立项时进一步向以临床价值为中心,解决临床未满足临床需求调整,而那些硬实力产品的先发优势将更加突出,潜在商业化窗口进一步加大。
作为武田大中华区注册事务负责人,刘艳玮更忙了,“得先认真学习领悟政策精神,才能支持指导接下来的工作和开展公司内外部的沟通。”在她眼中,此次政策的变动可谓是牵一发而动全身。尤其是,意见稿中提出,药品附条件上市期间,持有人自行评估其研究结果无法确证药品安全有效性的,应主动停止生产销售,以及对于附条件批准上市的品种/适应症,完成所附条件研究并转为常规批准后,方可开展再注册工作。
刘艳玮表示,这些条款直接关系到产品的整体策略和全生命周期的管理,同时也与公司整体目标方向也息息相关。这些都需要公司内部具有前瞻性和计划性,各部门通力合作制定实施计划确保管理高效,产品才能持续服务患者。接下来,她将持续推动公司内部的药物创新,全面评估药物创新中附条件批准的潜在产品,依据政策制定合理开发策略和实施计划确保患者用药可及。
对于已经获得附条件批准的项目,刘艳玮建议企业注意附条件批准中所附条件的研究的计划和实施,避免由于试验耽误影响再注册,导致断货,患者无法用药等情况。
需要再次强调的是,获得附条件批准不代表研发结束,而是4年倒计时的开始。“这是个未完成的任务,突破性治疗和优先审评拿到了我能睡好觉,附条件批准拿了也不踏实,总还是有把刀悬头上”,一名药企注册人员表示。
而受政策影响最大的莫过于那些“在PD-1、EGFR、以及跟随DS-8201项目等内卷项目上的Biotech公司”,一名投资人表示。
当这个花钱少,上市快的最佳通道一旦收紧,对于Biotech企业而言,影响的不仅仅是失去一个加速通道的资格,也预示着曾经的管线及临床试验策略需要重新评估、规划,更重要的是在资本寒冬中,需要投入更多的资金在临床上,最难过的是“如果进行中的临床试验不满足附条件申请转为常规审评,但又不满足常规审评的条件,还要修改方案设计,可能花费的时间更长,产品商业化延期,企业实现自我造血的时间将进一步后延”,某药企分析员表示。
而当前,最紧要的是,无论监管方还是行业需要将“附条件批准绝不是降低标准,而是对此类产品需要更多的监管和科学评价”,这一理念达成一致,刘艳玮强调。机会是留给有准备的人,一样道理,政策红利也是给为坚持真正药物创新而努力的企业。企业明确自己的公司定位和策略很重要,如果以药物创新作为初衷,相信这个政策红利必定让企业获利。
日前,有着“全国最大医院”之称的郑州大学第一附属医院(简称“郑大一附院”)迎来重大人事变动。据大河—河南日报报道,9月1日,姜勇受聘担任郑大一附院院长,院长聘任仪式在该院郑东院区举行。在姜勇上任之前,郑大一附院院长为王成增。
公开资料显示,姜勇为教授、博士生导师,长江学者特聘教授,国家“杰青”,原南方医科大学基础医学院病理生理学教研室主任。同时,姜勇还担任了国家教育部科学技术委员会生物医学学部委员,中国病理生理学会常务理事、休克专业委员会主任委员,广东省病理生理学会副会长等学术职务,是SHOCK、PLOS One、Mediators of Inflammation等国际SCI期刊的编委或学术编辑。
在研究领域方面,根据南方医科大学基础医学院官方网站2020年消息,在研究方向上,姜勇长期从事炎症相关的细胞信号调控及其分子机制的研究,对炎症信号转导机制及其相关信号分子的鉴定和功能研究作出了重要贡献。先后在Nature、Hepatology等多个顶尖国际期刊发表SCI论文120篇,被Science、Nature、Cell等国际期刊他引超5400次。
郑大一附院素来有“全球最大医院”之称。2021年9月,郑大一附院全面接管河南省省立医院后,正式进入“一院四区”时代(河医院区、郑东院区、惠济院区、航空港院区),床位规模达到12000张左右,再次压实“全球最大医院”的称号。同时,郑大一附院还拥有河南省口腔医院、河南省眼科医院、河南省基因医院、郑大一附院儿童医院等14个院中院,总占地面积871亩,临床医技科室120个,病区279个。
目前,郑大一附院在中国最佳医院排行榜(复旦版)中,综合排名位居全国第19位,在今年7月中国医学科学院发布的“2022 年度中国医学院校/中国医院科技量值(STEM)与 2018-2022 五年总科技量值(ASTEM)榜单”排名中,郑大一附院位列第17位。该榜单近几年的数据还显示,郑大一附院在科技量值方面的排名一路飙升,2014年排名第53位,2015年第42位,2016年第36位,2017年和2018年分别第31和第32位,2019年升至第23位,2020年、2021年均排名第21位。
8月23日,由国家卫健委主管的《中国药房》杂志刊发《第二批国家重点监控药品合理使用规范》、《国家重点监控药品(第二批)处方(医嘱)审核点评规则》,这是对第二批重点监控目录首次推出具体实施规则。


一封无法阅读的“信”变成的画,意味着什么?
海报上的加注,似乎产生了两个作用:一是形成一个并列,指示从书法抽离出“笔势”的作法,是真有先行的文本,而非凭空运用某些笔法来绘画;二是提示,这是一个基于文本隐晦特质的作品展——需要加注,但是不展示注解。通常,我们会把和主要呈现物,有着隐匿的重要关联的文本,称为“隐迹文本”;而吴非的作品似乎指示另一种情况,即,有一个和作品呈现有明确关联的文本,而这个文本本身,是不可获取的。这意味着什么?

吴非,三分之四的我,200×120cm,布面丙烯,2023
吴非创作的方法来路,处在抒情、视觉、观念,三种取径方式之间。“观念”其实只是一个引子,促成了寄情感于视觉的自成方法,而情感又收敛进作画的步骤程序,最终的呈现,好像是围绕书法笔势、遮盖色层、打磨镂空而成的纯抽象画。他的方法逻辑中,有乍看颇让人费解的成份:相当于说,我倾注情感于一封写给特定某人的信,但另一方面,我一开始就预设了这封信的内容是要被消解掉的。消解的行为,为作品重心向其他方面偏移,留出空间:或许,上述的“行为”只是一个引子,为的是要提供一种情感转化为纯抽象的视觉经营,笔势的章法/平铺笔触的分布序列,以及和“信”的语调对应的颜色,也就是画面本身,才是重点。又或许,是要覆盖掉具体情感的私密琐碎,只保留某种痕迹,呈现为更抽象、更普遍的语势状态,从而获得一种豁达、冲淡的教养。还有一种可能:吴非的意图,并不仅仅是给某个对象写信,或许,是要在自己与对象的互相关系中,反观自己,在这封信里,隐藏着他所想象的、对象给他的回信——给已故诗人的“信”,似乎尤其代表这种可能倾向:

吴非,桔子灯泡和飞虫2,60×45cm,布面丙烯,2023

吴非,你的到来,200×120cm,布面丙烯,2022
艺术家复写/摘抄了诗人的诗,提取“笔势”,作为艺术家写给诗人的“诗”/“信”。在这件名为《逍遥》的画作里,画面变得非常白/清净,笔势呈现为单色、镂空的形态,小时候练字时的方字格红线(或许有点重回、直面被赋予教养/不自由的心结时刻的意思),虚化、松动,尤其是格子的横线,被去象存意,只留存在“字”的行布和竖(斜)线的松动有无节奏里。与此同时,红线又似往者的血痕(不单单是艺术家这么描述,笔者在作品前的直观,也如此觉得)。愿往者“返其真”,尽得“逍遥”,“而我犹为人猗”。如此,这封天堂之书,又岂能不同时又是自我之书呢?
吴非,逍遥,200×400cm,布面丙烯,2023

吴非,杭州2,80×60cm,布面丙烯,2023
以上这段话,无疑脱胎于艺术家本人口头讲解所给出的线索;它们并没有作为组成作品的副文本,呈现在现场。实际上,基于艺术家将书法文字提取笔势、去信息化的处理方式,相应的信件内容,如果直接呈现,无疑就背道而驰了。回到开头的话题:创作意旨,不再作为直观呈现的一部分,作品在视觉上相对独立于背后故事,并不完全相对应,而背后故事却又是作品的重要组成,这样一种状态的架上艺术,无疑只能发生在当下艺术系统的语境。而这种机动的状态,无疑让艺术家在画面、情感、施行过程等方向上,综合地展开,被赋予更大的自由,而不再像过去的语境里那样一样,追求所有层面的绝对形式同一性。

吴非,会飞的妈妈3,60×45cm,布面丙烯,2023

吴非,抚养彩色,200×120cm,布面丙烯,2022
展览现场




墨方Mocube 吴非个展“给你的信”展览现场
©文章版权归属原创作者,如有侵权请后台联系删除

临床指南丨学术交流丨会议信息
期待优秀的中青年乳腺癌专家加入!
一例克服CDK4/6i耐药的Luminal型晚期乳腺癌
基本信息
🔹患者基本信息:患者庞女士,女性,51岁,未绝经
🔹主诉:右乳腺癌保乳术后2年余,发现肺转移1年余
治疗经过

✔ 现病史:2020.03外院行右乳癌保乳根治术,术后病理:浸润性导管癌,T 2.5cm,II级,淋巴结0/12,切缘阴性,脉管阴性,ER 60%+,PR-,HER2-,Ki67 1%+。2022.04-2020.07行EC化疗6次,放疗30次,具体剂量和范围不详。2020.10行三苯氧胺内分泌治疗,期间规律服药未中断。2021.01.20外院复查胸部CT提示:双肺结节,大者左上肺9mm,考虑转移,患者当地医院穿刺未见恶性肿瘤证据,定期随访。2021.3.24外院复查CT:右乳癌保乳根治术,双肺多发转移瘤?较前增大增多。后至我院就诊,2021.04.15我院胸部CT:右肺术后,两肺多发结节,最大结节位于左肺下叶前内基底段(SE7,IM184),实性结节影,大小16mm✖️12mm,可见分叶、胸膜凹陷征象,考虑转移,请结合临床(具体见图1-1)。2021.04我院介入科行肺结节穿刺未成功,2021.04我院胸外科行胸腔镜下肺楔形切除术,术后病理:(左下肺结节)浸润性癌,伴神经内分泌分化,结合病史及免疫组化染色结果,符合乳腺癌肺转移,ER(+,>90%,强),PR(-),HER2(0),Ki-67(+10%),AE1/AE3(+),Syn(+),CgA(-),SPA(-),NapsinA(-),P40(-),CK5/6(-),TTF-1(-),GATA3(+),Mammaglobin(+),GCDFP15(-),SOX10(-)。2021.06.-2021.08行诺雷德+阿贝西利+氟维司群治疗,2021.08.19我院胸部CT: 两肺多发转移部分较前增大,请结合临床(具体见图2-1、2-2、2-3、2-4)。2疗程疗效评估PD。2021.09至今开始诺雷德+西达本胺+依西美坦治疗,2022.01.17我院胸部CT:。两肺多发转移结节较前相仿,结合临床。后因上海疫情在当地复查随访,最佳疗效SD(具体见图3-1、3-2、3-3、3-4)。治疗期间不良反应有:III°血小板下降、I°谷丙转氨酶升高、I°中性粒细胞下降,I°恶心,余无不适主诉。末次门诊随访时间2022.08.30。患者目前无胸闷、胸痛、发热、咳嗽、咳痰,无夜间盗汗及体重减轻,自发病来,患者神志清,精神可,胃纳可,睡眠欠佳,大小便无殊,体重无明显增减。
✔ 既往史:
2018年11月于外院行右上肺肿瘤切除术,术后病理:浸润性高分化腺癌,肿块大小1.2cm。我院病理会诊:(右上肺叶)原位腺癌,微浸润腺癌不能除外,支气管切缘(-),淋巴结未见癌(0/21)。
✔ 家族史:无
✔ 体检阳性体征与重要阴性体征:无
✔ 诊断:1.右乳腺癌保乳术后(pT2N0M0,IIA期),肺转移(rTxNxM1,IV期),2.右肺原位腺癌,伴微浸润?
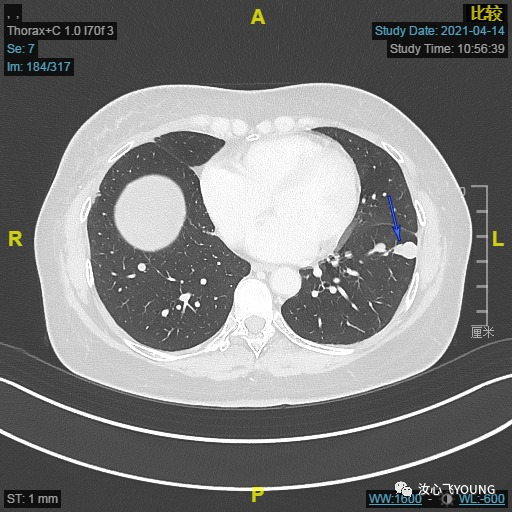
图1-1
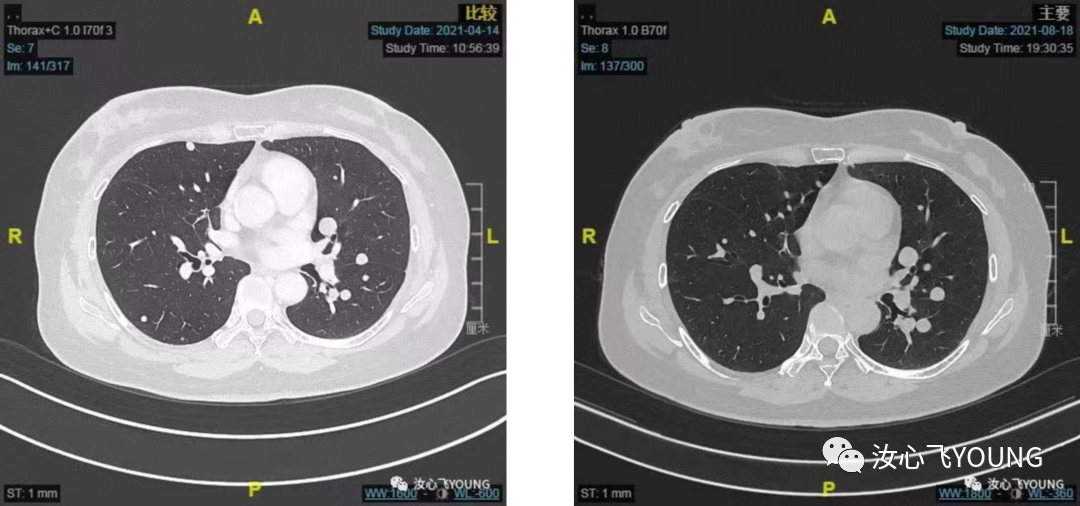
图2-1 图2-2
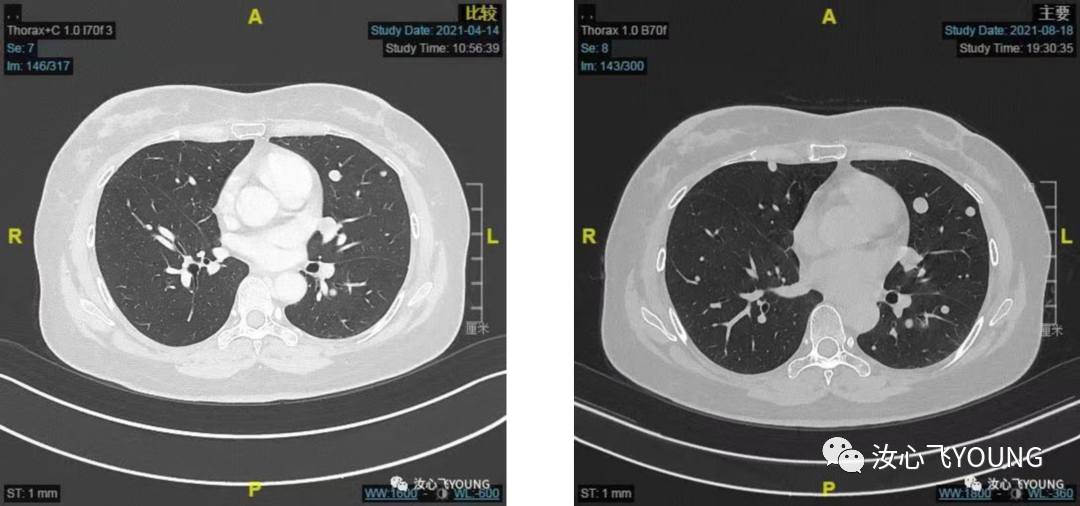
图2-3 图2-4
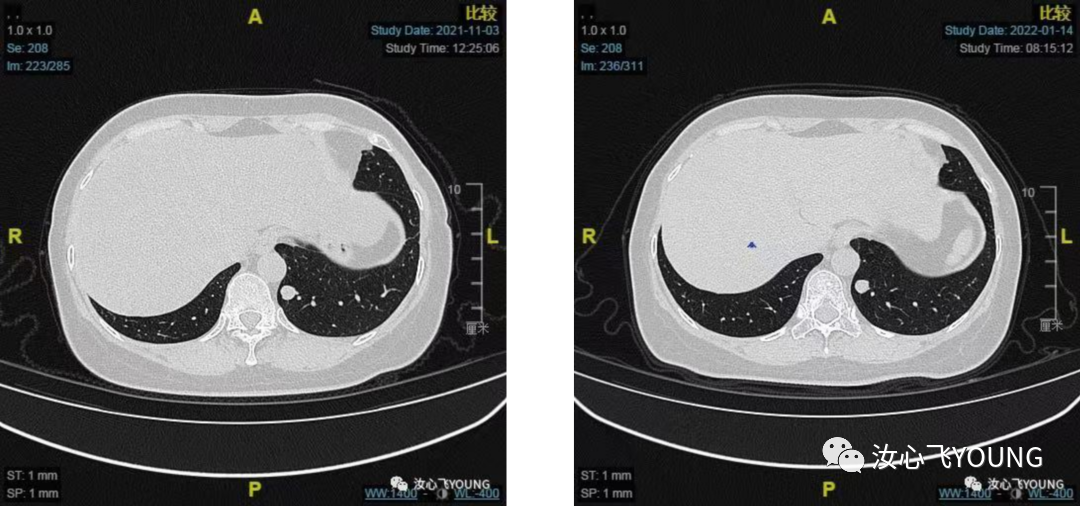
图3-1 图3-2
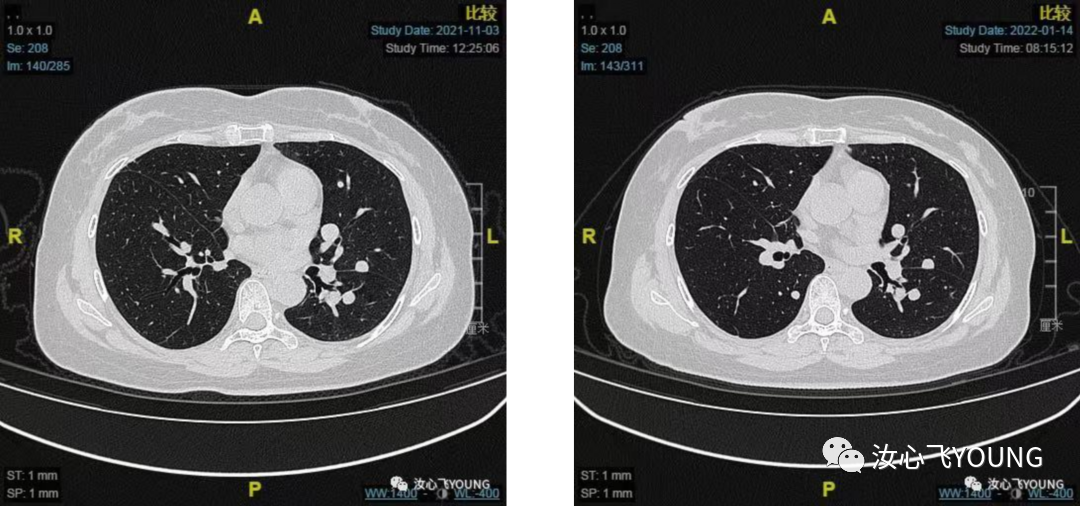
图3-3 图3-4

专家点评
患者存在双原发肿瘤(乳腺癌和肺癌),在首次出现肺部结节考虑恶性肿瘤时,应该进行穿刺活检明确诊断、鉴别肺部恶性肿瘤的来源,这对患者的预后及后续治疗至关重要。另外,乳腺癌是一个组异质性非常强的恶性肿瘤,其治疗方案的制定主要依靠分子分型,即ER、PR和HER2的表达,而原发灶和转移灶间的受体表达常不一致。据文献报道,ER阴性转变为ER阳性的比率在3.4-60%之间不等,ER阳性转变为ER阴性的比率在7.2%-31%,HER2的不一致率较低,为0.7-11%。因此复发转移病灶的再次活检可以为治疗提供信息。目前在NCCN指南、ESMO指南、CSCO指南或ABC共识中都强烈推荐对于首次复发转移病灶进行穿刺活检。
对于HR+/HER2-晚期乳腺癌而言,目前全球范围内和我国首选的一线标准治疗方案均为内分泌联合CDK4/6抑制剂,PALOMA系列、MONALEESA系列和MONARCH系列研究均证实在芳香化酶抑制剂(Aromatase inhibitor,AI)或氟维斯群的基础上加入CDK4/6抑制剂(帕博西利、阿贝西利和瑞博西利)均能够显著延长患者的无进展生存(PFS),且在MONALEESA系列研究中报道了总生存期(OS)的获益,这些研究均奠定了内分泌联合CDK4/6抑制剂在HR+/HER2-晚期乳腺癌中的重要地位。
但是对于标准治疗方案内分泌联合CDK4/6抑制剂治疗失败后应该如何选择,目前无论是国际指南还是国内指南,均没有统一的意见。由CSCO BC-Young发起的一项真实世界研究【1】纳入了中国5家医院(复旦大学附属肿瘤医院、江苏省人民医院、浙江省肿瘤医院、湖南省肿瘤医院、上海交通大学附属瑞金医院)的200名既往palbociclib治疗失败的HR+/HER2-乳腺癌患者,观察Palbociclib治疗进展后的治疗模式及其疗效与安全性;研究显示CDK4/6i 进展后26.5%(N=53)的患者依旧选择内分泌治疗,联合西达本胺的患者占到39.6%(N=21),研究开展期间正值西达本胺乳腺癌适应症获批初期,为中国CDK4/6i经治的患者提供了一个新的选择,然而由于其样本量较少,palbociclib治疗失败后各内分泌治疗联合几种靶向治疗之间比较未见统计学差异,期待后续更多的研究和数据给予临床选择的指导。目前国际国内均在进行诸多相关的临床研究,如CDK4/6抑制剂跨线治疗的相关研究,今年ASCO会议上报道的MAITAIN研究就是其中之一,该研究证实了既往CDK4/6抑制剂治疗失败后跨线使用瑞博西利联合内分泌治疗较单药内分泌治疗可显著改善患者无进展生存,但该研究是一项II期研究,仍需要大样本III期研究进一步证实。若患者无内脏危象、临床判断患者仍能够继续从内分泌治疗中进一步获益的,仍可尝试其他靶向药物联合内分泌治疗,如基于SOLAR-1研究和BYLieve研究,患者若存在PI3KCA突变,可尝试alpelisib联合氟维斯群治疗。今年ESMO会议中报道了APOBEC和HRD与ET +/- CDK4/6抑制剂早期耐药的关系,该研究结果提示在HR阳性的MBC中具有更高的APOBEC和HRD信号,以及更高的内分泌耐药相关的特定基因改变突变频率,其中包含PIK3CA、PTEN、ARID1A、NR1等,这种PIK3CA突变在APOBEC为主的乳腺癌中富集或可解释BYLieve研究队列A中既往CDK4/6抑制剂治疗持续时间小于6m的患者,使用alplelisib联合氟维斯群有更长的PFS(12.0m vs 6.2m)。临床前研究显示,HDAC抑制剂可上调p21表达,激活CDK抑制因子p21,恢复耐药细胞对CDK4/6抑制剂的敏感性,提示了HDAC抑制剂或可逆转CDK4/6抑制剂的耐药【2】。另外,HDAC抑制剂西达本胺可通过下调生长因子受体通路相关蛋白(如P13K/AKT/mToR和Raf/MEK/ERK)的磷酸化影响ER的活化,并且通过提高HsP90乙酰化水平以诱导ER降解,从而抑制配体非依赖性活化通路,进而克服内分泌耐药【3-4】。目前也有关于HDAC抑制剂联合CDK4/6抑制剂的相关临床研究,如探索Belinostat联合Ribociclib在乳腺癌中的安全性和有效性的研究(CHARGE研究,NCT04315233)以及复旦大学附属肿瘤医院进行的CINDERELLA研究(NCT05464173)。此外,越来越多的ADC药物正在进入临床,如DESTINY-BREAST04研究中的DS8201和TROPiCS-02研究中的戈沙托珠单抗正在改变CDK4/6抑制剂进展后的治疗格局。
文献出处:
【1】Li Y, Li W, Gong C, et al. A multicenter analysis of treatment patterns and clinical outcomes of subsequent therapies after progression on palbociclib in HR+/HER2− metastatic breast cancer. Therapeutic Advances in Medical Oncology. Vol. 13:1-11. 2021;
【2】Zupkovitz G, Grausenburger R, Brunmeir R, Senese S, Tischler J, Jurkin J, et al. The cyclin-dependent kinase inhibitor p21 is a crucial target for histone deacetylase 1 as a regulator of cellular proliferation. Molecular and cellular biology 30, 1171-1181 (2010)
【3】Chen CS, Weng SC, Tseng PH, Lin HP, Chen CS. Histone acetylation-independent effect of histone deacetylase inhibitors on Akt through the reshuffling of protein phosphatase 1 complexes. The Journal of biological chemistry 280, 38879-38887 (2005)
【4】Fiskus W, Ren Y, Mohapatra A, Bali P, Mandawat A, Rao R, et al. Hydroxamic acid analogue histone deacetylase inhibitors attenuate estrogen receptor-alpha levels and transcriptional activity: a result of hyperacetylation and inhibition of chaperone function of heat shock protein 90. Clinical cancer research : an official journal of the American Association for Cancer Research 13, 4882-4890 (2007)
病例提供

李 婷 教授
复旦大学附属肿瘤医院
乳腺及泌尿肿瘤内科 主治医师
医学博士 科主任助理
病例点评

王碧芸 教授
复旦大学附属肿瘤医院
乳腺及泌尿肿瘤内科 科主任
主任医师 硕士生导师

临床指南丨学术交流丨会议信息
期待优秀的中青年乳腺癌专家加入!
治疗概览

参考文献
[1] MIGLIETTA F, VISANI L, MARINI S, et al. Oligometastatic breast cancer: Dissecting the clinical and biological uniqueness of this emerging entity. Can we pursue curability? [J]. Cancer Treat Rev, 2022, 110(102462.
[2] SORAN A, OZMEN V, OZBAS S, et al. Randomized Trial Comparing Resection of Primary Tumor with No Surgery in Stage IV Breast Cancer at Presentation: Protocol MF07-01 [J]. Ann Surg Oncol, 2018, 25(11): 3141-9.
[3] BADWE R, HAWALDAR R, NAIR N, et al. Locoregional treatment versus no treatment of the primary tumour in metastatic breast cancer: an open-label randomised controlled trial [J]. The Lancet Oncology, 2015, 16(13): 1380-8.
[4] FITZAL F, BJELIC-RADISIC V, KNAUER M, et al. Impact of Breast Surgery in Primary Metastasized Breast Cancer: Outcomes of the Prospective Randomized Phase III ABCSG-28 POSYTIVE Trial [J]. Ann Surg, 2019, 269(6): 1163-9.
[5] JOHNSTON S R D, TOI M, O'SHAUGHNESSY J, et al. Abemaciclib plus endocrine therapy for hormone receptor-positive, HER2-negative, node-positive, high-risk early breast cancer (monarchE): results from a preplanned interim analysis of a randomised, open-label, phase 3 trial [J]. The Lancet Oncology, 2023, 24(1): 77-90.
[6] SLAMON D J, FASCHING P A, HURVITZ S, et al. Rationale and trial design of NATALEE: a Phase III trial of adjuvant ribociclib + endocrine therapy versus endocrine therapy alone in patients with HR+/HER2- early breast cancer [J]. Ther Adv Med Oncol, 2023, 15(17588359231178125.
[7] WANDER S A, HAN H S, ZANGARDI M L, et al. Clinical Outcomes With Abemaciclib After Prior CDK4/6 Inhibitor Progression in Breast Cancer: A Multicenter Experience [J]. J Natl Compr Canc Netw, 2021, 1-8.
[8] ANDRÉ F, CIRUELOS E, RUBOVSZKY G, et al. Alpelisib for PIK3CA-Mutated, Hormone Receptor-Positive Advanced Breast Cancer [J]. The New England journal of medicine, 2019, 380(20): 1929-40.
[9] RUGO H S, LEREBOURS F, CIRUELOS E, et al. Alpelisib plus fulvestrant in PIK3CA-mutated, hormone receptor-positive advanced breast cancer after a CDK4/6 inhibitor (BYLieve): one cohort of a phase 2, multicentre, open-label, non-comparative study [J]. The Lancet Oncology, 2021, 22(4): 489-98.
[10] ZHOU J, WU X, ZHANG H, et al. Clinical outcomes of tucidinostat-based therapy after prior CDK4/6 inhibitor progression in hormone receptor-positive heavily pretreated metastatic breast cancer [J]. Breast (Edinburgh, Scotland), 2022, 66(255-61.
[11] RUGO H S, BARDIA A, MARMÉ F, et al. Sacituzumab Govitecan in Hormone Receptor-Positive/Human Epidermal Growth Factor Receptor 2-Negative Metastatic Breast Cancer [J]. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 2022, 40(29): 3365-76.
[12] MODI S, JACOT W, YAMASHITA T, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer [J]. The New England journal of medicine, 2022, 387(1): 9-20.
病例提供

韩忠华 教授
福建医科大学附属协和医院
乳腺外科 副主任医师
医学博士,副教授,硕士研究生导师
海峡两岸医药卫生交流协会委员
海峡肿瘤防治科技交流协会委员
福建省抗癌协会肿瘤科普委员会委员
福建省抗癌协会肿瘤整形外科专业委员会委员
福建省抗癌协会肿瘤康复委员会青年委员会委员
福建省医学会科学普及分会委员青年委员
病例点评

林舜国 教授
福建医科大学附属协和医院
乳腺外科主任医师
中国抗癌协会乳腺癌专业委员会第五、六、七届委员
中国医师协会临床精准医疗专委会乳腺癌分会委员
海峽两岸医药卫生交流协会乳腺专业委员会执行主任委员
福建医学会外科分会乳腺专业组副组长
福建中医药学会乳腺病分会副主任委员
福建医学会科学普及分会副主任委员
实行预约制,保证医药信息交流活动的正常规范的开展,陆续有大三甲发布医药代表接待管理办法。
本周,据 MRCLUB 网友反馈,山东省立医院已于 8 月 25 日发布《医药代表接待管理规定(试行)》,按照公开透明、行为规范、管理有序的原则,根据来访目的实行分类管理,参照“定时定点定人”“有预约有流程有记录”(“三定”“三有”)的方式,结合工作实际合理安排接待工作。
在增加工作透明度的基础上,建立医院与药品器械生产经销企业之间信息与技术交流的正常渠道是应该的,山东省立医院的这份管理办法说明,是参照“定时定点定人”“有预约有流程有记录”(“三定”“三有”)的方式,结合工作实际合理安排接待工作。
三定三有的管理方式此前被上海、天津多家知名大型医院采用,也常见于后续的一些省份卫健委或医院的医药代表接待管理制度中(各地详情可参考 MRCLUB 历史消息,均有相应分享)。
据《山东省医药代表接待管理规定(试行)》,部门职责如下:
药学部、医学工程管理办公室:负责医药代表的预约、备案登记和接待管理,做好接待记录;
纪委、行风建设办公室:负责对制度执行情况和相关人员行为规范进行监督检查,对违规人员进行处罚和约谈;
保卫部:负责监控医药代表在院内的行为活动,对违规出入医院的医药代表实施管控;
试验机构办公室:负责临床试验项目审核对接及相关工作人员备案登记和接待管理;
相关职能部门、临床医技科室:负责管理本部门/科室工作人员行为规范,加强教育监督,禁止违规接触;
医药代表接待实行预约制,一般需至少提前一天(提前24小时)向药学部或医学工程管理办公室提出预约申请提交代表姓名、联系电话、来访日期、企业名称以及介绍内容等,见《医药代表来院预约登记表》,由药学部和医学工程管理办公室根据实际情况决定是否安排人员接待。
预约成功后,医药代表携带本人身份证及相关资料在规定时间到指定地点接受接待。药品、设备和医用耗材供货、对账、维保人员以及临床试验项目工作人员不需预约。其他特殊情况根据实际酌情安排。
当然,如前所述,是分类按固定时间来接待的,比如开展有关药品信息介绍等信息交流的医药代表;开展医疗设备、医用耗材产品介绍等信息交流的器械代表;开展学术推广、技术指导和项目合作的医药代表,不同类型的厂家代表都有相应的时间安排。
而且,有一点比其他地方的规定要合理,接待频次可根据预约和实际情况适当增加调整。药品、医疗设备、医用耗材供货、对账和维保人员直接到药品仓库和医工办相应办公室由相关人员接待。
当然了,备案是预约的前提,《管理规定》说明,与该院有业务往来的药械生产经营企业或其代理机构应主动向医院药学部或医学工程管理办公室登记备案企业医药代表相关信息,见《医药代表登记备案和诚信档案表》。
医药代表如有变更,需在 30 天内完成备案和信息注销医药代表首次预约时同时给予备案登记。
违规拜访也有相应的惩戒,据《管理规定》,医药代表违规擅自在医疗重点区域活动的,第一次发现给予警告,第二次发现约谈涉事药品器械生产经营企业或其代理机构,第三次发现将该企业及其医药代表纳入医院“黑名单”,停止使用其代理的药品、器械产品 3 个月,禁止该医药代表进入医院。一旦发现有违规行为,均记入企业及医药代表诚信档案。
你们那里有新的规定了吗?欢迎分享~
随着上半年半年报陆续公布,国内“抗癌神药”CAR-T疗法的销售情况也相继披露,价格依然是这款“百万一针”产品的待解难题。
CAR-T疗法属于细胞免疫疗法,是在体外利用基因工程的方法修饰患者外周血T细胞,赋予T细胞靶向识别肿瘤细胞表面抗原的特性 ,经体外扩增培养后回输到患者体内进行治疗肿瘤的方法。简单来说,就是利用人体免疫细胞抗癌,有“抗癌神药”之称,目前国内有三款产品获批。
国内获批的三款CAR-T销售情况如何?
复星医药合营公司复星凯特的阿基仑赛注射液(商品名:奕凯达)是国内首个获批上市的 CAR-T 细胞治疗产品,首个获批适应证为治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤(r/r LBCL)成人患者。8月29日,复星医药半年报披露,截至报告期末,阿基仑赛注射液累计惠及超过500位淋巴瘤患者,备案的治疗中心覆盖全国超25个省市、数量超过140家。

接受阿基仑赛注射液使用培训和认证的部分医疗机构名单
来源:复星凯特官网
2022年报中,复星医药曾提到,截至2023年1月末,阿基仑赛注射液已治疗近300位复发或难治性大B细胞淋巴瘤患者。也就是说,上半年5个月左右的时间,阿基仑赛注射液使用患者增加约200位。
今年6月,阿基仑赛注射液在中国境内新增获批二线适应证,用于一线免疫化疗无效或在一线免疫化疗后12个月内复发的成人大B细胞淋巴瘤。复星医药董事长吴以芳在8月30日的媒体沟通会上提到,从6月份批准新适应证后,7月和8月两个月的患者总数明显上升,“大幅度上升。”
第二款CAR-T疗法是药明巨诺(02126.HK)的瑞基奥仑赛注射液(商品名:倍诺达),该产品也已获国家药监局批准两项适应证,包括治疗成人患者的复发或难治性(r/r)大B细胞淋巴瘤 (LBCL)及r/r滤泡性淋巴瘤(FL)。
8月29日,药明巨诺也公布了上半年业绩,上半年收入增加32.9%至0.877万元,增长主要是由于瑞基奥仑赛注射液(商品名:倍诺达)持续商业化。截至2023年6月30日止六个月,药明巨诺已开具94张倍诺达处方,完成85例回输。此外,截至2023年6月30日,药明巨诺还为中国118家医院完成了评估及培训,并认证这些医院合资格使用其CAR-T产品。

接受瑞基奥仑赛注射液使用培训和通过认证的医疗机构部分名单
来源:药明巨诺官网
此前2022年报显示,药明巨诺全年开具了165张倍诺达处方,为r/r LBCL患者完成了141例的回输。这意味着,药明巨诺今年上半年开出的CAR-T处方量已超去年全年的6成。
国内第三款获批的CAR-T疗法是信达生物(1801.HK)与驯鹿生物的伊基奥仑赛注射液。6月30日晚间 ,国家药监局官网公示,这款靶向BCMA的CAR-T产品已获批上市, 用于治疗复发或难治性多发性骨髓瘤 (MM) 成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。由于获批时间,信达生物与驯鹿生物的CAR-T产品在今年上半年并未产生业绩。
百万一针的CAR-T能否进入医保?
作为一款个性化、定制化的疗法,目前国内已经上市的三款CAR-T疗法价格均在百万级别,价格始终是解决该疗法可及性的一个难题。
在八月初召开的第三届中国淋巴瘤病友大会期间,一位接受过CAR-T治疗的弥漫大B细胞淋巴瘤患者告诉澎湃新闻记者,由于有家里人的支持,加上自己经过治疗病情得到很大的缓解,“以前需要定期化疗,现在轻松得就像换了一个人一样”,百万级别的费用对自己的家庭来说是值得的,但对于更多家庭来说,费用确实是一个很大的阻碍。
上海市同济医院血液科主任医师李萍教授在上述大会期间接受澎湃新闻记者采访时介绍,同济医院从2015年开始就开展了CAR-T疗法的临床,目前临床研究加商业化使用CAR-T的患者大约有千例,其中她所在的中心使用获批CAR-T产品的有几十例。
“现在对于部分淋巴瘤患者来说,CAR-T疗法的长期缓解率在30%左右,也就是说,三分之一的患者可能通过CAR-T实现临床治愈。”李萍向澎湃新闻记者介绍,目前CAR-T疗法的适应证还有限,但由于有临床治愈的希望,咨询的人数并不少。站在临床医生角度,面对患者的咨询也会从经济角度给出建议:如果患者家庭经济条件较好,会建议使用市场上的CAR-T疗法。如果经济条件有限,可能会选择其他的治疗手段或看是否满足参与一些CAR-T疗法的临床研究项目。
如何解决CAR-T疗法这种“抗癌神药”的高价问题?实际上,近两年,CAR-T疗法均曾进入当年国家医保局的医保目录调整初审名单,但最终并未进入医保。近期公布的2023年医保目录调整初审名单再次出现复星凯特和药明巨诺的两款产品。


CAR-T疗法是否能顺利通过医保谈判进入医保目录,是否能实现降价?8月30日的复星医药中期业绩媒体交流会上,复星医药董事长吴以芳表示,对于CAR-T疗法进医保,复星医药很期待,也在和国家医保局沟通,但对于今年有多大把握进医保,现在还没有任何确定的消息,“我觉得我们都在努力着。”
CAR-T疗法支付难题需多种方式共同解决
除了寄希望于国家医保,惠民保、商业保险等是目前解决CAR-T疗法高额治疗费用的重要方式。
复星医药在半年报中介绍,截至报告期末,阿基仑赛注射液累计惠及超过500位淋巴瘤患者,被纳入超过90款省市惠民保和超过60项商业保险。
药明巨诺在半年报中提到,截至2023年6月30日,其CAR-T疗法已被列入62个商业保险产品及91个地方政府的补充医疗保险计划。截至2023年6月30日止六个月,85名已回输公司产品的患者中有42名患者获得保险补偿,赔付比例为38%至100%。
医疗创新支付服务提供商镁信健康大客户总监汤容也曾向澎湃新闻记者表示,在医药行业,像CAR-T疗法这样昂贵的药物并非孤例,这类产品都会面临支付难题。对于这种特别高价的高值产品来说,通常无法通过单一的支付方式来解决,而是需要多种支付手段一起去打配合,做多层次的保障,去降低其治疗负担。从患者自费到多地惠民保将CAR-T纳入报销目录,再到多种商业保险纳入,CAR-T疗法的支付方式越来越多元,可及性不断得到改善。
就CAR-T疗法的支付问题,综合医疗服务平台圆心科技集团相关负责人此前曾向澎湃新闻记者表示,百万一针的CAR-T疗法,目前走得最多的是各地的惠民保,实际上,包括商业保险、慈善捐助,以及各地针对低保家庭的民政捐助、地方的大病医保扶持等多种支付手段也能发挥一定的作用,但一个关键问题是,很多患者或家属无法清楚了解这些方式。
“假设上海某医院有多层次医疗保障窗口,一个买了沪惠保的患者,出院的时候把单子交给窗口,核对后就可以理赔,如果患者符合低保或慈善捐助,也可以直接划掉一部分费用,其他该自费的就自费。” 上述负责人表示,目前相关部门正在推动商业型多层次医疗保障,当越来越多的医院加入其中,便有望进一步解决CAR-T疗法等高价药物的支付难题。
整理:肿瘤资讯
来源:肿瘤资讯

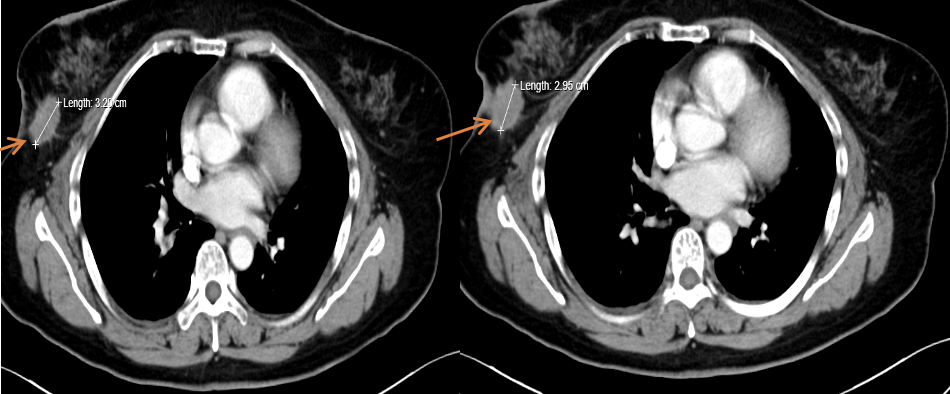
图1. 2020-4右乳病灶CT
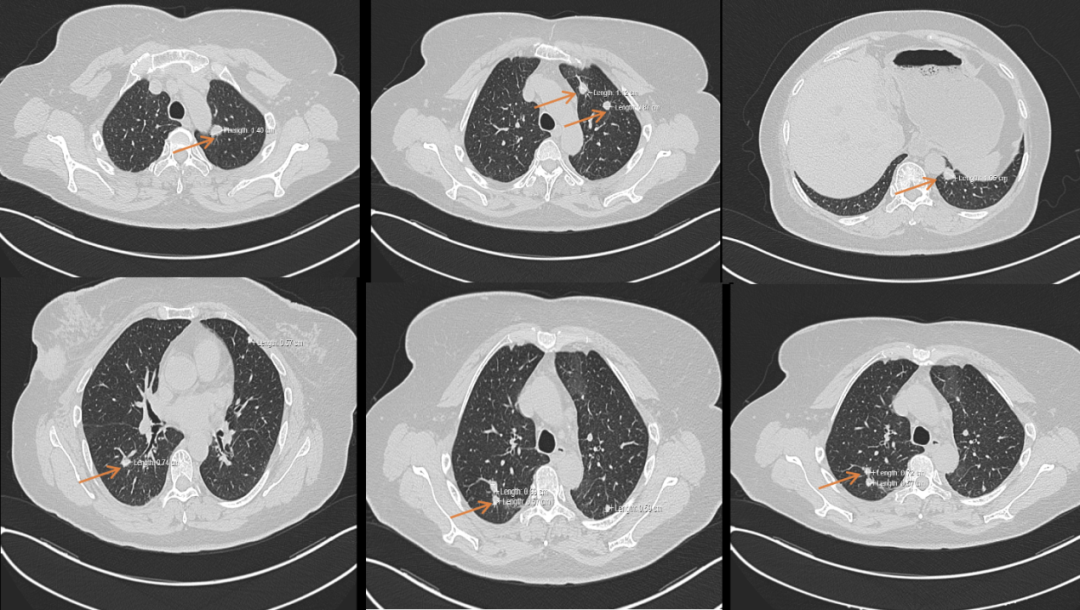
图2. 2020-4胸部CT肺窗
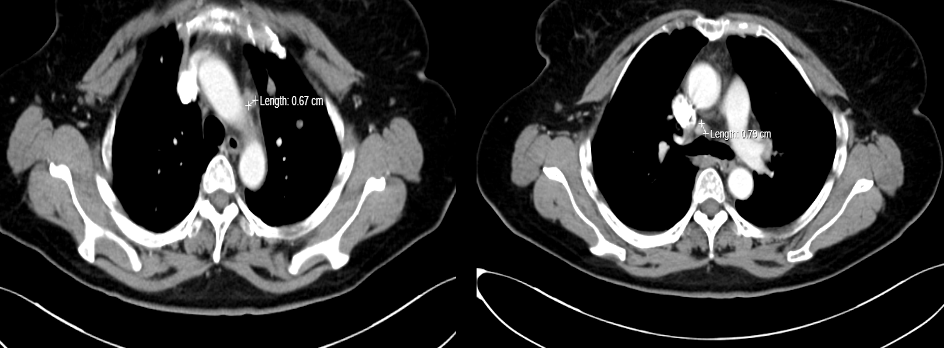
图3. 2020-4胸部CT纵隔窗

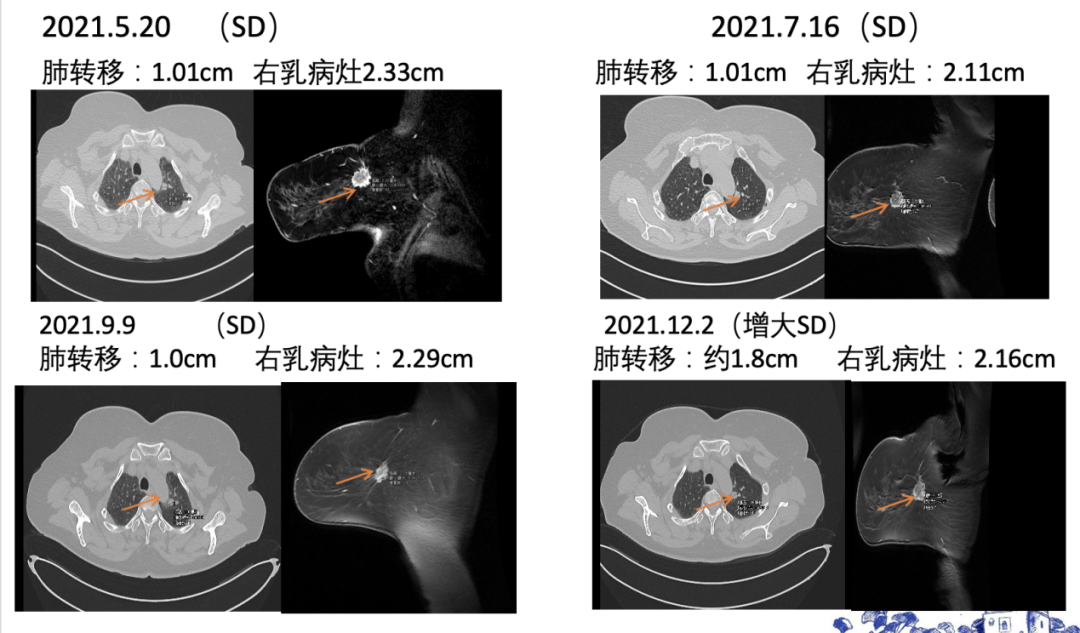
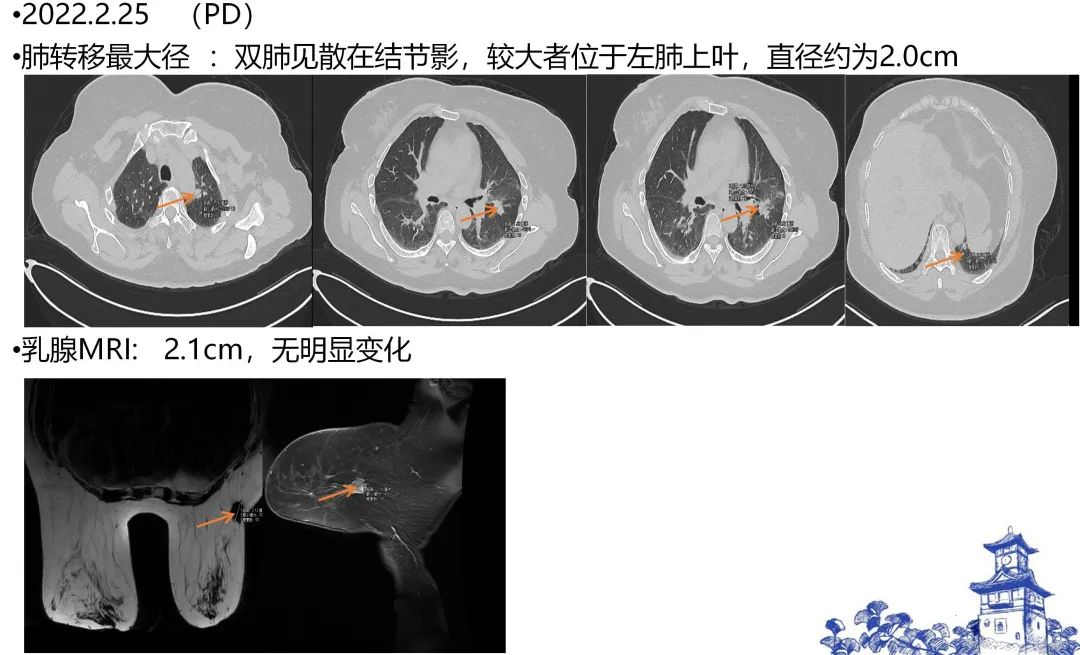
图4. 一线治疗期间,肺转移灶CT和右乳病灶MRI评估

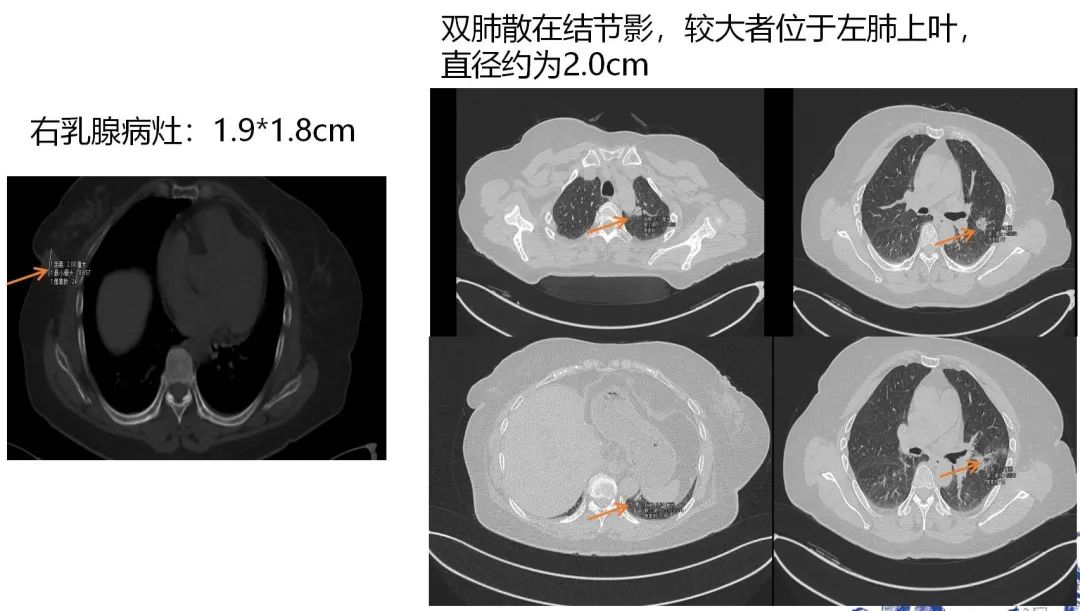
图5. 二线治疗后,右乳和肺部病灶首次评估SD

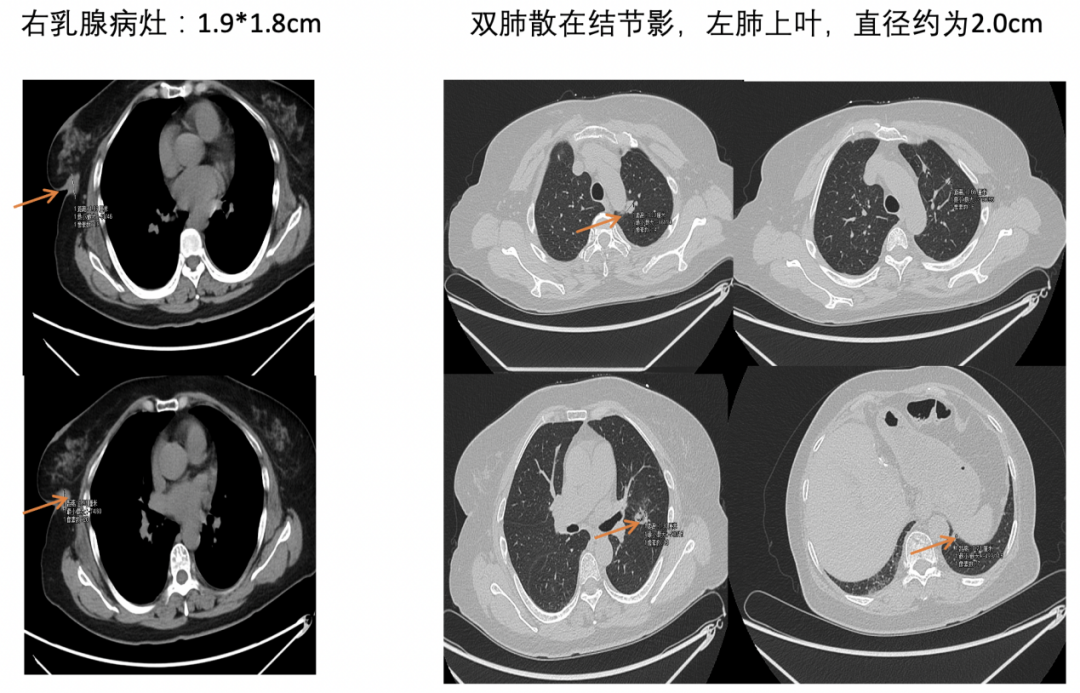
图6. 2022-9-22,右乳病灶和肺部病灶的影像评估

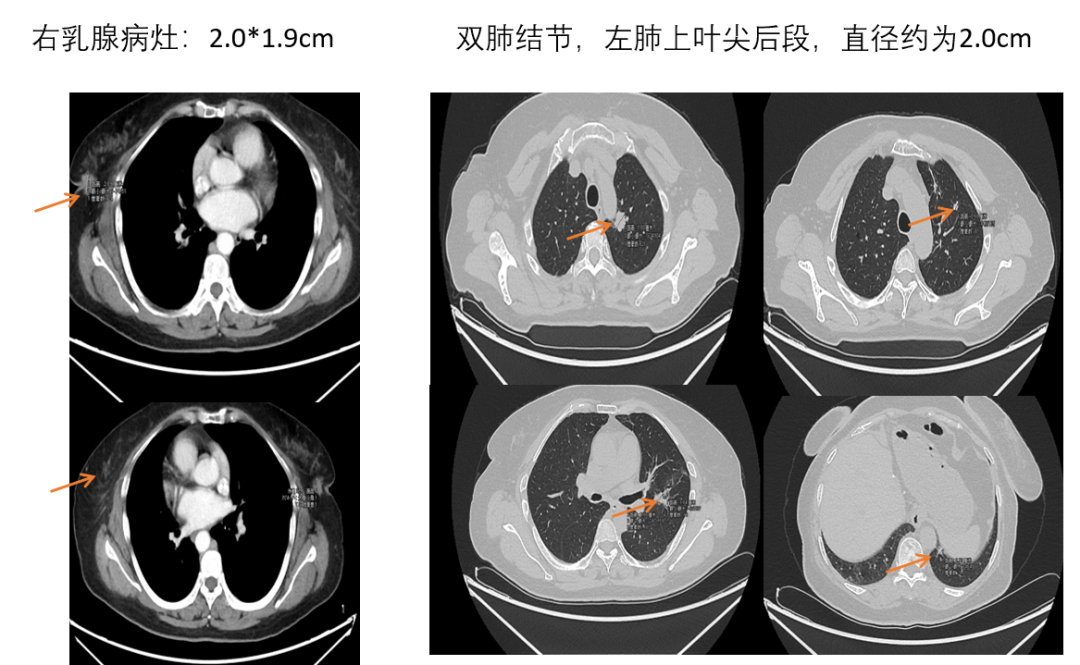
图7. 2023-1-12,右乳病灶和肺部病灶的影像评估

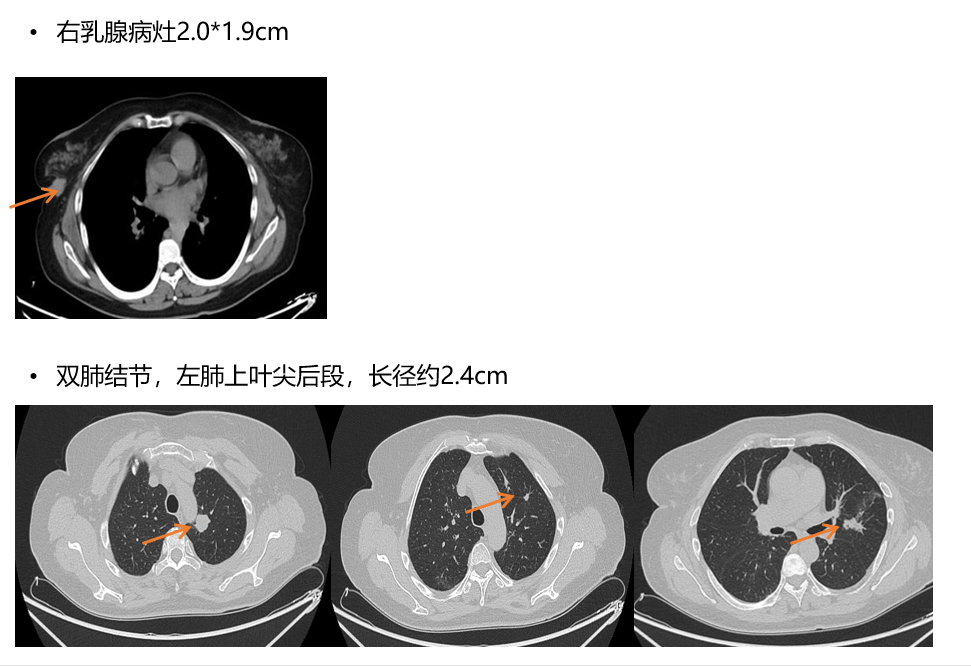
图8. 2023-4-28,右乳病灶和肺部病灶的影像评估

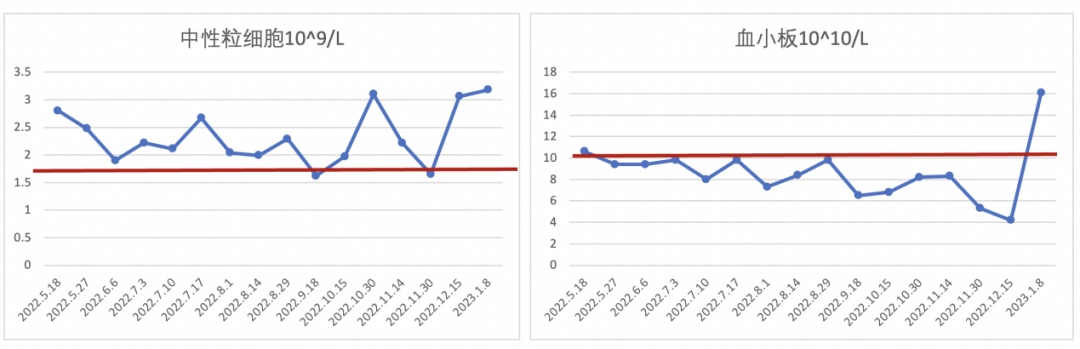
图9. 二线西达本胺+氟维司群治疗中,中性粒细胞和
血小板计数变化趋势


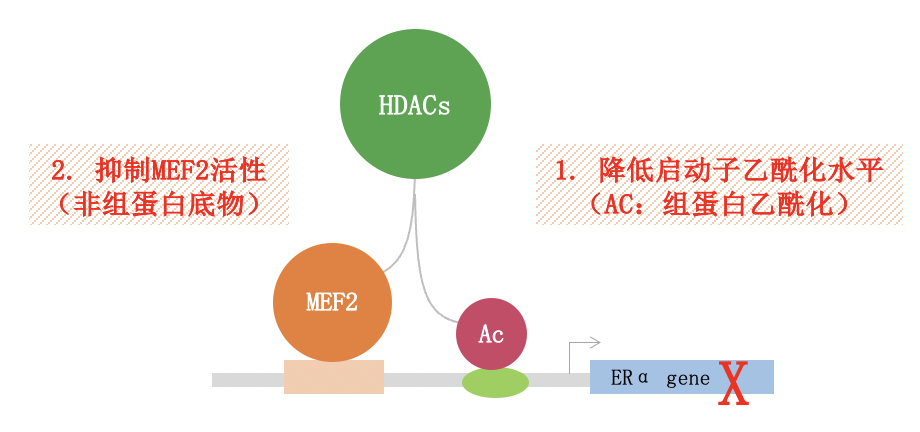
图10. HDAC抑制剂诱导ER/PR表达,克服耐药

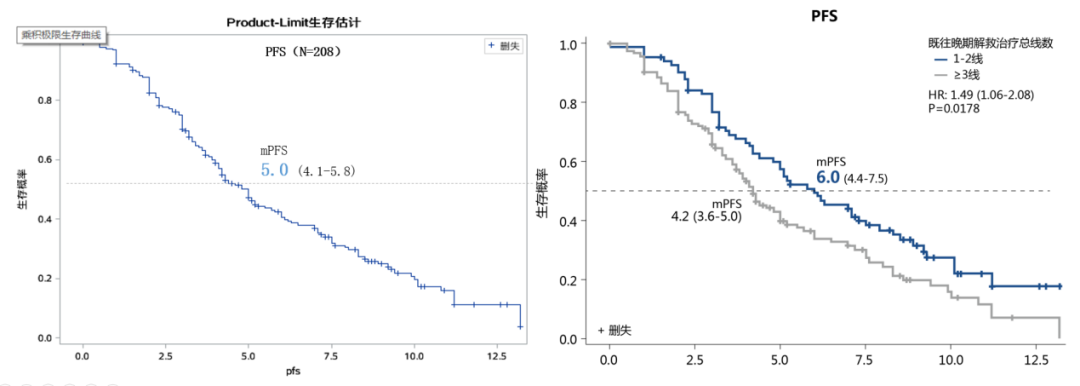
图11. 西达本胺真实世界研究,CDK4/6抑制剂耐药后患者的PFS
