9月4日,荣昌生物发布公告,董事会于 2023 年 9 月 4 日收到公司首席财务官兼联席公司秘书李嘉先生提交的书面辞呈,因个人职业发展原因,李嘉先生申请辞去公司首席财务官兼联席公司秘书职务,辞任后不再担任公司任何职务。

又一个WordPress站点
9月4日,荣昌生物发布公告,董事会于 2023 年 9 月 4 日收到公司首席财务官兼联席公司秘书李嘉先生提交的书面辞呈,因个人职业发展原因,李嘉先生申请辞去公司首席财务官兼联席公司秘书职务,辞任后不再担任公司任何职务。

2023年半年报已收官,各家药企的业绩相继公开,作为经典抗肿瘤药PD-(L)1产品的业绩也陆续公布。
PD-1全称是“Programmed cell death protein1”(程序性细胞死亡蛋白1),这是表达于活化T细胞上的一个免疫检查点,肿瘤细胞表面则表达PD-1的配体PD-L1,两者结合后会抑制T细胞的活化并诱导其凋亡,使得肿瘤细胞躲开免疫系统的清除。PD-(L)1产品则可以通过激活患者自身T细胞的抗肿瘤免疫功能,发挥抗肿瘤的作用。
作为肿瘤免疫治疗的代表性产品,自2018年国内有了首个国产PD-(L)1产品后,该赛道竞争日益激烈,价格不断下降,业内人士甚至称其为“内卷之王”。根据半年报,澎湃新闻记者梳理了A股和港股10家企业的12款PD-(L)1产品销售情况,其中一半的产品未直接列出销售额,公布数据的产品中,百济神州的PD-1产品替雷利珠单抗销售额最高,国内销售额达到18.36亿元。

尽管竞争激烈,但从半年报来看,PD-(L)1产品依然是部分上市公司的业绩支撑,而在这类企业的布局中,不少管线仍是基于PD-(L)1产品,而PD-(L)1产品的出海之路同样被寄予厚望。
百济神州PD-1卖了18亿,多款未公布销售数据
众多PD-(L)1产品中,最先在国内获批的是君实生物的特瑞普利单抗(商品名:拓益)。8月30日晚间,君实生物公布的2023上半年业绩显示,上半年总营收6.7亿元,其中核心产品特瑞普利单抗收入约4.47亿元,同比增长约50%。也就是说,PD-1肿瘤药一款产品贡献了上半年约66%的营收。
在PD-(L)1产品上,百济神州、恒瑞医药、信达生物与君实生物共同被称为“国产PD-1四小龙”。半年报来看,恒瑞医药没有公布两款PD-(L)1产品销售情况。信达生物仅在半年报中提到,上半年产品收入24.575亿元,较去年增长20.4%,主要受益于产品组合整体销量的持续增长,包括PD-1肿瘤药信迪利单抗的强劲销售表现。不过,信达生物的合作方,即知名跨国药企礼来在二季报中提到,Tyvyt(信迪利单抗的英文商品名)上半年销售额1.646亿美元,约11.97亿元。

礼来二季报提到信迪利单抗的销售数据
来源:礼来二季报
百济神州直接公布了替雷利珠单抗的销售额,该产品目前在中国获批,上半年国内销售额达到18.36亿元。从公开的12款产品销售数据来看,是上半年销售额之最。对于该药的增长,百济神州称,主要得益于新适应证纳入医保所带来的新增患者需求、销售团队效率的进一步提高以及药品进院数量的增加。目前,该药已在中国获批11项适应证,其中9项适应证已纳入国家医保目录。
上述“四小龙”是国内PD-(L)1产品的第一梯队,第二梯队中誉衡药业和康宁杰瑞等并未公布PD-(L)产品的销售情况,表现不一。
具体来看,康方生物的PD-1/CTLA双抗肿瘤药卡度尼利单抗上半年销售额6.06亿元,其他产品销售额1.889亿元,同比下降36.4%。其他产品包括派安普利单抗注射液以及公司已与SUMMIT达成战略合作,为SUMMIT供应依沃西(AK112,PD–1/VEGF)临床试验药品。
复宏汉霖的PD-1产品斯鲁利单抗被称为“H药”,上半年销售额5.563亿元。2023年3月,该产品首次实现中国境内(不包含港澳台地区)单月销售额过亿。此外,乐普生物上半年PD-1产品普特利单抗销售收入为4400万元,基石药业的舒格利单抗特许权使用费收入为1462万元。
有药企舍弃PD-1产品,有药企加码出海
今年6月,嘉和生物在港交所公告称,旗下PD-1杰诺单抗(GB226)的新药上市申请未获批准。这是首次被拒批的国产PD-1,也被视为PD-1神药光环消失的代表性事件。除了被拒的未上市产品,还有公司放弃已上市的PD-1产品。
6月28日,誉衡药业公告称,拟将持有的参股公司广州誉衡生物科技有限公司(简称誉衡生物)42.12% 股权以2.4亿元的交易价格出售给青岛普晟普利企业管理中心(有限合伙),本次交易完成后,公司将不再持有誉衡生物股权。

誉衡生物股权结构
2016年3月,誉衡药业设立誉衡生物,将其作为未来发展生物药战略的平台载体。不到十年,为何放弃誉衡生物?誉衡药业给出的原因是鉴于誉衡生物亏损对公司业绩构成较大影响,公司结合实际情况综合评估,而“综合评估”就包括对PD-(L)1赛道的激烈竞争。
誉衡药业称,2022年底,由于誉衡生物产品销售业绩未达预期,公司对誉衡生物开发支出计提减值准备42347.79万元,影响公司净利润-17836.89万元。2023年,国内生物药行业竞争持续加剧,国内已有多款PD-1/PD-L1相关产品获批上市,誉衡生物的赛帕利单抗注射液在市场准入、价格竞争及患者群体规模上已不具备优势;此外,誉衡生物PD-1产品宫颈癌适应证及其他产品的研发进展较为缓慢,后续发展需要更多的资金投入。
2022年报显示,截至报告期末,誉衡生物已初步完成商业化团队的组建,营销中心员工达185名。赛帕利单抗注射液已覆盖超过260家医院的患者,累计发货超过10000支。
有的PD-(L)成弃子,有的仍然在药企管线中占据着不可取代的重要。以君实生物的特瑞普利单抗为例,作为首个我国自主研发并获NMPA批准上市的PD-1产品,也是首个领衔“闯关”美国FDA的国产PD-1。在美国,特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗,以及单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的上市申请(BLA)正在接受FDA审评。
君实生物称,目前FDA已完成对生产基地的现场核查,特瑞普利单抗于美国的上市申请进展顺利。如顺利获批,君实生物北美合作伙伴Coherus将尽快在美国市场推出特瑞普利单抗。特瑞普利单抗也将成为美国首个且唯一用于鼻咽癌治疗的肿瘤免疫药物。
基石药业在半年报也提到,旗下舒格利单抗五项新药上市申请正在审评中,其中两项申请分别在英国和欧盟,适应证为一线IV期非小细胞肺癌,目前进展顺利,并已收到欧洲药品管理局发出的药物临床试验质量管理规范(GCP)检查通知;另外三项在中国大陆,适应证覆盖一线胃癌、一线食管癌、淋巴瘤。五项申请预计将在2023年下半年至2024年上半年陆续获批。
值得一提的是,各家药企在PD-1的国内商业化上也展示出不同的策略。以国家医保目录为例,恒瑞医药、百济神州等多家药企的PD-1通过谈判进入医保。也有企业选择医保外路径,如康方生物在半年报中提到,卡度尼利单抗注射液已被纳入北京、上海、杭州、成都等40多个地区惠民保目录。
在9月3日国家医保局公布的2023年医保目录调整通过形式审查药品名单中,恒瑞医药的阿得贝利单抗、乐普生物的普特利单抗、复宏汉霖的斯鲁利单抗等均不在其中,预计将不参加今年医保谈判。
— Visual Abstract —
![[BMT]T-ALL/LBL移植后西达本胺维持](https://cdn.thinkwit.com/unimm/cms/2023/09/frc-9fdb10af6e722e2467500ccfa1b513be.jpeg)
Keypoint:
高危T-ALL/LBL allo-HSCT后西达本胺维持可显著改善1年EFSMRD
西达本胺维持治疗未增加急性和慢性GVHD发生率和严重程度
![[BMT]T-ALL/LBL移植后西达本胺维持](https://cdn.thinkwit.com/unimm/cms/2023/09/frc-159da8eee3eecbc3bf2a47da7da037ba.png)
1
研究背景
T细胞急性淋巴细胞白血病(T-ALL)和T细胞淋巴母细胞淋巴瘤(T-LBL)是成人罕见疾病,预后不良。疾病复发是移植失败的主要原因,由于缺乏有效的挽救疗法,T-ALL患者的结局令人沮丧。考虑到治疗移植后复发患者的难度,迫切需要探索预防T-ALL/LBL异基因造血干细胞移植后复发的新方案。
西达本胺是一种口服新型亚型选择性HDACi ,单药或联合治疗在体外和小鼠模型中都具有有效的抗肿瘤活性。最近一项研究证明,西达本胺联合化疗可比单纯化疗组为R/R T-ALL/T-LBL患者带来更好的PFS。在临床试验中,西达本胺也显示出良好的耐受性和安全性。这为T-ALL/T-LBL患者的西达本胺维持治疗提供了坚实的基础。
2
研究方法
本中心于2019年10月-2022年3月进行了一项前瞻性、单中心、单臂研究,以确定西达本胺作为T-ALL/LBL患者allo-HSCT后维持治疗的疗效。最终,18例高危T-ALL/LBL患者成功接受西达本胺作为移植后维持治疗。此外,2012年4月-2019年12月,51例生存超过2个月,没有任何复发迹象,未接受任何维持治疗的患者纳入无维持治疗组。
西达本胺初始剂量为5mg/d,饭后约30分钟口服一次,每周连续5次。当血液学恢复充分时,剂量增加至10mg,并在治疗期间根据AE的发生情况随时调整剂量。西达本胺治疗应持续至少1年,直至出现复发或不可接受的毒性。定期进行常规血液学指标、骨髓穿刺活检和细胞遗传学研究。主要终点是OS和累积复发率(CIR)。次要终点包括EFSMRD和安全性。EFS的事件包括死亡、血液学复发和分子学复发。
3
研究结果
患者特征如表1所示,接受西达维持治疗的患者中,17例诊断为T-ALL,1例诊断为T-LBL,骨髓中原始细胞为6%,中位年龄26岁(IQR, 19–36)。移植后3.08个月开始使用西达本胺(IQR, 2.68-8.65),西达本胺的中位给药时间为9.65个月(IQR, 5.57-16.84)。
![[BMT]T-ALL/LBL移植后西达本胺维持](https://cdn.thinkwit.com/unimm/cms/2023/09/frc-ee54827757e797376a2a70f6385b27d4.png)
![[BMT]T-ALL/LBL移植后西达本胺维持](https://cdn.thinkwit.com/unimm/cms/2023/09/frc-8f07e87e96bd6fc7438ed28f7b22e505.png)

ChinaBio® 合作论坛是中国领先的国际性生命科学合作会议,借助领先的partneringONE® 合作系统,为您带来全新的合作体验!
此次会议将汇聚来自世界各地的生物技术和制药业领袖以及数百名中国新技术研发企业,是有意在中国境内外发展跨境合作关系的公司必然参加的全球盛会。
除一对一合作会议之外,本论坛还包括现场及点播观看的会议演讲、公司路演、桌面展览、公司展示以及各种社交环节。让您充分展示您的企业优势,并与行业精英建立深厚的业务联系。
与行业领袖共聚ChinaBio合作论坛:机遇尽显其中!

您将遇到谁?
全球生物技术和医药公司的CEO和业务发展主管
创新型初创企业
CRO(合同外包研究)和CMO(合同外包生产)机构代表
投资公司
领先大学及研究机构的研究人员

精选会议议程
中国生物制药管线及全球合作伙伴关系的现状和未来。演讲嘉宾将探讨后疫情时代面临的最紧迫挑战,国际合作伙伴关系的数量和价值日益增加,以及中国在最新创新方面的投资影响。
后疫情时期的“快速中国”:专家们将讨论中国如何快速恢复到疫情前的投资、创新和市场增长水平。
研讨会:中国如何运用最新的人工智能技术提升效率?如何在药物研发和商业化过程中成功避开法律雷区。
风险投资:专注于将资金导向推动产品进入临床阶段。
全球IPO趋势:2023年市场是否保持犹豫不决,抑或转机?
有哪些参与形式?

GENERAL ATTENDEE 普通参会


LIVE AND DIGITAL EXHIBIT 展览和赞助
KEY DATES 重要日期
• 合作系统开放 — 2023年8月23日
• 公司路演开放 — 2023年8月31日
• 线下活动开始 — 2023年9月20日
• 数字活动开始 — 2023年9月25日

全球化合作平台
partneringONE® 提供一个强大、直观而高效的合作系统平台,为与会者提供了与国际合作伙伴建立联系和探索全球合作的机会。
轻松安排与其他与会者的会面,在活动之前浏览参会者的个人资料和项目信息,发送会议邀请。无论您计划拓展市场、寻找合作伙伴,还是进行战略洽谈,partneringONE® 将成为您在会议中取得成功的关键工具。
partneringONE® 合作系统已开放!立即登录账户,开始发送和响应一对一会议请求,安排您的会议日程。
解锁partneringONE® 的潜力:观看网络研讨会和丰富的视频课程,了解如何充分利用合作系统,确保您在Chinabio合作论坛中获得最大收益!
参会者分享
Johnson
& Johnson Innovation很荣幸受邀参加了连续九届的ChinaBio®合作论坛。作为中国生命科学行业最重要的合作论坛之一,我们对能够参与其中感到非常荣幸。
尤其是在经历了三年的暂停后,今年的会议以面对面的方式举行,这让我们格外激动。
尽管受到COVID-19和市场动荡的影响,我们仍然坚信合作是加速医疗创新的重要途径。我们对中国和亚洲其他市场上的医疗保健创新和生物医学创新领域的更多机会和不断发展的景象感到兴奋。
在9月20-21日的ChinaBio®合作论坛中, 我和我的团队期待着在Johnson & Johnson Innovation展台以及一对一会议中与合作伙伴和创新者会面!
– Johnson
& Johnson Innovation
往期会议花絮
 我们期待您的加入,共同推动生命科技行业的创新与发展!
我们期待您的加入,共同推动生命科技行业的创新与发展!
两种注册形式自由选择
全程参会票
一个partneringONE®合作账户
9月20日-21日现场一对一会议、9月25-26日线上一对一会议
参加线下会议议程,包括主题演讲、研讨会、公司路演、专题讨论和展览展示
享用会议早餐、午餐和茶歇
参加欢迎酒会和接待晚宴
数字参会票
一个partneringONE®合作账户
9月25-26日线上一对一会议
随时访问丰富的活动内容库,包括主题演讲、研讨会、公司路演、专题讨论和展览展示

如何最大化提升曝光度
如何在众多公司中脱颖而出? — 参加公司路演!
本届会议的公司路演分为四个专场:生物技术公司、中型制药公司、下一代企业和学术创新者。这些路演可以选择线下现场或线上数字方式进行。
EBD数据显示,路演公司将获得比平均多20%的会议邀约,并能吸引更多顶级投资者、生物制药高管和潜在合作伙伴的关注。这是您开创新机、启动筹资计划的绝佳机会。
如果您的公司的产品或技术具有高度创新性,并正在寻找合作伙伴进行合作开发、授权许可、战略合作或资金支持,我们诚挚邀请您参加本届ChinaBio®合作论坛并进行路演!
| 线下路演 | 数字路演 |
|
|
不要错过这个机会,深入挖掘生物制药行业最具潜力的市场之一,并与世界行业领导者建立联系。
会议官网
赞助和参展
Tom Wu
+86 180 1978 6185
公司路演
Olivia Guiliana
+1 212-710-7414
会议注册
EBDCustomerService@ebdgroup.com

我们真诚期待您的加入!
合作系统已经开放!立即登录账户,开始发送和响应一对一会议请求。现在使用「CBPFSQQ15」优惠代码注册,享受折上折,您将获得额外15%的全通票注册优惠!
2023年1月18日,国家医保局正式发布《国家基本医疗保险、工伤保险和生育保险药品目录(2022年)》,共111种药品新增进入目录,由中国原创新药领域的先行者深圳微芯生物科技股份有限公司(以下简称“微芯生物”,股票代码:688321.SH)自主研发和生产的双洛平®(西格列他钠)被正式列入医保目录。
双洛平®于2021年10月经国家药品监督管理局批准上市。单药适用于配合饮食控制和运动,可以有效改善2型糖尿病患者胰岛素抵抗这一核心问题,从而实现对患者血糖的控制。双洛平®进入国家医保目录,不仅仅是对药物疗效的肯定,更多的是基于患者群体现状的困境以及市场的需求,这将极大减轻患者的疾病负担,提升患者的用药可及性和依从性,使患者获得更优效和安全的治疗方案,提升生活质量,造福更广泛的中国患者。
根据最新数据显示,中国是全球糖尿病第一大国,截至2021年,20~79岁的糖尿病患者约1.41亿人。其中,2型糖尿病是临床上最常见的类型,主要由胰岛素抵抗明显而引起。胰岛素抵抗贯穿糖尿病的整个病程,是2型糖尿病发生和发展的核心病理机制之一。然而,胰岛素抵抗一直是糖尿病药物研发及临床治疗上的难题,存在着显著未满足的临床需求。
作为全球首个获批用于治疗2型糖尿病的PPAR全激动剂,双洛平®可有效改善胰岛素抵抗,在一系列临床研究中显示出显著且持久的降糖效果,显著的胰岛素增敏和血脂调控等综合作用,同时具有潜在的肝脏保护作用,为糖尿病及代谢综合征患者带来更多临床获益。
作为双洛平®三期临床试验的牵头专家之一,北京大学人民医院纪立农教授表示,“临床试验表明双洛平®在改善血糖控制、防治并发症以及安全性之间可以实现良好的平衡。我国自主研发出这样有效、安全的重磅产品,这在糖尿病治疗领域是一个重要的突破,展示了中国原创新药研发的实力。糖尿病是慢性病中首当其冲的疾病,且会导致多种并发症。国家高度重视糖尿病防治工作,将糖尿病防治纳入“健康中国”行动的15个专项行动中。因此,我非常高兴看到双洛平®上市后很快被纳入医保,这不仅会减轻患者的治疗负担,对于中国的慢性病防控也具有非常深远的意义。”
2型糖尿病占糖尿病总患病人数的90%以上,其核心发病机制为胰岛素抵抗及后继出现的胰岛功能失代偿。近70%的2型糖尿病患者存在胰岛素抵抗。对于存在胰岛素抵抗的患者,正常水平甚至显著升高的胰岛素难以发挥降糖的功能,导致血糖难控。除此以外,胰岛素抵抗还是代谢综合征的中心环节,影响机体血脂、能量代谢,增加糖尿病患者高血脂、脂肪肝、心血管疾病等多种并发症风险,严重影响患者生活质量,增加患者疾病负担。因此,改善胰岛素抵抗一直是2型糖尿病治疗中的核心需求,临床亟需可直接改善胰岛素抵抗的药物。
PPARγ受体可调节胰岛素敏感性,改善胰岛素抵抗,此前上市的PPARγ受体激动剂TZD类药物就已展现出了良好的降糖疗效。然而,安全性问题限制了TZD类药物在临床中的使用。双洛平®是一个非TZD类结构的构象限制型PPAR全激动剂,可适度激活体内PPAR α、γ和δ三个受体亚型,并选择性地改变一系列与胰岛素敏感性相关的基因表达,靶向直击胰岛素抵抗。由于同时适度激活三个功能不同但又互有重叠的PPAR受体亚型,双洛平®不但可以控糖,还可调控糖尿病患者常伴随的血脂异常、高血压等代谢综合征症状,全方位防治2型糖尿病及并发症,为患者提供更优效、安全的治疗方案。
上海市第十人民医院邹大进教授强调,“这是一个精准治疗的新时代,如果判定患者高血糖的原因在于胰岛素抵抗,除了生活方式改善,也需要针对胰岛素抵抗进行药物治疗。双洛平®的临床试验为我们临床医生提供了判断胰岛素抵抗的指标,让我们能够更精确地鉴别出胰岛素抵抗的患者,从而进行有针对性的治疗。在胰岛素抵抗患者群体中,双洛平®具有很好的疗效,且安全性良好。”
近年来,国家医疗保障局不断完善药品目录动态调整机制,提升医保用药科学化、精细化管理水平,提高人民群众的医保获得感、幸福感和安全感。一直秉持创新和科学理念的微芯生物以极大的热情参与国家医保药品目录调整工作,创新药品经过谈判后极具经济性优势,进入医保对于参保患者、国家医保工作以及创新企业而言可以说是三方共赢。
微芯生物创始人、董事长兼总经理鲁先平博士表示,微芯生物从创立初期就一直致力于立足中国、开发全球原创新药应对我国的健康挑战。“非常感谢国家医保局选择双洛平®进入医保目录。我们衷心希望双洛平®能帮助糖尿病患者重获高质量的生活。微芯生物将继续坚持‘持续创新,以满足患者未满足的临床需求’为己任,不断努力,研发出更多更好的原创新药,助力实现健康中国。”

微芯生物是由资深留美归国团队于2001年创立的现代生物医药企业。公司专长于原创新分子实体药物研发,致力于为全球患者提供价格可承受的、临床亟需的、具有革命性疗效的创新机制药物。
凭借自主创建的国际先进的“基于化学基因组学的集成式药物发现及早期评价平台”,微芯生物在肿瘤、代谢性疾病、自身免疫性疾病、中枢神经性疾病和抗病毒五个重大疾病领域已开发出包括西达本胺(已上市)、西格列他钠(已上市)、西奥罗尼(已进入临床Ⅲ期)和CS12192(Ⅰ期临床试验开展中)在内的多个原创新药产品线。
目前,微芯生物拥有以深圳总部/研发中心、GMP生产基地全资子公司深圳微芯药业有限责任公司、成都区域总部/研发中心/创新药生产基地全资子公司成都微芯药业有限公司及其致力于开发大分子及其他除小分子以外的新颖治疗技术的子公司成都微芯新域生物技术有限公司、北京分公司(临床研究中心)、上海分公司(商业中心)及微芯生物科技(美国)有限公司的全球化布局。同时,作为国家首批“创新药物孵化基地”,国家高新技术企业,公司独立承担数十项国家“863”、“十五”、“十一五”、“十二五”及“十三五”国家重大科技专项及“重大新药创制”项目。累计申请境内外发明专利482项,131项已获授权。
2020年12月16日,微芯生物与浙江海正药业股份有限公司达成战略合作,将西格列他钠片(双洛平®)在中国19个省份区域的推广权独家授予海正药业。微芯生物和海正药业子公司瀚晖制药的携手合作,强强联合,在产品进入2022国家医保目录后将为糖尿病及代谢综合征患者带来更多临床获益。
来源:肿瘤资讯


点击观看孙春晓医生、李薇教授完整病例解读

图1

图2A
图2B

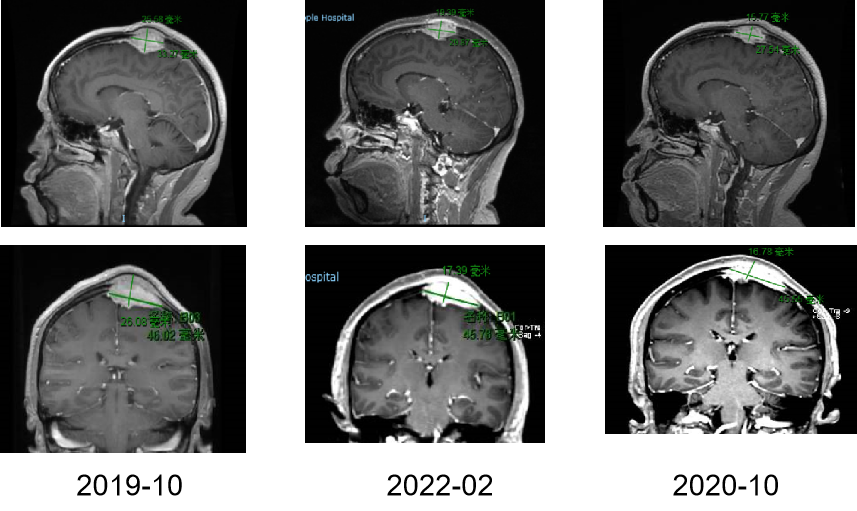
图3A
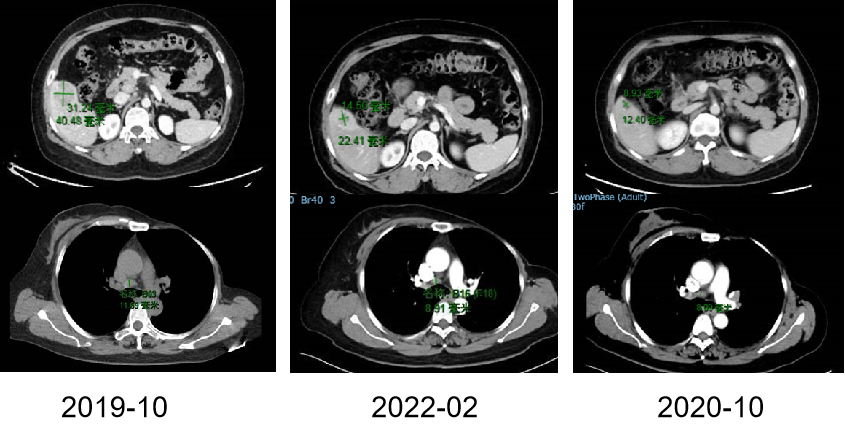
图3B
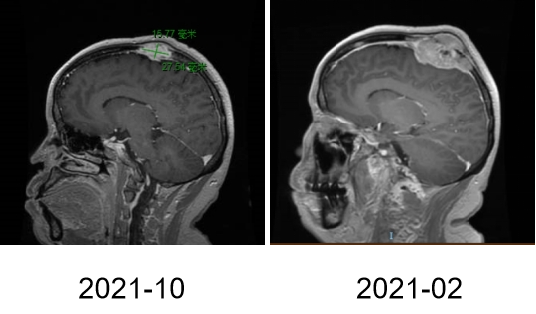
图4

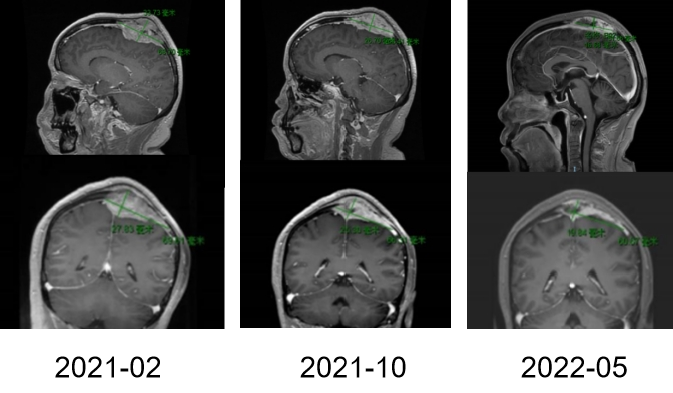
图5A
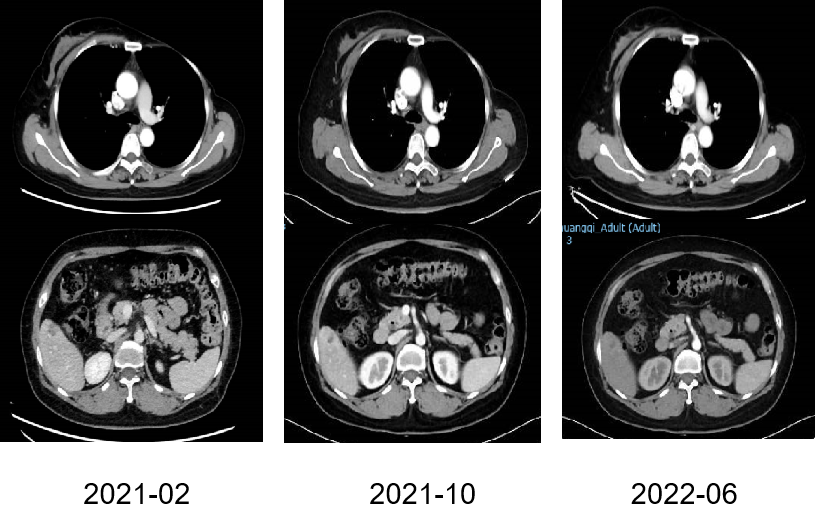
图5B

来源:肿瘤资讯
点击观看杜益群教授完整病例分享

点击观看张剑教授完整病例点评

9月1日,赛诺菲中国在其官微宣布,更新中国战略及组织架构,设立三个新的全球管理职位。
施旺被任命为赛诺菲大中华区总裁,并将继续向赛诺菲执行副总裁兼普药全球事业部负责人夏立维汇报。施旺将与关键职能部门合作,全面领导包含特药、疫苗和普药三个事业部在内的赛诺菲中国整体业务。消费者保健业务架构保持不变。
设立中国研发负责人,这一任命将在不久后宣布。届时,中国研发负责人将直接向赛诺菲全球研发负责人Houman Ashrafian汇报。
何国玲被任命为中国制造与供应链负责人,向赛诺菲全球执行副总裁兼制造与供应事业部负责人Brendan O'Callaghan汇报。她将带领生产制造、供应链和质量管理团队打造行业领先的卓越制造和供应链来支持中国的优先关键事项。
植根中国市场40年,赛诺菲已将中国市场发展成其全球第二大市场。为了进一步推动在中国的强劲发展,赛诺菲还制定了全新的中国雄心,在2030年成为中国领先的跨国医药健康企业,加速为中国患者带来创新药物和疫苗。
赛诺菲宣布全球执行委员会变动
在中国组织架构调整的前一天,赛诺菲宣布了全球执行委员会成员的最新任命。
Houman Ashrafian 被任命为赛诺菲新任研发主管兼执行副总裁,从2023年9月11日开始生效。他将负责加强公司开发首创或同类最佳药物的战略,并增强赛诺菲管线的发展势头。
Madeleine Roach作为业务运营主管兼执行副总裁,自2023年10月1日起生效。Madeleine Roach 将建立并领导业务运营业务部,整合现有的业务服务活动,推动集中化服务进一步扩展为一个全球性部门,重点是提高效率和生产力,促进业务增长和赛诺菲在科学领域的投资。
Emmanuel Frenehard 被任命为首席数字官,该任命立即生效。Emmanuel Frenehard将领导赛诺菲全公司的数字转型,并继续推进公司的数字、数据和技术战略。
赛诺菲执行副总裁、特殊护理GBU负责人Bill Sibold 将离开赛诺菲寻求外部机会。现任北美专业护理主管兼美国国家负责人Brian Foard 将临时领导特殊护理GBU。
据了解,此次全球管理层变革是深化战略的动作之一。
上半年,重磅产品Dupixent 表现亮眼
7月28日,赛诺菲公布2023H1业绩,净收入同比增长4.4%至201.87亿欧元。具体来看,生物制药业务收入174.67亿欧元,同比增长4.1%,细分的疫苗业务贡献12.23亿欧元,同比增长9.1%;消费者保健业务收入27.20亿欧元,同比增长6.1%。
今年上半年,赛诺菲中国区收入15.40亿欧元,同比下滑4.5%,主要原因是受到疫情和集采的影响。分季度来看,赛诺菲中国区收入2023Q1下滑14%,2023Q2增长6.3%。
其中,赛诺菲的重磅产品Dupixent 半年创收48.78亿欧元,增长速度达36.7%,表现亮眼。目前,该药物现已斩获特应性皮炎、哮喘、慢性鼻-鼻窦炎伴鼻息肉、结节性痒疹、嗜酸性食管炎5项适应症,未来有望进一步释放市场潜力。
同时,赛诺菲还有3款关键产品,长效A型血友病疗法Altuviiio、长效RSV单抗Beyfortus以及1型糖尿病(T1D)新药Tzield ,在未来,有望进一步实现强劲增长。