编者按l第66届美国血液学会(ASH)年会将于2024年12月7日至10日在美国圣地亚哥盛大召开。作为血液学界全球性、综合性的顶级学术盛事,ASH年会每年都汇集全球众多的专家学者,在此交流血液学的最新进展和创新临床发现。湖南省肿瘤医院周辉教授团队领衔的两项研究——西达本胺和阿扎胞苷联合化疗一线治疗滤泡辅助性T细胞(TFH)淋巴瘤的疗效和安全性:一项综合回顾性研究,以及通过RNA剪接,西达本胺在肿瘤相关巨噬细胞重编程和免疫治疗中的新作用荣登ASH大会摘要。为此CCMTV·血液频道特邀周辉教授进行采访,为大家深入解读研究成果。
探索西达本胺和阿扎胞苷联合化疗作为TFH
淋巴瘤的一线治疗方案
问题一
TFH淋巴瘤是一种外周T细胞淋巴瘤(PTCL),诊断和治疗都具有挑战性。周教授,您在淋巴瘤领域深耕多年。能否请您简要介绍一下TFH淋巴瘤当前的治疗现状?

周辉 教授
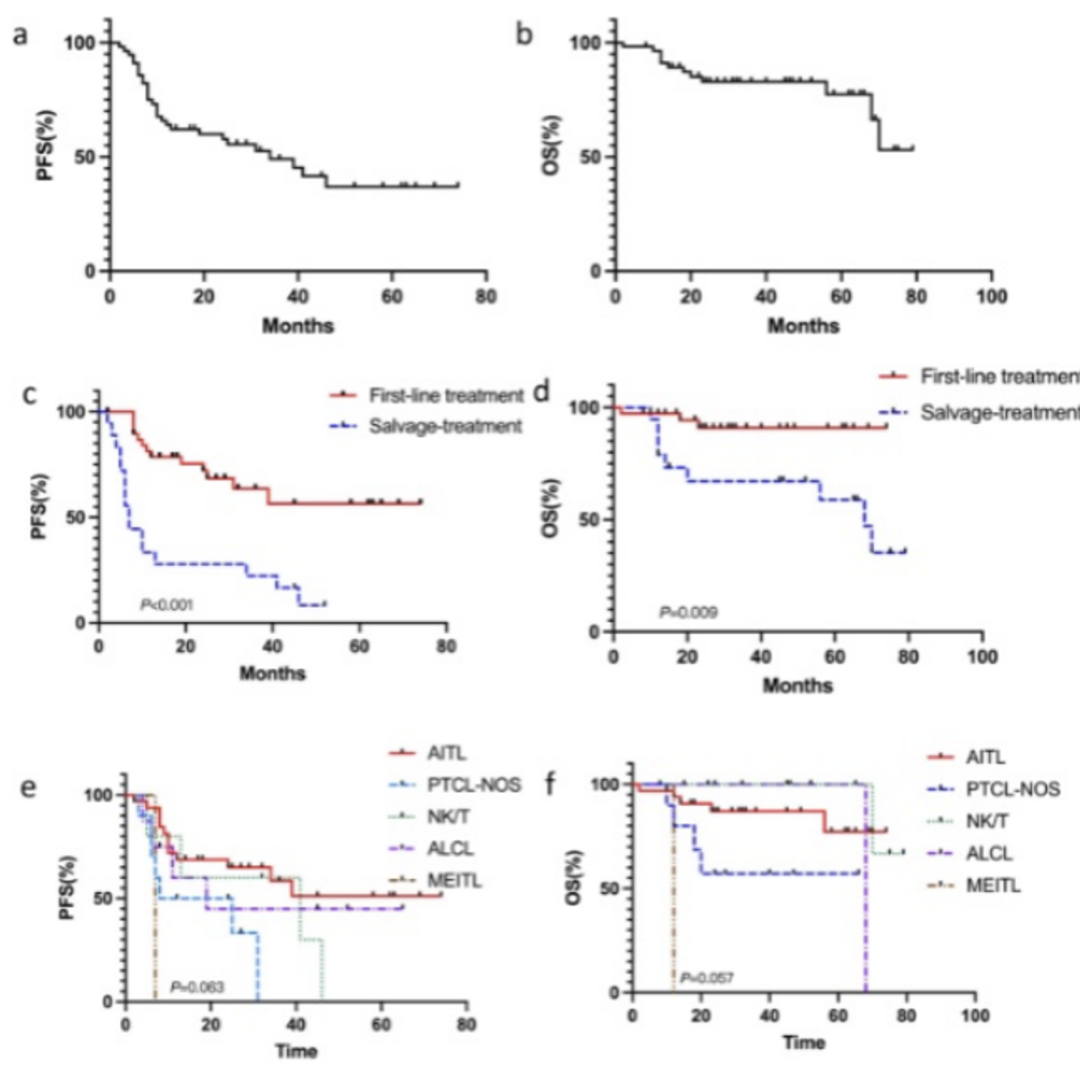
外周 T 细胞淋巴瘤(PTCL)是一组起源于成熟T淋巴细胞的恶性增殖性疾病,生物学和临床表现呈现侵袭性和高度异质性,而TFH淋巴瘤是其中一种常见的侵袭性亚型, 其发生发展机制与表观遗传及TCR信号通路异常密切相关。目前的一线治疗方案常采用以蒽环类药物为主的化疗方案,一线治疗客观缓解率(ORR)为60%~70%,但约50%~70%的患者易出现复发进展。现有治疗手段疗效不理想,整体预后较差,5年总体生存率(OS)大约在30%~40%左右,因此临床上有很大的未被满足的需求,近年来也有很多新药的探索。
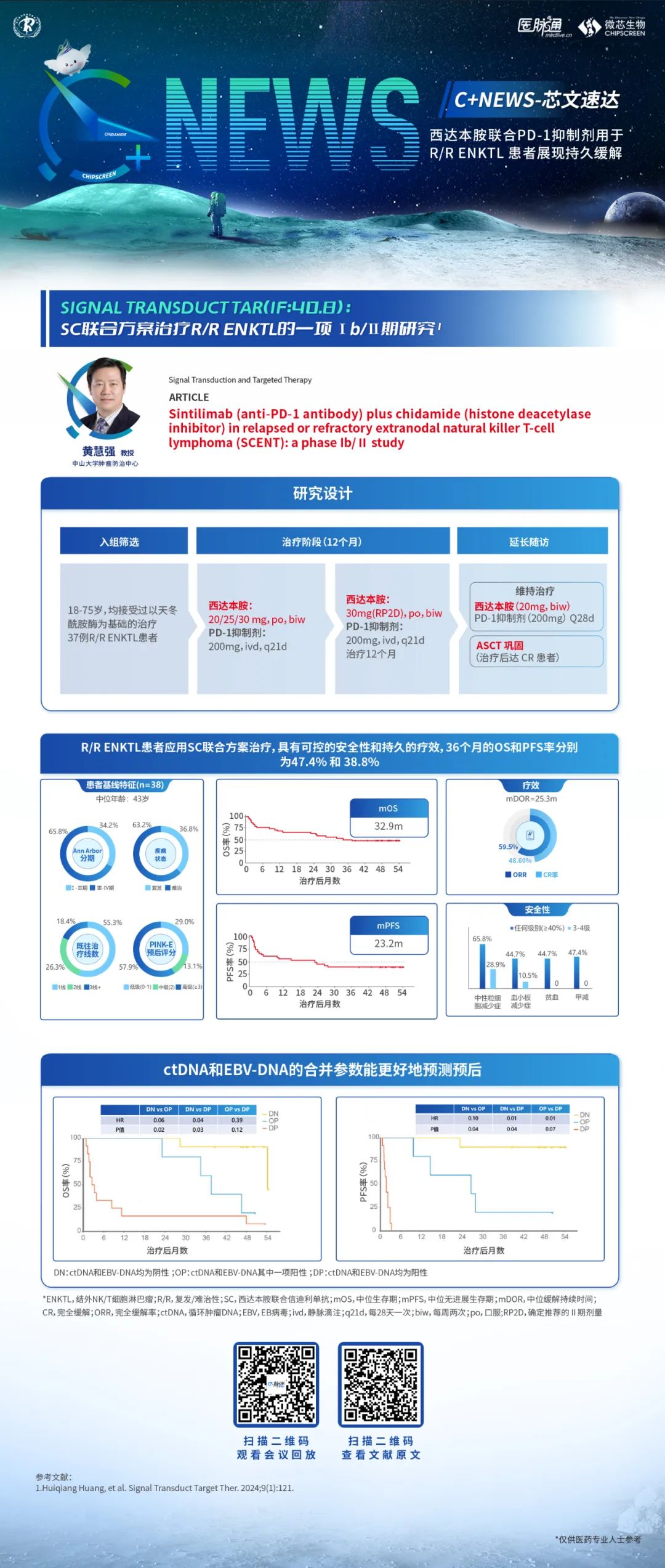
基于此类亚型的疾病特点,表观遗传调控药物大有可为。组蛋白去乙酰化酶抑制剂(HDACi)西达本胺是临床探索热点,西达本胺可诱导肿瘤细胞死亡、分化和细胞周期停滞,还可调节宿主免疫应答。既往我国的一项多中心Ⅱ期临床研究显示,西达本胺治疗复发难治PTCL(R/R PTCL)ORR为28%,而其中TFH淋巴瘤的主要亚类:血管免疫母细胞性 T 细胞淋巴瘤(AITL),ORR达50%,CR率达40%,反应更持久。
问题二
在本次ASH年会上,由您牵头完成的这项研究观察了HDACi西达本胺和阿扎胞苷联合化疗一线治疗TFH淋巴瘤的疗效和安全性,请问这项研究是如何设计的?有哪些发现?

周辉 教授
这项研究纳入了2021年7月至2024年7月我们中心收治的29名新诊断PTCL患者,这些患者在一线治疗期间接受了西达本胺和阿扎胞苷(AC)联合化疗。给予西达本胺口服20mg,每周2次,皮下注射阿扎胞苷 100mg,每3周的第1-5天或第1-7天,共6个周期4。诱导治疗结束后获得CR或PR的患者再采用西达本胺维持治疗。

入组患者的中位年龄是56岁,两位被诊断为非特指型PTCL,其余均为AITL或TFH淋巴瘤。其中II期占17.2%,III期占24.1%,而IV期的患者最多,占58.7%。25例患者从治疗的第一个周期开始接受西达本胺和阿扎胞苷,而4例患者在2-4个周期的化疗后联合西达本胺和阿扎胞苷。最常见的联合化疗方案是CHOP方案(26/29)。17例患者接受了西达本胺维持治疗,2例患者接受了自体ASCT作为巩固治疗。
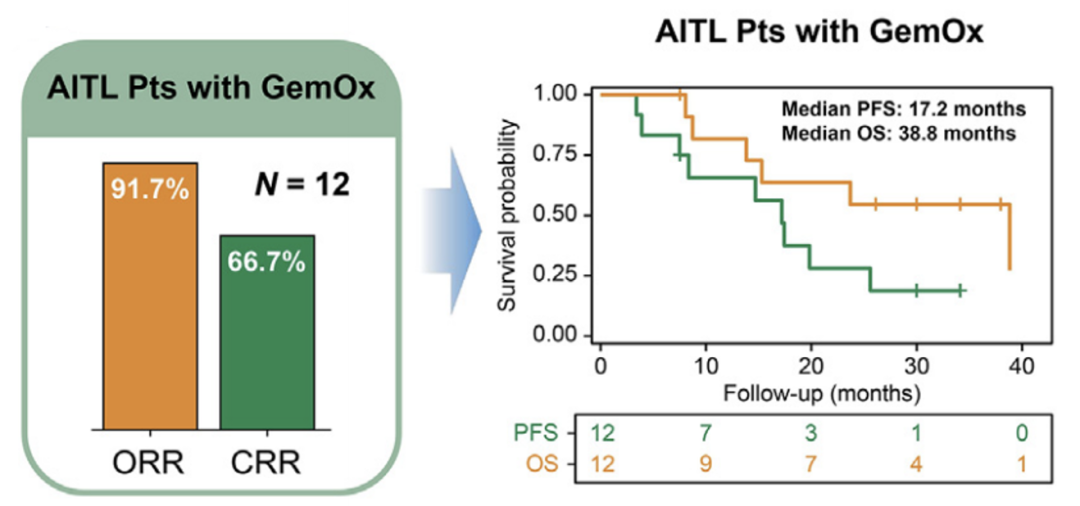
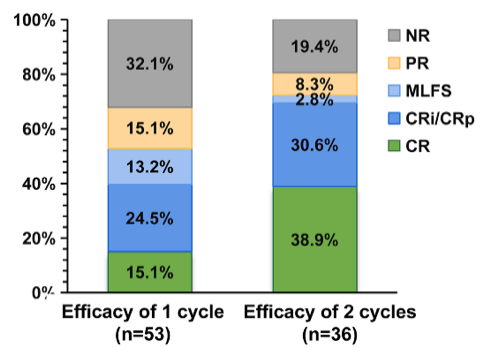
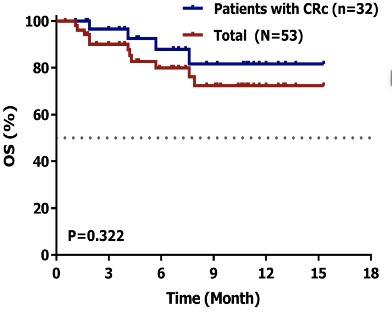
在疗效方面,本研究显示ORR高达96.6%,完全缓解率(CRR)为69.0%。中位随访17个月,中位无进展生存期(PFS)和总生存期(OS)还未达到。排除5名未完成一线治疗的患者和4例随访不足1年且无疾病进展的患者,剩余20例患者的1年PFS为75%,1年OS为90%。
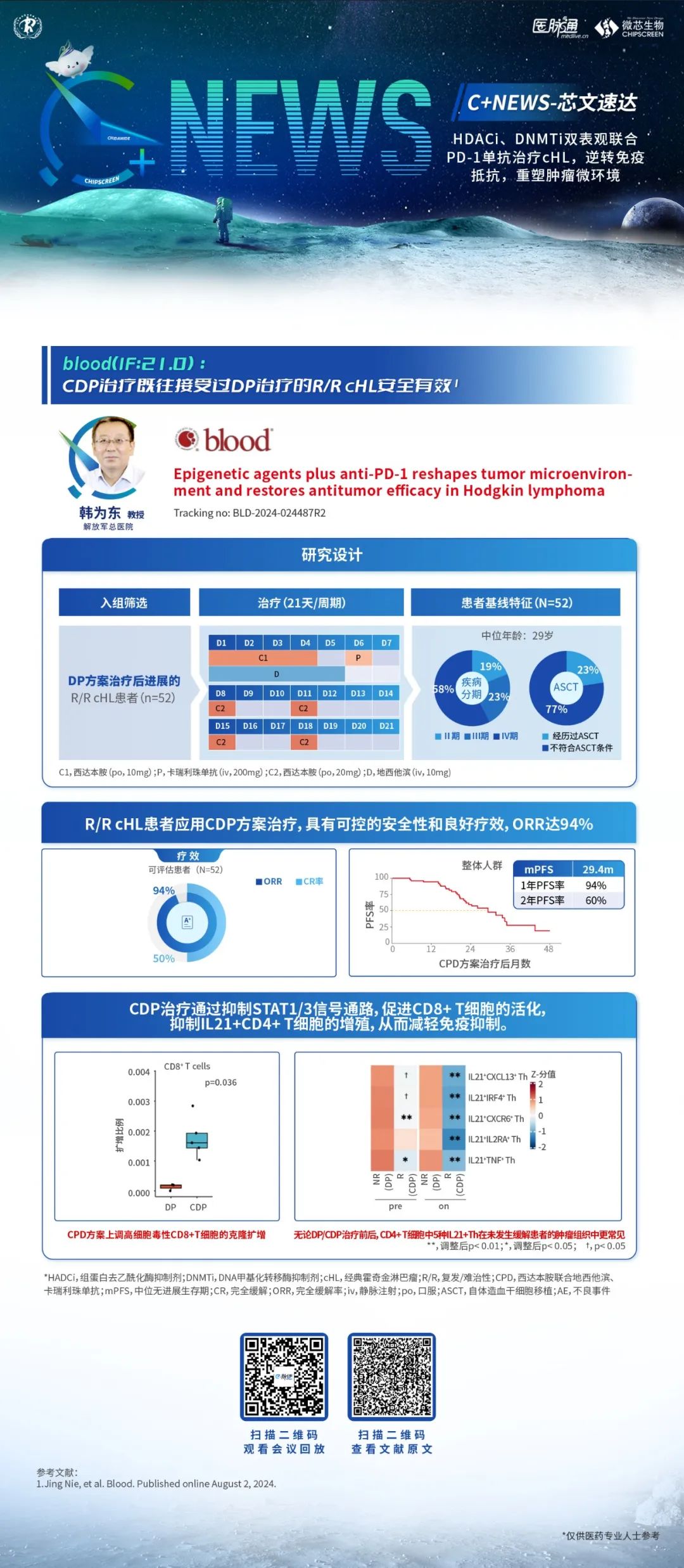
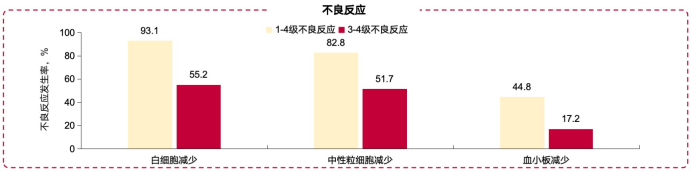
安全性方面,有3例患者因疾病进展死亡,其中1例为PTCL-NOS患者,1例因经济原因在两个周期后停止治疗。该方案最常见的3-4级不良反应包括白细胞减少、中性粒细胞减少和血小板减少。1例慢性乙型肝炎患者在接受了两个周期的AC-CHOP方案后出现丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)4级升高,但后来恢复并完成了剩余治疗。只有1例患者因持续骨髓抑制而停止治疗。
问题三
您刚才分享的这项研究显示,西达本胺和阿扎胞苷联合化疗一线治疗TFH淋巴瘤ORR高达96.6%, CRR为69.0%,同时显示出良好的安全性和耐受性。该研究结果对于TFH淋巴瘤的治疗有哪些积极意义?

周辉 教授
这项研究取得了令人满意的结果,意味着大多数TFH淋巴瘤对西达本胺和阿扎胞苷联合化疗序贯西达本胺维持治疗的方案显示出了非常高的近期有效率,且该方案显示出良好的安全性和耐受性,对于提高患者的长期生存及生活质量有积极意义。
这项研究为TFH淋巴瘤提供了极具希望的新治疗模式,为西达本胺应用于TFH淋巴瘤患者的一线治疗提供了循证依据。但是我们的这项研究也存在局限性,本研究是回顾性的单臂研究,其次患者随访时间相对较短,目前我们已经联合其他中心正在开展前瞻性、多中心、随机对照研究以进一步证实该方案在TFH淋巴瘤的疗效和安全性,期待研究结果能提供更高级别的循证医学证据。
通过RNA剪接,西达本胺在肿瘤相关巨噬
细胞重编程和免疫治疗中的新作用
问题四
您和您的团队是基于怎样的初衷和想法来设计这项试验?

周辉 教授
T/NK细胞淋巴瘤(TNKCL)是一种侵袭性恶性肿瘤,治疗失败率高,复发率高,我们迫切需要寻找新的治疗策略来改善这些患者的预后。肿瘤微环境(TME),特别是肿瘤相关巨噬细胞(TAMs),在肿瘤进展和治疗反应中起着至关重要的作用。TAMs的高度可塑性,是潜在的治疗靶点。
HDACi已显示出对TNKCL的积极疗效,这提示我们需要进一步探索其作用机制。这项研究的目的就是探究西达本胺对TAMs表型的影响及其分子机制,揭示西达本胺独特的抗肿瘤特性,并扩展其临床应用。
问题五
作为这项研究的主要研究者,请您介绍一下该试验的具体方案及研究结果?

周辉 教授
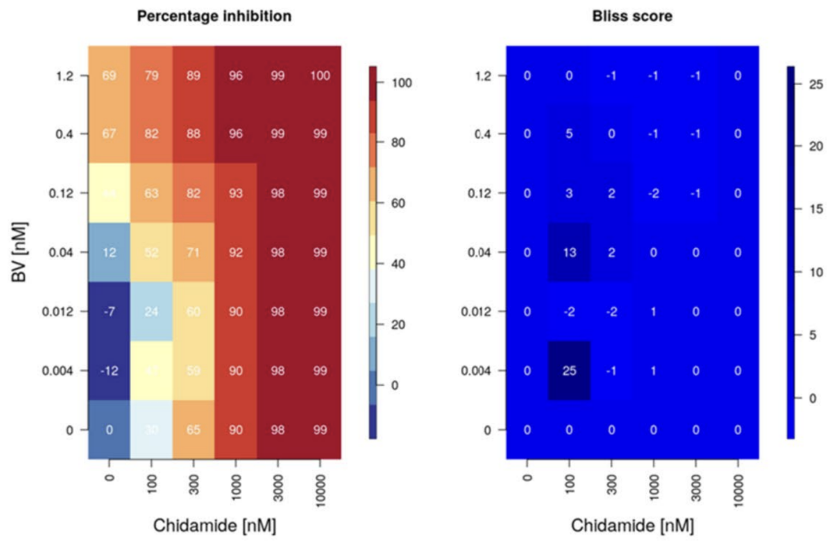
在这项研究中,我们用不同浓度的西达本胺处理了来自人类和小鼠的巨噬细胞,并通过流式细胞术评估了它们的极化状态。建立了共培养模型来观察巨噬细胞对TNKCL细胞的吞噬能力。此外,我们检测了巨噬细胞中炎症相关分子、活性氧(ROS)和代谢改变。
为了深入探究西达本胺的作用机制,我们构建生物素化的西达本胺,并借助质谱和RNA-seq等高通量检测方式鉴定西达本胺重编程巨噬细胞的全新靶点。应用多色流式细胞术和RT-PCR等分子生物学方法验证新靶点的全新作用机制。最后,我们也在T细胞淋巴瘤动物模型中验证了西达本胺抗肿瘤免疫效应的分子机制及其与免疫检查点抑制剂的协同作用。
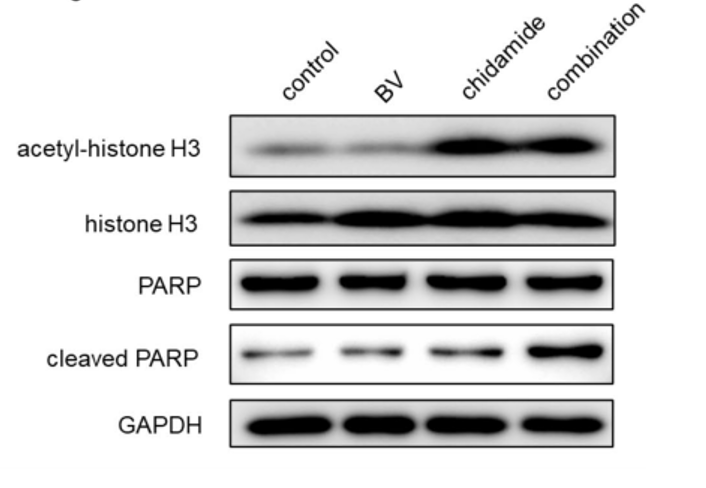
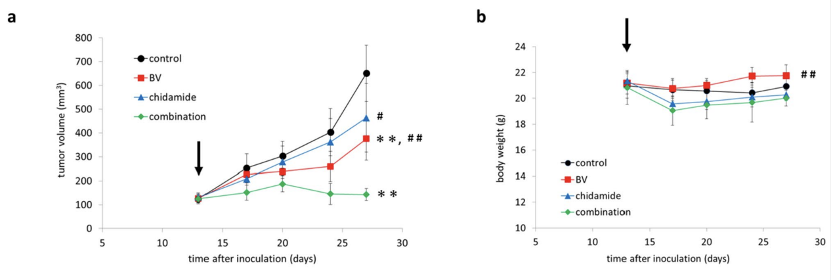
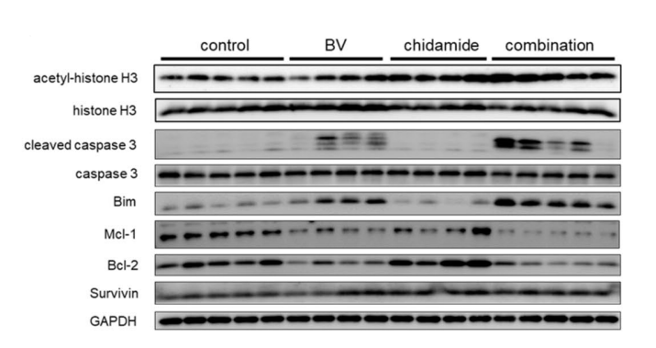
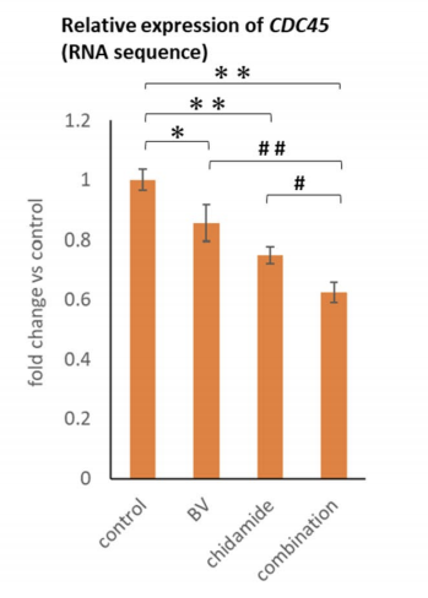
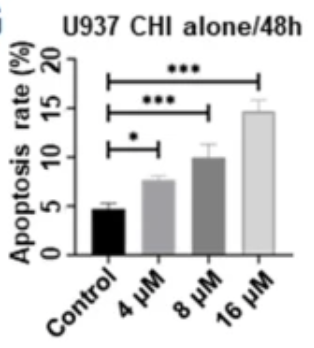
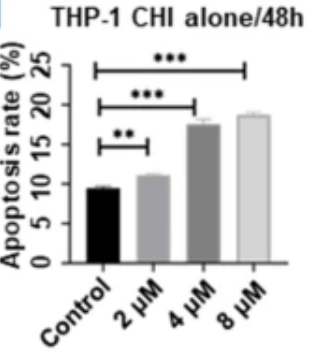
研究结果显示,经西达本胺治疗后, TNKCL患者外周血单核细胞(PBDMs)中的M1型巨噬细胞数量和比例显著增加;在健康志愿者的PBDMs、THP1细胞和小鼠骨髓来源的巨噬细胞(BMDMs)中均观察到西达本胺强大的促M1极化作用,并显著提升巨噬细胞对肿瘤细胞的吞噬能力。通路富集结果显示,经西达本胺处理的巨噬细胞中炎症通路被激活,表现为促炎表型。在动物模型中,西达本胺可明显的抑制T细胞淋巴瘤的生长,同时通过肿瘤免疫微环境的检测发现,肿瘤中M1型巨噬细胞浸润增加,而CD8+ T细胞和NK细胞水平保持不变,表明西达本胺的抗淋巴瘤效果依赖于巨噬细胞。更重要的是,西达本胺促进M1极化的的抗肿瘤机制独特于其他HDACi,并非通过抑制HDAC。并且,西达本胺也不影响巨噬细胞发挥功能相关的ROS、乳酸代谢和TAM受体酪氨酸激酶(TAM-RTK)通路,说明西达本胺促进M1极化依赖全新的靶点和作用机制。
为了寻找西达本胺的新靶点,我们通过质谱检测生物素化的西达本胺的结合产物,确定了RNA剪接因子SF1为西达本胺的新靶点,敲除SF1可消除西达本胺的M1极化效果。通过可变剪接事件分析发现,西达本胺处理的巨噬细胞中外显子跳跃事件显著减少,并且证实SETD4-L和PPWD1-L剪接变体促进了M1极化和增强巨噬细胞的吞噬作用。通过小鼠荷瘤模型,我们检测到西达本胺与抗PD-1抗体的联合使用增强了抗淋巴瘤作用和M1巨噬细胞浸润,这表明西达本胺通过M1巨噬细胞重编程可以提高免疫治疗的疗效。
问题六
您认为这项研究的结果对西达本胺在淋巴瘤治疗上有什么意义?

周辉 教授
我们的研究发现,西达本胺通过促进巨噬细胞的M1极化、显著增强巨噬细胞的吞噬能力,揭示了西达本胺在调节肿瘤微环境中的积极作用;机制上,西达本胺独立于HDAC,通过全新靶点SF1,调控剪接变体SETD4-L和PPWD1-L来促进M1极化,这一全新机制可能为淋巴瘤治疗提供新的方向。此外,西达本胺与PD-1抗体联用显示出增强的M1极化和抗淋巴瘤作用,表明通过M1型巨噬细胞重编程可以提高免疫疗法的疗效。这些新发现不仅开拓了我们对西达本胺抗肿瘤机制的理解,也为未来的淋巴瘤治疗提供了新的策略。
问题七
近年来,您和您的团队在淋巴瘤的治疗方面研究成果颇丰,能简单介绍一下团队的研究成果,以及未来的研究方向吗?

周辉 教授
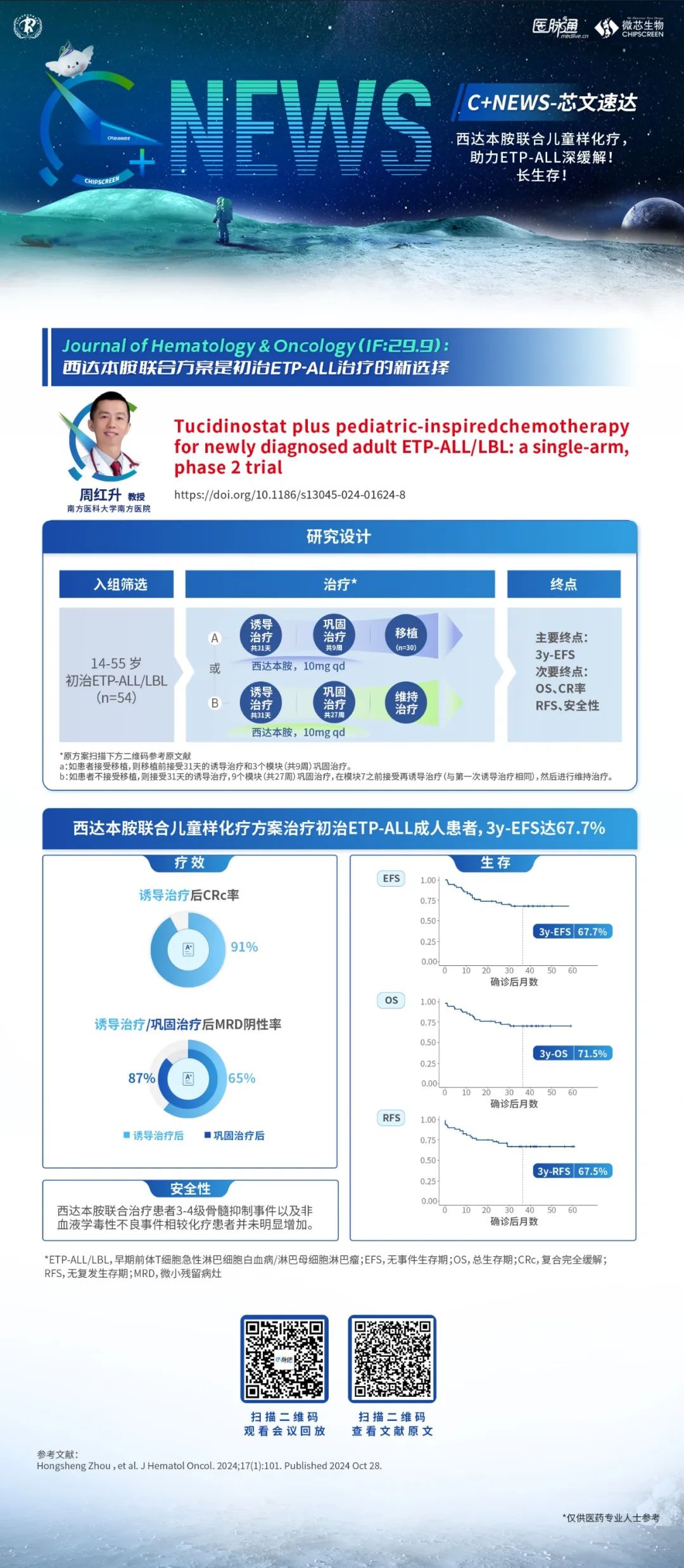
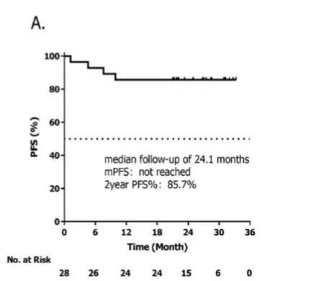
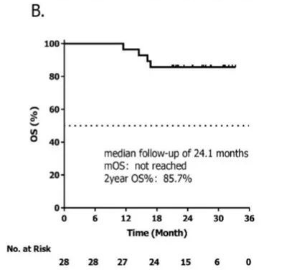
2023年,我们团队在EHA上公布了西达本胺、替雷利珠单抗和培门冬酶(CTP方案)联合放疗一线治疗高危Ⅰ期和Ⅱ期结外NK/T细胞淋巴瘤(ENKTL)患者前瞻性Ⅱ期临床研究结果。最终完成CTP+放疗治疗方案的24例患者,CR率为100%。在可评估疗效的28例患者中,中位随访时间为24.1个月,中位PFS和OS均未达到。2年PFS率及OS率均为85.7%。且整体不良反应可控,安全性得到证实。
目前,我们团队在探索基于HDACi方案一线治疗FTH淋巴瘤和ENKTL方面初步已取得了令人满意的成绩,未来将扩大样本量,优化治疗方案,进一步验证含西达本胺方案治疗不同亚型淋巴瘤患者的疗效和安全性。同时,我们也会继续探索西达本胺的抗肿瘤机制,为未来的淋巴瘤治疗提供新的思路和见解。
专家介绍
Expert presentation
周辉 教授
湖南省肿瘤医院
湖南省肿瘤医院党委委员,副院长
湖南省肿瘤医院淋巴瘤血液内科主任
肿瘤学博士、教授、主任医师、硕士生导师
湖南省抗癌协会淋巴瘤专业委员会主任委员
中国抗癌协会淋巴瘤整合康复专业委员会副主委
中国老年保健协会肿瘤免疫治疗专委会候任主任委员
湖南省淋巴瘤诊疗中心主任
淋巴瘤精准诊疗湖南省工程研究中心主任
中华医学会肿瘤学分会淋巴瘤学组委员
中华医学会肿瘤学分会肿瘤转化医学组委员
中国医促会肿瘤内科分会委员
中国抗癌协会淋巴瘤专业委员会常委
湖南省医学会肿瘤内科学专业委员会
候任主任委员
CSCO抗淋巴瘤联盟委员
CSCO抗白血病联盟委员
中国抗癌协会青年理事会理事

血液相关会议、学术资讯、直播定期推送
☝️扫码进群
本文来源于互联网:并蒂花开,硕果累累 | 周辉教授团队研究:西达本胺联合方案一线治疗TFH淋巴瘤ORR达96.6%,从肿瘤微环境层面揭示抗癌新机制