HDAC抑制剂(HDACi)西达本胺作为新型抗肿瘤机制的表观遗传调控药物,继2014年获批用于复发难治性外周T细胞淋巴瘤(PTCL)后,其用于初治MYC及BCL2表达阳性弥漫性大B细胞淋巴瘤(DLBCL)的适应症也已于2024年4月30日获得中国国家药品监督管理局(NMPA)批准。如今,西达本胺已投入临床切实地为PTCL、DLBCL患者带来获益,其在白血病和多发性骨髓瘤(MM)等多种血液系统肿瘤的研究也如火如荼开展。HDACi是通过何种机制实现广泛的抗肿瘤作用?当前HDACi在血液领域又有哪些研究进展及未来方向?且听复旦大学附属中山医院刘澎教授和中国医学科学院血液病医院魏辉教授共同为我们揭示以西达本胺为代表的HDACi治疗血液肿瘤的机制奥秘,并对HDACi的未来进行展望。
表观遗传学异常在多种血液肿瘤如淋巴瘤、白血病和MM等的发病、恶性转化和预后中均发挥广泛调控作用。HDACi作为肿瘤靶向治疗的研究新热点,其抑制肿瘤细胞的增殖,诱导细胞分化和凋亡作用也已逐步被临床实践证实。基于HDACi独特的机制优势,全球首个口服亚型选择性HDACi西达本胺在血液肿瘤中焕发出勃勃生机,继获批用于R/R PTCL后,于近期获批全新的一线适应症—MYC及BCL2表达阳性DLBCL,相信将为DLBCL患者带来新的治疗选择及治愈希望。
组蛋白去乙酰化酶(HDAC)是重要的维持细胞新陈代谢动态平衡酶,在基因转录、细胞增殖、血管生成、迁移及分化等生物过程中扮演着重要角色。HDACi与不同作用机制的药物例如蛋白酶体抑制剂、免疫调节剂等联用在临床前研究中显示了协同抗肿瘤效果。基于此,HDACi联合方案的多项临床研究方兴未艾,研究结果显示HDACi联合方案在治疗淋巴瘤、白血病和MM领域具有的可观的疗效及可控的安全性,未来相信含HDACi的联合方案的不断探索将有望进一步改善血液肿瘤的患者生存及预后。
HDAC异常与肿瘤的发生存在着明显的相关性,如HDAC3,7定位于染色体断裂段,易于通过突变、易位、缺失而发生改变,引起乙酰化状态的失衡而致病1。HDACi通过增加细胞内组蛋白的乙酰化程度、提高 p21等基因的表达水平等途径,抑制肿瘤细胞的增殖,诱导细胞分化和凋亡1。其中,西达本胺作为HDAC亚型选择性抑制剂,具有对肿瘤异常表观遗传功能的调控作用,通过选择性抑制相关 HDAC亚型,产生针对多条信号传递通路基因表达的调控与改变,进而抑制肿瘤细胞周期、诱导肿瘤细胞凋亡,同时对机体细胞免疫具有整体调节活性,诱导和增强自然杀伤细胞(NK)和抗原特异性细胞毒 T细胞(CTL)介导的肿瘤杀伤作用。西达本胺还通过表观遗传调控机制,诱导肿瘤干细胞分化、逆转肿瘤细胞的上皮间充质表型转化(EMT),进而在恢复耐药肿瘤细胞对药物的敏感性和抑制肿瘤转移、复发等方面发挥潜在作用2。
凭借着机制优势,HDACi西达本胺目前已在血液肿瘤领域获批用于PTCL和DLBCL,并在临床中为众多患者带来了获益,这也证明了HDACi在治疗淋巴瘤方面具有重要价值,为未来在白血病、MM等更多类型血液肿瘤中的应用奠定了坚实的基础,应用前景广阔,未来可期。
1. 刺破黑暗,HDACi为B细胞淋巴瘤患者带来深度缓解、长期生存新曙光
DLBCL是最常见的非霍奇金淋巴瘤(NHL)组织学类型,具有高度异质性。R-CHOP方案一线治疗后仍有30%-40%的患者无法得到治愈,易进展为难治复发。CD20丢失是利妥昔单抗相关方案治疗R/R DLBCL的主要障碍。RNA测序显示,HDACi西达本胺可显著上调DLBCL细胞中2000余个转录子的表达水平,克服利妥昔单抗介导的CD20表达下调,并上调CD20表达(图1)。因此,西达本胺协同增强利妥昔单抗诱导的肿瘤生长抑制作用3,此外,西达本胺可通过抑制JAK/STAT3途径下调DLBCL细胞中c-MYC和BCL2表达4,从而为治疗利妥昔单抗耐药的双表达DLBCL患者提供了全新的治疗策略和思路。
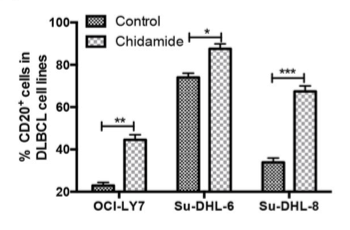 图1.西达本胺对DLBCL细胞中的CD20表达的影响
图1.西达本胺对DLBCL细胞中的CD20表达的影响
多项临床研究均显示HDACi联合方案治疗B细胞淋巴瘤的潜力,其中DEB研究是全球首个以初治MYC/BCL2双表达DLBCL为适应症的多中心III期注册临床研究,期中数据分析显示,西达本胺联合R-CHOP方案CR率显著高于对照组(73% vs. 61.8%, P=0.014)2,基于西达本胺联合方案良好的疗效及安全性,于2024年4月30日获得NMPA批准,用于MYC和BCL2阳性的初治DLBCL患者的治疗,为此类患者带来更多治愈的希望。
2. 卓有成效,HDACi为NK/T细胞淋巴瘤治疗注入了新鲜血液
免疫逃逸和异常表观遗传调控是NK/T细胞淋巴瘤的重要分子遗传学特征5。BCL-6共抑制因子(BCOR)和混合谱系白血病2(MLL2)的突变和异常表达模式也与NK/T细胞淋巴瘤息息相关。表观遗传调节剂可以在增强肿瘤微环境、恢复免疫识别和免疫原性方面发挥主要作用,其中HDACi通过对抑癌基因的组蛋白乙酰化作用对癌细胞产生多种细胞毒性作用6,是治疗NK/T细胞淋巴瘤的潜在治疗药物。
SCENT研究是一项西达本胺联合PD-1单抗治疗R/R 结外NK/T细胞淋巴瘤的临床试验,结果显示,在意向治疗人群(n=37)中,客观缓解率(ORR)为59.5%,完全缓解(CR)率为48.6%。接受治疗人群的中位无进展生存期(PFS)为23.2个月,中位总生存期(OS)为32.9个月 (图2a, b)7。研究提示HDACi西达本胺可与PD-1单抗联用发挥协同抗肿瘤作用,助力此类患者获得深度且持久的缓解。
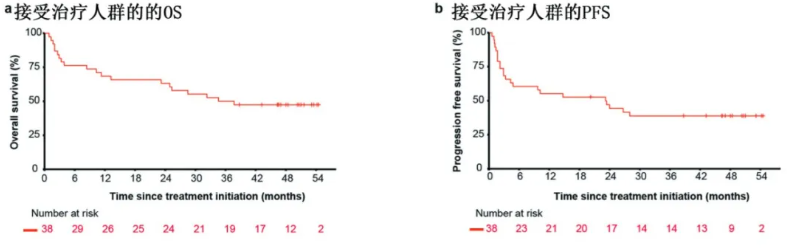 图2. SCENT研究接受治疗人群患者客OS率和PFS率
图2. SCENT研究接受治疗人群患者客OS率和PFS率
3. 厚积薄发,HDACi联合方案有望为白血病患者带来新突破
急性髓系白血病(AML)是一类具有高度异质性的常见白血病亚型,长期预后不理想,标准诱导治疗方案后达到CR患者,仍有约50%陷入复发困境,亟需更有效的靶向治疗及新药联合方案。HDACi已被证明在AML中具有抗白血病作用。研究显示,西达本胺单药或联合方案可抑制AML细胞增殖,诱导G0/G1阻滞,增加细胞凋亡(图3)和化学敏感性8。
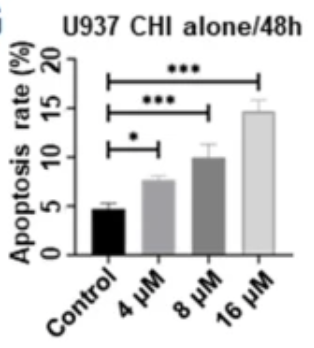
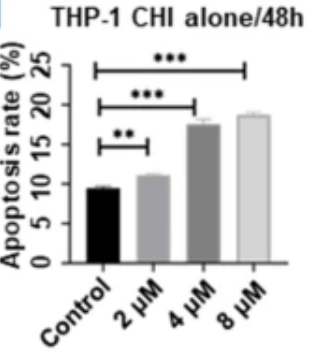
图3.西达本胺显著增加了肿瘤细胞的凋亡率
一项西达本胺联合维奈克拉和阿扎胞苷治疗R/R AML的研究9,表现出令人鼓舞的疗效及良好的安全性。53例患者ORR达68%,2个治疗周期后CRc率为72%,ORR为81%,中位随访6.7个月,中位OS仍未达到。
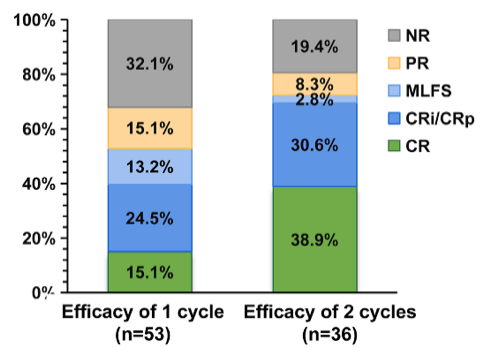
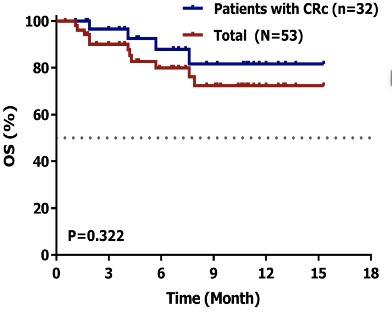
图4. 西达本胺联合维奈克拉和阿扎胞苷治疗的患者ORR和OS率
4. 协同增效,HDACi联合方案为MM治疗提供新思路
MM目前仍是一类不可治愈的疾病,HDAC在MM中过表达,且与MM发生发展密切相关。HDACi通过抑制HDAC可阻滞NF-κB信号传导和HSP90、上调细胞周期调节因子例如p21和p53的表达,下调抗凋亡蛋白BCL-2的表达,诱导细胞凋亡;诱导DNA损伤和氧化应激10,通过多种途径发挥抗MM作用。临床前研究显示HDACi与硼替佐米和地塞米松联合方案具有协同抗MM作用。HDACi单药研究的安全性数据也为联合方案研究奠定了基础,目前已有多项研究旨在探索HDACi联合地塞米松方案治疗的有效性,越来越多的结果表明,与地塞米松的联合方案可以提高R/R MM的疗效10。
此外,另一项临床前研究显示HDACi西达本胺联合维奈克拉方案具有协同抗肿瘤效果,通过上调BIM表达,表现出良好的抗肿瘤活性,有望在临床实践中为MM患者提供新选择11。
血液肿瘤已进入个体化精准化治疗时代。基于HDACi的多项基础与临床研究成果,目前已有多款HDACi在全球范围内上市。因其可与多类药物联合发挥协同抗肿瘤作用,继续探究HDACi与其他药物联合用药机制将有助于提升疗效,改善患者生存。而HDACi最优协同治疗方案的选择,也是临床专家面临的挑战。随着HDACi在临床的广泛应用,早期评估、合理预防、加强临床监测和及时治疗是防治药物不良反应的关键12。结合药物应用现状,未来可进一步探索HDACi在血液肿瘤前线治疗的有效性及安全性,也期待HDACi拓展更广泛适应症造福更多其他肿瘤患者,为实现健康中国2030计划添砖加瓦。


刘澎教授
-
教授,主任医师,博士生导师
-
复旦大学附属中山医院血液科主任
-
复旦大学“校聘关键岗位”引进人才
-
上海市卫生系统优秀学科带头人
-
上海市医学会血液学专科分会副主任委员
-
上海市肿瘤防治联盟淋巴瘤专委会主任委员
-
中华医学会血液病学分会委员
-
中国医师协会血液科医师分会委员
-
中国抗癌协会血液肿瘤专委会委员
-
中国生物医学工程学会干细胞工程技术分会副主任委员
-
主持国家自然科学基金3项
-
获得“中华医学科技奖” 等省部级科技奖励


魏辉教授
-
中国医学科学院血液学研究所血液病医院
-
主任医师,博士生导师
-
白血病诊疗中心主任
-
国家血液系统疾病临床医学研究中心副主任
-
中华医学会血液学分会委员,白血病淋巴瘤学组副组长
-
中国抗癌协会血液肿瘤专业委员会副主任委员
-
Hematological Oncology副主编
-
主要从事白血病的基础和临床研究
参考文献:
1. Alison J. et al. Novel Agents in Hodgkin Lymphoma. Curr Oncol Rep, 2012, 14:419-423.
2. 西达本胺片说明书
3. Guan, XW, et al. Cell Death Dis 11, 20 (2020).
4. Zhang H, et al. Mol Med Rep. 2021;23(5):308.
5. Gao Y, et al. Signal Transduct Target Ther. 2024 May 17;9(1):121.
6. Xiao‑Peng Tian, et al. J Hematol Oncol. 2023 Jul 22;16(1):78.
7. Gao, Y., et al. Sig Transduct Target Ther 9, 121 (2024).
8. Gu S, et al. Exp Hematol Oncol. 2023 Feb 27;12(1):23.
9. Xu B, et al. Blood (2023) 142 (Supplement 1): 4274.
10. Pu, J, et al. Exp Hematol Oncol 13, 45 (2024).
11. Cao L, et al. Clin Epigenetics. 2022 Jul 7;14(1):84.
12. 中国临床肿瘤学会(CSCO)淋巴瘤专家委员会, 等. 白血病·淋巴瘤, 2021, 30(9) : 518-523.


戳“阅读原文”,查看更多内容