本共识详细介绍了肠内营养的历史、发展及肠内营养制剂的临床应用。肠内营养是指通过胃肠道途径提供营养物质。其营养制剂主要有粉剂、混悬液和乳剂。肠内营养制剂的主要评价参数有能量密度、蛋白质含量、蛋白质来源;次要评价参数有渗透压、脂肪含量、脂肪来源等。营养不良是肠内营养主要应用的疾病,同时根据适应症和禁忌症采用不同的给药方式。肠内营养的并发症及防治也同样重要,患者病情变化或代谢状态改变时,临床药师需积极调整调整肠内营养方案。
指南与共识|重症病人胃肠功能障碍肠内营养专家共识(2021版)
亚洲急危重症协会中国腹腔重症协作组. 重症病人胃肠功能障碍肠内营养专家共识(2021版)[J]. 中华消化外科杂志, 2021, 20(11): 1123-1136. DOI: 10.3760/cma.j.cn115610-20211012-00497.

蒋正英教授

常志刚教授

李维勤教授
亚洲急危重症协会中国腹腔重症协作组
通信作者:蒋正英 常志刚 李维勤
重庆大学附属肿瘤医院重症医学科
北京医院外科重症医学科
中国人民解放军东部战区总医院重症医学科,南京
重症病人早期肠内营养至关重要,然而其临床实践仍充满挑战。中国腹腔重症协作组9家医院25位专家,针对重症病人胃肠功能障碍的病因及评估、早期肠内营养实施策略,以及各种临床实践中的具体方案进行讨论,并提出18项临床最为关注的问题,综合循证医学证据及临床经验,最终制订该共识,旨在为临床医师提供参考及指导,以期改善病人预后。
胃肠疾病; 胃肠功能障碍; 重症疾病; 肠内营养; 专家共识
目前重症病人营养支持治疗相关指南及共识推荐危重症病人入住ICU 24~48 h内尽早启动肠内营养[1-2]。肠内营养有助于营养胃肠黏膜,增强神经内分泌功能,有益于保留肠道黏膜屏障功能和免疫功能。早期肠内营养与降低感染率,加速伤口愈合,缩短机械通气时间、ICU住院时间和总体住院时间,以及降低病死率有关[1-4]。然而在临床实践中,由于ICU病人的个体差异性较大,不同病种或病程病人胃肠功能受损程度不同、对肠内营养的耐受性差异很大,胃肠功能障碍重症病人开展肠内营养支持治疗仍充满挑战。因此,中国腹腔重症协作组9家医院25位专家,针对胃肠功能障碍重症病人如何评估、实施肠内营养,讨论并提出18项临床最关注的问题。
首先每位专家成员选择1~2个条目,综合循证医学证据以及临床经验给出相关建议,形成共识初稿。然后通过电子问卷形式将共识初稿发给25位专家,专家根据共识条目的理论依据、科学性、创新性、可行性等特征综合评分。综合评分以1~10分计分,其中1~4分为不推荐,5~7分为弱推荐,8~10分为推荐。最后统计分析25位专家的评分,确定各条目的推荐强度,最终形成共识。
一、胃肠功能障碍的基础概念与评估
(一)胃肠功能障碍的定义与分级
胃肠功能主要包括消化吸收功能、黏膜屏障功能、内分泌功能及免疫功能等,其中消化功能包括胃液、胰液、胆汁和肠液的化学性消化及胃肠运动的机械性消化作用。临床上胃肠运动功能障碍与胃肠屏障功能障碍是危重症病人常见的两大主要障碍[5]。危重病人胃肠运动功能障碍率高达60%[5]。其临床表现包括胃食管反流(有或无吸入性肺炎)肠鸣音消失或改变、腹胀、腹痛、腹泻、便秘、胃排空延迟、肠内喂养不耐受、肠梗阻等,其中胃排空延迟与肠内喂养不耐受是最具代表性的临床表现。胃肠屏障功能障碍的临床表现包括胃肠黏膜应激性病变(stress related mucosal disease,SRMD)胃肠出血、肠道细菌移位、脓毒症、MODS等[6]。
胃肠功能障碍的分级有多种标准。根据2012年欧洲重症医学协会腹部疾病工作组(ESICM-WGAP)制定和颁布的《急性胃肠损伤的定义与分级诊疗建议》,目前急性胃肠损伤(acute gastrointestinal injury,AGI)定义为由于重症病人急性疾病本身导致的胃肠功能障碍,根据严重性进行分级[7]。见表1。
近年床旁超声检查由于其便利性及普及性逐渐被用于重症病人的日常评估。在胃肠功能障碍领域中,有研究者设计评分系统探索其在评估重症病人胃肠功能损伤情况及预测喂养不耐受等方面的作用,如急性胃肠损伤超声(acute gastrointestinal injury ultrasonography,AGIUS)检查评分、胃肠泌尿系统损伤超声(gastrointestinal and urinary tract sonography ultrasound,GUTS)检查评分等,研究结果显示:两种评分系统评估及预测效果良好,但仍需更多的研究结果佐证及优化[8-9]。下面以AGIUS评分为例,通过床旁超声检查的客观数据评估病人胃肠功能。见表2。
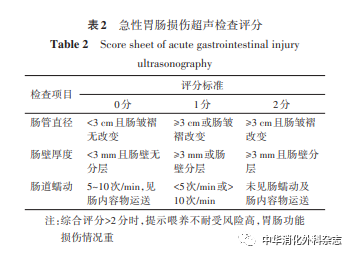
推荐意见1:临床最常用的胃肠功能障碍定义与分级标准为AGI分级。AGI根据临床表现分为4级,较为主观。更为客观的有超声评分系统,如AGIUS评分、GUTS评分等,可用于评估重症病人胃肠功能损伤情况及预测喂养不耐受。[推荐强度:(8.47±1.42)分]
(二)胃肠功能障碍的常见原因
肠神经系统中的肠神经胶质细胞对胃肠功能的影响越来越受到关注[10]。有研究结果显示:在肠道炎症过程中(如炎症性肠炎、大肠杆菌感染),肠神经胶质细胞数目减少或变性,转化为反应型肠神经胶质细胞表型,破坏肠神经胶质细胞神经介质传递的网络结构,肠神经元轴突变性、坏死,引起胃肠功能障碍[11]。
胃肠运动功能受多种因素影响[12]。见表3。腹部外科手术打击对胃肠运动功能影响最直接,有研究结果显示:90%的腹部手术会发生术后肠梗阻[13]。术后胃肠功能障碍是由手术应激导致的胃肠功能紊乱,与手术方式、手术操作、内环境紊乱、麻醉或镇痛因素、血流灌注、炎性反应及神经内分泌等因素有关[14]。此外,重症病人常接受阿片类药物行镇痛治疗,可直接影响胃肠道动力。过量液体复苏,肠道组织水肿也可导致严重胃肠运动障碍[15]。在应激病理刺激时(如创伤、烧伤、大手术、大出血、严重感染、休克等),肠道因低灌注而缺血、缺氧、酸中毒,通过中枢神经系统、肠神经系统及胃肠激素的作用,诱导激活肠免疫反应功能,释放各种炎症因子、一氧化氮、前列腺素大量合成,肠黏膜屏障功能的完整性遭到破坏,导致肠道内环境失衡、SRMD、穿孔、出血。在采取预防措施前,SRMD的发生率可高达100%[16]。
此外,根据胃肠功能障碍发病机理,AGI可分为原发性与继发性[5]。原发性AGI与原发疾病或胃肠系统器官直接损伤相关,如急性腹膜炎,急性胰腺炎、肝脏疾病、腹部外科手术或腹部创伤等。继发性AGI是由危重病人宿主反应而致,而无胃肠系统直接损伤的主要病因,如脓毒症、ARDS、心脏疾病、非腹部手术及危重疾病的复苏治疗等。
推荐意见2:胃肠功能障碍受病人基础疾病,以及内、外源性多种因素影响,根据发病机理可分为原发性AGI与继发性AGI。[推荐强度:(8.94±0.89)分]
(三)胃排空与胃潴留的监测
目前用于胃排空的诊断工具有核素显像、无线运动胶囊实验、胃排空呼气实验、MRI检查等,其中核素显像是胃排空评估的金标准。但以上方法昂贵且复杂,在ICU环境中不易操作,故难以作为重症病人的常规评估方法[17]。目前临床上评估胃潴留最常用的方法为胃残余量测量[18]。
在实施肠内营养过程中通过测量胃残余量评估胃潴留,旨在评估病人胃排空能力、预防吸入性肺炎,但相关文献中很少有数据支持其标准性及有效性,具体实施方法亦存在争议[19]。有研究纳入153例胃管喂养的重症病人,结果显示:重症病人经胃管喂养,高胃残余量很常见,且发生时间早,尤其在镇静或昏迷病人中更频繁,同时高胃残余量是上消化道喂养不耐受的早期标志,与院内获得性肺炎、ICU病死率密切相关[20]。有研究结果显示:胃残余量为150~300 mL可作为给予胃肠动力药物治疗的临界值,胃残余量为250 mL可作为喂养不耐受的早期诊断标准,需要启动早期干预治疗[21-22]。欧洲临床营养与代谢学会(ESPEN)指南建议胃残余量>500 mL/6 h应推迟肠内营养[1]。
胃残余量的测量方法有包括(1)经典测量:停止鼻饲后,脱开营养泵管,使用50 mL或60 mL规格注射器连接鼻胃管后回抽,多个注射器回抽得的胃内容物总量即为胃残余量[23]。(2)改良测量:停止鼻饲后,将鼻胃管的连接管接入胃残余量收集袋,并将其挂在床边或放在低位,收集15 min后计算总量;若营养管内有气泡或未见胃内容物自主流入收集袋,可轻压病人腹部[23]。这两种通过鼻胃管收集胃残余量的方法,通常受鼻胃管的材质、内径、管尖位置和具体实施操作手法等影响。(3)超声检查测量:床旁超声检查评估胃残余量在健康人或重症病人的测量结果与其胃内容物量有良好的线性关系[24]。通过超声检查测量胃窦横截面积(cross-sectional area,CSA)评估胃残余量的具体操作如下:病人仰卧位,床头抬高30°(若椎体或骨盆骨折,则床整体斜坡抬高30°),将凸阵超声探头放置在病人腹上区,探头与身体纵轴平行,指示点指向病人头侧,探头自左向右滑动扫描,依次可观察胃底、胃体及幽门切面,获取幽门部矢状位横截面图像,测量前后径(Dap)及头尾径(Dcc),根据公式:usCSA(cm2)=(Dap×Dcc×π)/4,胃容量(mL)=27.0+14.6×CSA‒1.28×年龄[25]。一项系统性回顾分析结果显示:若测得胃内容量>1.5 mL/kg,提示高误吸风险[26]。
推荐意见3:胃残余量测量是评估胃潴留最常见的方法,包括经典测量法、改良测量法和超声检查评估法。胃残余量≥250 mL提示喂养不耐受,需尽早启动干预治疗。[推荐强度:(8.29±1.21)分]
(四)喂养不耐受的定义及评估方法
喂养不耐受是ICU病人实施肠内营养过程中的常见事件,发生率为2%~75%[27]。喂养不耐受的定义通常是指在喂养过程中由于各种原因(如呕吐、高胃残余量、腹泻、胃肠出血等)导致肠内营养输注量减少[28]。病人经72 h尝试肠内营养,仍不能达到20 kcal/(kg·d),需考虑喂养不耐受。但既往部分研究常结合胃肠道症状定义胃肠不耐受。Reintam Blaser等[29]的研究结果显示:病人入住ICU第1天,出现≥3个胃肠道症状与28 d病死率相关,但单一胃肠道症状与病死率无关。另一项回顾性研究比较不同喂养不耐受的定义,结果显示:多个胃肠道症状联合与ICU病死率显著相关,同时肠内输注量减少与90 d病死率强相关[30]。然而,肠内营养输注量减少通常由喂养不耐受引起,且不利于优化管理[31]。
目前重症病人喂养不耐受的精准评估仍较为困难,尤其是昏迷或深镇静病人。针对胃肠功能障碍,可根据ESICM提出的AGI严重程度分级进行评估,评估内容包括呕吐、高胃残余量、腹泻、胃肠出血、腹内压等。东部战区总医院于2018年开展一项关于喂养流程的多中心整群随机对照研究(randomized controlled trial,RCT),制订了基于胃肠道症状的喂养不耐受评分辅助肠内营养的实施[32]。见表4。
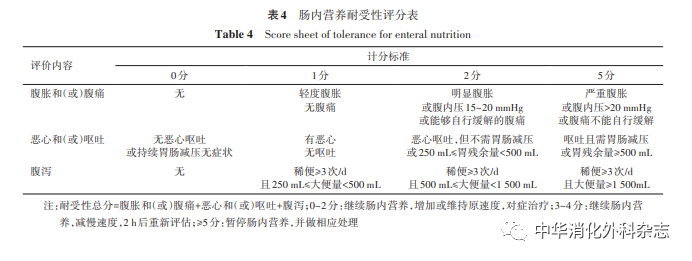
推荐意见4:喂养不耐受指喂养过程中由于各种原因导致的肠内营养输注量减少。评估喂养不耐受通常基于胃肠道症状,如高胃残余量、呕吐、腹胀、腹泻等。[推荐强度:(8.59±0.94)分]
(五)胃肠吸收功能的评估
胃肠吸收功能是指胃肠道对脂肪、蛋白质、碳水化合物和各种矿物质和微量元素的消化吸收能力。吸收不良是指病变发生在胃肠道表面的消化细胞(胃、肠细胞)或淋巴系统导致吸收功能下降[17]。影响消化道吸收的主要因素是吸收表面长度、肠黏膜完整性和运动能力[33-34]。胃肠道吸收功能的主要监测手段有:粪便检查、同位素标记检查、尿液检查等,糖吸收试验包括右旋木糖试验反映小肠对糖类的吸收功能,氢呼气试验提示胃肠道对乳糖的吸收情况[35-37]。131I标记甘油三酯、14C甘油三酯呼气试验、粪便脂质含量测定可判断脂肪的吸收情况[38-39]。蛋白质吸收试验包括a1-抗胰蛋白酶和放射性标记Alb的粪便清除[40-41]。微量元素包含维生素B12吸收试验、胆盐吸收试验等[42]。
推荐意见5:目前暂无公认的测定胃肠吸收功能特异性较高的血液生物标志物或者试验。主要监测手段有粪便检查、同位素标记检查、尿液检查等。[推荐强度:(7.82±1.13)分]
二、胃肠功能障碍的早期肠内营养策略
(一)胃肠功能障碍启动肠内营养时机
大量证据表明入住ICU后24~48 h内早期实施肠内营养有益[1-2]。对于胃肠功能障碍病人,ESICM-WGAP建议根据AGI分级启动最低剂量肠内营养(20 mL/h),随后在AGI Ⅰ级病人中将营养剂量增加至计算能量的100%;对AGI Ⅱ级或AGI Ⅲ级病人,建议从最低剂量开始尝试,根据症状给予其他治疗(如促胃肠动力药);而对于AGI Ⅳ级病人则不建议给予肠内营养[7]。该指南建议在开始肠内营养前评估胃肠功能,但未涉及具体评估方法和开启肠内营养方式;且这些建议并不完全基于证据,特别是在AGI病人的肠内营养管理方面仍缺乏证据。
根据共识执笔者临床经验,对于AGI Ⅰ~Ⅲ级病人,开启肠内营养后,应监测肠内营养耐受情况,根据喂养耐受评分(表4)调整肠内营养速度[32]。
推荐意见6:AGI Ⅰ~Ⅲ级病人可从最低剂量开始肠内营养,AGI Ⅳ级病人不建议给予肠内营养。[推荐强度:(8.65±0.86)分]
(二)胃肠功能障碍启动肠内营养的速度与喂养量
AGI病人肠内营养通常存在喂养不耐受,因此选择肠内营养制剂首先考虑胃肠功能。对于胃肠功能正常或轻度损害病人(AGI≤Ⅰ级),尝试初始速度为25 mL/h的整蛋白肠内营养配方。对于胃肠功能中度损害病人(如AGI Ⅱ~Ⅲ级):尝试初始速度为10~15 mL/h的短肽型预消化肠内营养配方。对于胃肠功能重度损害病人(如AGI Ⅳ级):暂无法肠内营养[1,5]。综上,AGI病人肠内营养应从低剂量(10~20 mL/h)开始,期间动态评估胃肠道耐受性,动态监测腹内压,缓慢、谨慎、逐步增加喂养速度直至达到目标喂养量[43]。
2016年美国肠外和肠内营养学会(ASPEN)指南推荐,重症病人的常规目标喂养量为25~30 kcal/(kg·d),目标蛋白需要量通常为1.2~2.0 g/(kg·d)[2]。对于AGI病人不要求早期肠内营养能够满足病人的全能量需求,低热卡肠内营养可能更安全。早期阶段最适的能量和蛋白目标尚不清楚,建议对重症病人采取渐进式喂养策略,在ICU早期(前72 h),保持<70%的能量目标;ICU住院第1周内,逐步达到70%~100%。
推荐意见7:胃肠功能障碍病人应依据AGI分级,选择不同的肠内营养制剂和喂养速度;早期低热卡肠内营养可能更安全,对重症病人可采取渐进式喂养策略。[推荐强度:(8.82±0.81)分]
(三)胃肠功能损伤肠内营养的制剂与配方
>50%的ICU病人存在喂养不耐受[44]。且80%的颅脑损伤及50%机械通气的病人术后存在胃排空延迟及不同程度的胃肠功能损伤。因此,采用改善病人耐受的肠内营养配方才是合理的喂养方案。改善病人耐受的肠内营养配方包括短肽型预消化配方、中链甘油三酯营养配方及含益生菌配方等[45]。由于肠上皮细胞吸收短肽,水解蛋白营养配方可应用于整蛋白不耐受重症病人;中链甘油三酯营养配方可快速被小肠吸收、肝脏代谢,易被消化,可改善胃排空,部分降低胆囊收缩素、胰高血糖素样肽‑1等胃肠激素分泌[46]。此外,在一项急性胰腺炎研究中含有益生元(低聚果糖的混合物)和其他可溶性、不溶性纤维肠内营养配方可改善临床结局,但仍需更高质量的研究确定补充益生元肠内制剂对胃肠功能损伤危重病人的临床效果[45]。
对于胃肠功能损伤病人,建议根据AGI严重程度分级指导营养配方的选择。对于AGI Ⅰ~Ⅱ级病人,如无禁忌证可予以整蛋白肠内营养配方,有短肠综合征等胃肠功能障碍病人可考虑予以短肽型预消化配方[47]。对于AGI Ⅲ级病人,建议在保证避免胃肠功能损伤进展的情况下,可考虑予以短肽型预消化配方滋养喂养,同时可早期予以补充性肠外营养[48]。
推荐意见8:对于胃肠功能损伤的病人,建议根据AGI严重程度分级指导营养支持策略。[推荐强度:(8.71±0.85)分]
(四)保护胃肠功能的方法
胃肠功能障碍早期症状不典型,容易被忽视。目前通常是在病人出现明显症状后对症处理,主要方法如下:(1)积极有效地恢复肠道血供、氧供,改善肠道缺血状态。应用抗氧化剂(如谷胱甘肽),可清除氧自由基,减少肠道缺血及再灌注损伤。(2)改善胃肠道微循环。给予小剂量多巴胺和前列环素,可改善胃肠黏膜低灌流状态[49]。应用人重组生长激素等药物可促进肠黏膜修复[50]。(3)维护胃肠道微生态平衡。生态免疫营养剂(如双歧杆菌、乳酸杆菌等)可巩固肠道生物屏障,恢复肠道菌群生态平衡[51]。Suez等[52]的研究结果显示:益生菌有利于保持肠道微生态环境平衡,纠正多种病理状态下的菌群紊乱。此外,合理使用抗菌药物及免疫抑制剂,维护肠道“定植抗力”,也是维持胃肠道微生态平衡的重要措施[53]。(4)肠内营养支持。早期、合理的肠内营养可为肠黏膜提供足够的能量合成,促进肠道功能康复。此外,给予谷氨酰胺、精氨酸等肠道本身需要的特殊营养物质,可防止肠黏膜萎缩,促进肠蠕动及肠功能恢复,并维护肠道黏膜的正常结构与屏障功能[54]。(5)肠道清洗。危重症病人多使用镇静、镇痛药物,常存在高血糖、低血钾,这些因素均是胃肠功能障碍的危险因素。因此,应防止低血钾等诱因,防止发生肠麻痹,尽早给予通便措施[55-56]。(6)改善胃肠道动力。给予多潘立酮等促胃肠动力药物,可刺激胃和小肠,促进胃排空,提高肠内营养的耐受性[57]。也有研究表明针灸治疗可促进胃肠动力[58]。(7)中药治疗。中药大黄具有攻下泻火、荡涤肠胃等功能。一项Meta分析结果显示:大黄不仅能保护胃肠黏膜、促进胃肠蠕动、排除细菌和毒素,改善微循环,有效预防肠道功能紊乱,对应激性胃肠黏膜病变等也有独特的治疗作用,大黄治疗后胃肠功能衰竭的缓解率为80.4%,胃肠功能衰竭的持续时间明显缩短[59]。其他方药如四君子汤、清胰汤、承气方剂等对胃肠功能障碍亦有调节作用[60]。(8)相关护理措施。主要为对症处理,包括腹胀给予禁食、胃肠减压、肛管排气及腹部按摩,便秘予灌肠通便,腹泻予止泻剂等。
推荐意见9:胃肠功能障碍发病机制复杂,诱因较多,早期有效预防及治疗是最关键的措施。具体措施包括恢复肠道血流、改善胃肠道微循环、维护胃肠道生态平衡、肠内营养支持、肠道清洗、改善胃肠道动力、中医中药治疗等。[推荐强度:(8.53±1.01)分]
(五)微生物组群的调控在肠道功能紊乱中的作用
人类胃肠道中存在大约100万亿种微生物,其中大部分是细菌,但也有病毒、真菌和原生动物,包含远超于人类的基因编码信息。近年来随着微生物组学的研究发展,动物模型和人体研究证据均支持肠道微生物群对人类健康可产生关键作用,如免疫、代谢、神经行为特征等[61-62]。微生物组学旨在鉴定微生物组的组成成分,分析微生物基因组,表征微生物组与宿主之间的相互作用,并确定其对疾病病理学的影响[63]。
肠道微生物组的治疗操作通常通过改变饮食、服用益生元、益生菌、合生元或抗菌药物,以及粪便微生物组移植实现[64]。益生菌是一类在肠道中增殖并发挥积极健康影响的微生物。益生元是不可消化的低聚糖,可促进肠道中特定细菌的生长和(或)活性,如菊粉、低聚果糖、低聚半乳糖、异麦芽低聚糖、大豆低聚糖、焦糊精和乳果糖等。合生元是指益生菌和益生元的混合制品,或再加入维生素和微量元素等。上述疗法旨在将生态失调的微生物群落状态转变为健康的微生物群落稳定状态,但是其功效尚未完全确定。Seif教授及团队进行一项肠道微生物调控对重症病人肠内营养耐受性影响的系统评价,共纳入15篇文献,在肠道微生物调控对能量摄入量影响上,6项相关研究中只有2项研究显示使用益生元组能量摄入显著增加。在益生菌降低达到目标热卡所需时间上,4项RCT中只有1项发现显著作用;在腹泻发生率及持续时间上,12项相关RCT中7项显示肠道微生物调控有益。在临床终点(总体住院时间、ICU住院时间)上,除1项研究外,其余研究均未发现肠道微生物调控治疗可产生有益影响[64]。在艰难梭菌感染中,尽管几项研究结果显示:益生菌有益于预防艰难梭菌腹泻(中等质量证据),但欧洲临床微生物学和感染学会(ESCMID,2014),美国传染病协会(IDSA)及医疗保健流行病协会(SHEA)指南综合分析均显示目前无足够证据支持益生菌用于预防艰难梭菌感染,对于多次复发艰难梭菌感染且抗感染效果不佳的病人,推荐使用粪便微生物群移植(强烈推荐,中等质量证据)[65-66]。
推荐意见10:肠道微生物群组调控通过改变饮食、服用益生元、益生菌、合生元以及粪便微生物组移植实现,但目前仅有部分临床研究结果显示其在腹泻的发生率及持续时间上发挥有益作用,其他方面作用有限。[推荐强度:(7.88±1.27)分]
(六)胃肠动力药在AGI中的应用
甲氧氯普胺、红霉素和多潘立酮是目前最常见的促胃肠动力药。甲氧氯普胺可通过阻断上消化道多巴胺能D2受体,增加胃窦收缩,促进胃肠蠕动,从而促进胃排空,改善胃食管反流。Yavagal等[67]纳入305例胃管放置>24 h的重症病人,随机分为甲氧氯普胺组(10 mg,131例)和空白对照组(174例),结果显示:虽然甲氧氯普胺可延迟院内获得性肺炎的发展,但不会减少其发生率,也不改善病死率。Marino等[68]随机纳入22例重型颅脑损伤病人,结果显示:甲氧氯普胺对重型颅脑损伤病人的胃排空无影响。已有研究结果证实:在重症病人中静脉注射甲氧氯普胺可促进肠蠕动,改善喂养不耐受,但胃管给药无效。因此,建议甲氧氯普胺10 mg,3次/d静脉注射,用于重症病人喂养不耐受。
红霉素是一种大环内酯类抗菌药物,影响肠神经元及平滑肌细胞发挥动力作用,局部作用于十二指肠的肠嗜铬细胞促进胃动素的释放,胃动素可导致十二指肠和胃窦收缩。Nguyen等[69]随机纳入90例喂养不耐受的机械通气重症病人,结果显示:与甲氧氯普胺比较,红霉素可更有效地改善病人喂养不耐受。因此,建议,红霉素100 mg,3次/d静脉注射,可恢复胃肠动力,并在大多数情况下改善胃排空。
多潘立酮是另一种多巴胺D2受体拮抗剂,但有Q-T间期延长风险,Johannes等[70]的一项巢式病例对照研究纳入1 608例病人,结果显示:多潘立酮增加严重室性心律失常及心源性猝死的风险。
新斯的明是一种可逆的乙酰胆碱酯酶抑制剂,增加突触间隙乙酰胆碱的浓度,作用于副交感神经,促进胃肠收缩。目前新斯的明改善重症病人喂养不耐受的研究证据不足,均基于小样本低质量研究。但其在结肠促动力作用的研究一致,在结肠急性肠梗阻病人中,予以新斯的明2.0~2.5 mg静脉注射可有效改善结肠假性梗阻,有效率达80%~90%[71]。因此,建议对于结肠动力不足导致喂养不耐受的病人可考虑予以新斯的明。
盐酸伊托必利可通过双重作用模式增强胃肠动力,通过阻断突触后区域胆碱能神经多巴胺D2受体;阻止乙酰胆碱酯酶对乙酰胆碱的水解,从而促进胃肠动力。有RCT纳入76例肠内喂养不耐受的重症病人,结果显示:与甲氧氯普胺比较,治疗1周后盐酸伊托必利能显著降低病人胃残余量,明显增加喂养量,以及热卡、蛋白摄入量[22]。
加拿大重症实践指南推荐将甲氧氯普胺作为ICU第一线胃动力药,ASPEN建议高误吸病人予以甲氧氯普胺或红霉素。ESPEN推荐将静脉注射红霉素作为喂养不耐受重症病人的一线胃动力药物。MacLaren等[72]纳入20例胃残余量>150 mL的重症病人,其研究结果显示:红霉素及甲氧氯普胺均可降低胃残余量,增加喂养次数,但红霉素比甲氧氯普胺可更为有效地促进胃动力。而Lewis等[73]一项Meta分析纳入13项RCT评估重症病人胃肠动力药的有效性及安全性,结果显示:胃肠动力药可显著降低喂养不耐受(RR=0.73,95%CI为0.55~0.97,P=0.03),降低胃残余量发生风险(RR=0.69,95%CI为0.52~0.91,P=0.009),增加幽门后喂养成功率(RR=1.60,95%CI为1.17~2.21,P=0.004)。但亚组分析未发现红霉素和甲氧氯普胺之间存在差异。因此,目前尚无明确证据支持何种促胃动力药更有益处。
Davis和Ferrone[74]提出联合治疗方案,其纳入75例喂养不耐受的机械通气病人,结果显示:联合予以红霉素及甲氧氯普胺比单用红霉素可更有效地改善喂养不耐受。Baradari等[75]的一项随机双盲研究纳入90例胃残余量持续3 h>120 mL的机械通气病人,结果显示:联合予以甲氧氯普胺及新斯的明可显著降低胃残余量,有效率达96.7%,而单用甲氧氯普胺有效率为50%,新斯的明有效率为43.3%,且联合用药未见明显增加不良。因此,对于喂养不耐受的重症病人,联合用药可能更有益处[76]。
耐药性是所有促胃动力药最常见的不良反应,Nguyen等[69]的研究结果显示:甲氧氯普胺在喂养治疗24 h后有效率为62%,第3天为27%,第7天仅为31%。红霉素也存在同样效果,24 h有效率为87%,第3天为47%,第7天仅为31%。因此,建议予以胃动力药物≤3 d。其次是心脏不良反应,阻断钾离子通道,Q⁃T间期延长是红霉素等大环内酯类抗菌药物常见的不良反应。在有心肌病、充血性心力衰竭、冠状动脉疾病、心房颤动和(或)心动过缓、低钾血症和低镁血症等合并症病人中,Q⁃T间期延长的发生率更高。此外,有中枢D2受体拮抗作用的促胃动力药均可诱导可逆的锥体外系运动反应,包括嗜睡、激动、易怒、疲劳、肌张力障碍和迟发性运动障碍,常发生在数个月的慢性治疗[77]。非常罕见的并发症还包括女性病人月经不规律及抗精神病药物恶性综合征[78]。
推荐意见11:建议采用甲氧氯普胺、红霉素静脉注射用于改善胃肠动力。对于结肠动力不足导致喂养不耐受的病人可考虑予以新斯的明。通常使用胃动力药≤3 d,同时应注意相关药物的不良反应。[推荐强度:(8.41±1.00)分]
三、各种特殊情况下胃肠功能障碍的肠内营养策略
(一)应用血管活性药物升压时是否给予肠内营养
ESPEN和ASPEN指南均建议,对于血流动力学不稳定的病人应推迟肠内营养,一旦休克控制,在逐渐撤除血管活性药物支持的过程中,可谨慎开始肠内营养(质量证据等级为2D)。但无安全肠内营养的血管活性药物剂量的推荐意见[1-2]。
危重病人由于存在不同程度的胃肠功能损伤,当休克未得到控制,应用高剂量血管升压药物时给予肠内营养,肠道血液灌注可能不足以满足需求,从而进一步加剧肠道损伤,导致非阻塞性肠系膜缺血和非梗阻性肠坏死等并发症[79-80]。绝大多数验证肠内营养喂养量与预后关系的RCT均排除使用高剂量血管活性药物的病人(例如Arabi等[81]的研究排除使用肾上腺素或去甲肾上腺素>0.4 μg/(kg·min)或≥2种各超过0.2 μg/(kg·min)的数据,Melis等[82]的研究排除使用肾上腺素或去甲肾上腺素>30 μg/min的数据)。NUTRIREA-2是首个比较机械通气休克病人营养方式的RCT,结果显示:两组均使用高剂量去甲肾上腺素{肠内营养组0.56 μg/(kg·min)[0.3~1.2 μg/(kg·min)]比肠外营养组0.50 μg/(kg·min)[0.25~1.03 μg/(kg·min)]},尽管28 d和90 d病死率比较,差异无统计学意义,早期肠内营养组肠缺血和结肠假性梗阻发生率增加[83]。多项回顾性观察性研究结果显示:对于使用中、低剂量血管活性药物的ICU病人进行早期肠内营养是安全且能改善临床结局[84-86]。建议去甲肾上腺素或等效药物剂量的临界值为0.14~0.30 μg/(kg·min)。值得注意的是,去甲肾上腺素剂量的高低不能完全等同于血流动力学是否稳定,还需要根据个体病人的各项因素综合判断。
推荐意见12:休克、液体复苏期,应用高剂量血管活性药物[>0.3 μg/(kg·min)]去甲肾上腺素或等效药物)的重症病人,应延迟给予肠内营养,直到血流动力学稳定。应用中、低剂量的血管活性药物的重症病人,早期肠内营养以滋养型或者允许性低热卡喂养为主,逐渐加量,密切观察肠缺血或喂养不耐受等相关症状、体征,及时处理。[推荐强度:(8.28±1.18)分]
(二)上消化道出血的肠内营养支持策略
目前,尚缺乏在消化道出血活动期进行肠内营养的研究。在上消化道出血活动期禁食被认为可改善胃内pH值、稳定血凝块和降低再出血风险[87]。同时,进食及肠内营养可能导致再出血干扰进一步内窥镜检查。当出血停止后,确定开始肠内营养时机很重要,有研究结果显示:早期喂养可以降低治疗成本并缩短住院时间[88-89]。建议对于再出血风险低的病人,如消化道溃疡(Forrest Ⅱc级和Ⅲ级)胃炎、食管贲门黏膜撕裂症、食管炎或血管发育不良的病人,可在其上消化道出血24~48 h内开始肠内营养[87]。多项RCT及荟萃分析结果显示使用肠内营养可预防应激性溃疡和胃肠道出血[90-92]。延迟肠内营养没有必要,甚至有害,因为其增加了应激性溃疡的风险和延长住院时间[87]。
推荐意见13:活动性上消化道出血的病人应暂停肠内营养,而当出血停止且无再出血迹象时可开始肠内营养。[推荐强度:(8.41±1.00)分]
(三)下消化道出血是否行肠内营养支持
下消化道出血并非肠内营养的绝对禁忌证[93]。下消化道出血的临床表现常涉及便血,仅在极少数情况下涉及黑便。一项前瞻性研究结果显示:在235例严重便血病人(被认为出血位置较低)中,75%为结肠来源[94]。出血病因包括憩室病、缺血、痔疮、直肠溃疡、息肉、癌症和血管瘤。为这些病人提供肠内营养对再出血风险影响较小,继续或停止肠内营养的决定通常取决于与结肠镜检查前的肠道准备。对于大多数下消化道出血病人,只要不干扰结肠镜检查准备,可继续肠内营养。
推荐意见14:下消化道出血病人可以给予肠内营养,只有在需要结肠镜检查肠道准备时才需停止肠内营养。[推荐强度:(8.71±1.05)分]
(四)腹泻的原因与肠内营养策略
腹泻的定义为成人大便次数增加(>3次/d)和(或)>250 g/d液体粪便[95]。可能导致急性腹泻的因素包括配方中纤维的类型和数量,配方渗透压,给药方式,肠内营养污染,药物(抗菌药物、质子泵抑制剂、促胃肠动力药、降糖药、非甾体抗炎药、选择性血清素再摄取抑制剂、泻药尤其是含山梨糖醇的制剂)和传染性病因,包括艰难梭菌感染[96]。有研究结果表明:短链碳水化合物、可发酵的低聚糖、二糖和单糖以及多元醇与腹泻之间存在关联,因其具有高渗透性并能被肠道细菌快速发酵。腹泻评估应包括腹部检查、粪便定量、艰难梭菌的粪便培养和(或)毒素测定、血清电解质检测(以评估过度电解质丢失或脱水)和药物审查。应尝试区分感染性腹泻和渗透性腹泻[97]。
不能因腹泻而停止肠内营养,可在继续肠内营养的情况下寻找腹泻原因[98]。对于持续性腹泻病人(排除其他腹泻来源如药物和艰难梭菌),建议使用含有混合纤维的肠内营养制剂,对纤维缺乏反应的病人可使用短肽制剂,但目前尚无大型前瞻性试验将其作为强烈推荐。对于腹泻危重病人,使用可溶性纤维补充剂比商业混合纤维配方更能有效减少腹泻。这种补充剂的主要止泻机制来自益生元可溶性纤维(如果胶、低聚果糖、菊粉和瓜尔胶)的发酵和短链脂肪酸的产生,短链脂肪酸对结肠细胞的营养作用刺激了水和电解质的吸收[99]。理论上,使用可溶性纤维添加剂可能比使用混合纤维配方造成肠梗阻的风险更低。5项小型RCT评估标准肠内制剂中添加可溶性纤维补充剂的使用情况[95,100-103]。其中在将腹泻作为研究终点的4项试验中,3项研究结果显示:危重病人的腹泻显著减少,但机械通气持续时间、入住ICU时间或多器官功能衰竭发生情况比较,差异均无统计学意义[95,101‑102,104]。一项针对严重脓毒症和感染性休克病人的较早的前瞻性双盲RCT结果显示:接受可溶性纤维补充剂的病人平均腹泻时间显著低于仅接受标准肠内营养的病人[101]。
推荐意见15:腹泻常见原因有药物相关、感染相关和肠内营养相关,前两者需停用相关药物及治疗感染,肠内营养相关者建议给予可溶性纤维补充剂。[推荐强度:(8.35±1.36)分]
(五)腹胀时肠内营养的实施
腹胀是行肠内营养病人的常见症状,无论是通过鼻饲还是经皮胃造口形式进行喂养均可发生,通常伴有不同程度恶心[105]。造成腹胀和恶心的因素很多,建议针对诱因进行分析,尽快缓解症状,达到喂养目标。
引起腹胀的常见因素包括(1)喂养速度过快:为了达到营养目标,进行推注式喂养或者喂养速度上升过快容易导致腹胀[106]。因此,评估病人腹胀症状时需了解是否与近期喂养速度调整有关。如情况符合,则应考虑退回原始的速度甚至暂停喂养,等待病人症状缓解。(2)胃肠功能障碍:胃肠动力不足是危重病病人常见情况,腹部多种疾病如急性胰腺炎、急性腹膜炎等均可引起胃肠功能障碍,特别是胃肠动力不足,从而引起腹胀[107-108]。对于该类病人,要结合临床疾病,在病因治疗同时,辅助促动力药物改善病人胃肠功能[109]。(3)病人体位:将病人保持头高足低30~45°体位,可能有助于改善腹胀症状,同时减少误吸发生的可能性。(4)运动造成的相关症状:目前ICU内早期康复和有阻力运动已得到广泛普及。如果在病人运动时或运动后短时间实施喂养,容易导致腹胀等不适症状[110]。因此,对于此类病人,应注意在开始运动前暂停喂养,运动后30 min后再重新开始喂养避免相关影响。(5)药物和肠内营养本身因素:阿片类药物对胃肠动力影响较大,病人开始肠内营养喂养后,应尽量减少或暂停阿片类药物的使用[111]。肠内营养液温度也是引起腹胀症状的可能原因,如果肠内营养液直接从冰箱中取出即开始喂养或室温较低,要考虑加温肠内营养液以改善病人的腹胀症状。
推荐意见16:腹胀是行肠内营养病人的常见症状,需考虑喂养过快、胃肠功能障碍、体位、活动相关、药物等因素,针对性处理,达到改善症状、喂养达标的目标。[推荐强度:(8.65±1.06)分]
(六)麻痹性不全性肠梗阻病人肠内营养策略
欧洲危重病学会制订的重症病人肠道功能障碍推荐意见对肠管扩张和(或)肠梗阻等胃肠功能障碍相关的专业术语已给出较明确的定义[107]。麻痹性肠梗阻指肠蠕动功能受损,导致粪便不能排出体外。临床症状包括≥3 d肛门停止排便,肠鸣音存在或消失,同时需排除机械性肠梗阻。肠管扩张是指腹部X线平片或CT检查显示结肠直径>6 cm(盲肠>9 cm)或小肠直径>3 cm。
完全性肠梗阻是肠内营养的禁忌证,本节中提及的肠梗阻为麻痹性不全性肠梗阻。肠管扩张和(或)肠梗阻常合并腹内高压,并伴有肠内营养喂养不耐受,需常规监测腹内压和胃残余量[112]。依据病人腹痛腹胀、恶心呕吐等临床症状,并结合腹内压和胃残余量等指标,至少每4 h动态评估胃肠道耐受性。短肽型预消化的肠内营养制剂有助于改善喂养不耐受。对合并肠管扩张和(或)肠梗阻病人首先应该积极治疗原发病,同时建议给予短肽型肠内营养配方[113-114]。肠管扩张和(或)肠梗阻病人肠内营养策略详见图1[115-116]。同时还可采用中药内服、灌肠、外敷、针灸穴位和理疗等改善胃肠动力,注意纠正电解质紊乱,保证肠内营养顺利实施[117]。
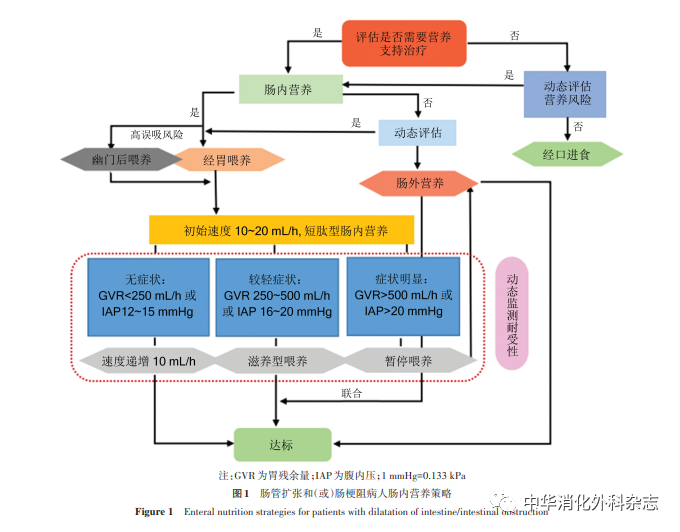
推荐意见17:麻痹性不全性肠梗阻病人在积极治疗原发病同时,依据临床症状、腹内压和胃残余量动态监测胃肠道耐受性和评估肠内营养策略,建议给予短肽类肠内营养配方。[推荐强度:(8.18±0.88)分]
(七)腹内高压肠内营养的实施
由于腹内高压影响胃肠道血流、肠屏障功能、肠道蠕动功能,腹内高压时给予肠内营养是否安全以及如何实施一直是临床关心的问题。有研究结果显示:Ⅰ~Ⅱ级腹内高压病人实施肠内营养不增加病人腹内压,谨慎施行肠内营养安全可行[118]。然而,当腹内压≥15 mmHg时,喂养不耐受将明显增加[119]。在实施胃肠内营养过程中,监测腹内压可提高危重症病人肠内营养效果,降低不良事件发生率。对于腹腔开放病人,与肠外营养比较,早期肠内营养不增加病死率和感染风险[120]。欧洲重症以及肠外与肠内营养协会针对腹内高压病人胃肠营养的推荐意见一致:对于腹内高压不伴有腹腔间室综合征的病人推荐早期胃肠内营养,如腹内压进一步升高则考虑减量或暂停;对于腹腔间室综合征病人,建议延迟给予胃肠营养。对于腹腔开放的病人,建议早期肠内营养[1,43]。ASPEN指南建议:对于腹腔开放不伴有肠道损伤的病人,早期(损伤后24~48 h之内)给予肠内营养[2]。
推荐意见18:对于腹内高压病人,当腹内压≤20 mmHg时,可早期给予胃肠内营养,同时需谨慎监测喂养不耐受和腹内压变化,如积极采取措施仍不能改善喂养不耐受或腹内压进一步增加,应予以减量或暂停喂养。对于腹内压Ⅲ级以上和腹腔间室综合征病人,延迟给予胃肠内营养。[推荐强度:(8.71±0.92)分]
利益冲突 所有作者均声明不存在利益冲突
《重症病人胃肠功能障碍肠内营养专家共识(2021 版)》编写委员会成员名单
按医院名称首字母顺序:
北京医院外科重症医学科:常志刚、冯喆
北京医院普通外科:朱明炜
重庆大学附属肿瘤医院重症医学科:蒋正英、周明明、隆毅
重庆大学附属肿瘤医院胃肠肿瘤中心:孙浩
福建医科大学附属协和医院重症医学科:陈存荣、陈钧年、李彩婷
唐山南湖医院重症医学科:张军伟、张秋华
西安交通大学第一附属医院外科重症医学科:张靖垚、刘昌、王文静
浙江大学医学院附属邵逸夫医院重症医学科:郭丰、吴银山
浙江大学医学院附属邵逸夫医院普通外科:虞洪
中国人民解放军东部战区总医院重症医学科:李维勤、柯路、童智慧、叶博
中南大学湘雅医院重症医学科:刘志勇、彭米林
中日友好医院外科重症医学科:段军、吴筱箐、马军宇
中日友好医院消化科:杜时雨
执笔统筹:常志刚、冯喆、蒋正英、张靖垚
来源:中华消化外科杂志
中西结合,三效合一 活化高守护骨关节健康
随着人口老龄化的加剧,以及健身文化的兴起,越来越多的人患上了关节炎。据统计,全世界关节炎患者3.55亿人,每六个人就有一人在一生的某个阶段患上关节炎。由贵州联盛药业有限公司独家出品的活化高™麝香活血化瘀膏,中药组方结合西药成分,拔毒、镇痛、抗过敏之功三效合一,是骨关节炎患者的优先选择。
中西结合,三效合一
活化高守护骨关节健康
刘晴/文

发病率高、危害大
骨关节炎不容忽视
骨关节炎是由多种因素引起的关节软骨纤维化、皲裂、溃疡、脱失而导致的关节疾病。主要病理改变是关节软骨的退行性病变和继发性骨质增生。其发病与年龄、肥胖、炎症、创伤和遗传等因素有关,是一种慢性关节疾病。
专家介绍,当前关节炎不仅仅是老年人的专利,所有年龄段的人,甚至包括儿童都有可能罹患此病。据《2018中国卫生健康统计年鉴》显示,我国居民在14岁以下骨科类疾病发病率为2.8%,15-44岁的发病率为20.8%,45岁以上的发病率则达到76.4%。关节炎不仅发病率高,危害也不容小觑。据统计,我国关节炎的致残率高达53%。
那么,得了关节炎,患者该如何治疗?活化高™麝香活血化瘀膏,给出了最佳答案。其适应症为活血化瘀,消炎止痛,主要用于治疗关节扭伤,软组织挫伤,急性腰扭伤,腰肌劳损,肩周炎,未溃冻疮,结节性红斑。
根据第三军医大学附属医院临床观察,麝香活血化瘀膏,可以有效对抗关节肌肉的疼痛、肿胀,总有效率100%,显效率85%以上。因此,活化高™麝香活血化瘀膏不失为骨关节炎患者的优先选择。
中西结合、创新工艺
活化高市场无限广阔
据了解,活化高™麝香活血化瘀膏,主要由人工麝香、三七、红花、丹参、血竭、樟脑、硼酸、尿素、颠茄流浸膏、盐酸苯海拉明、盐酸普鲁卡因等成分组成。中药组方结合西药成分,共奏拔毒、镇痛、抗过敏之功,达到三效合一、标本兼治的目的。
与其他骨科肌肉系统常见中成药外用贴剂相比,活化高™麝香活血化瘀膏摒弃了辣椒碱、乌头等刺激性或毒性成分,并采用创新的氧化锌热压工艺与多成分定量质控标准。因此不仅治疗效果突出,还有优异的安全性,过敏率仅为1.5%,远低于常见中成药贴剂的10%-25%过敏率。
由于临床用药经验充足,舒肤抗敏,疗效确切,麝香活血化瘀膏已经得到广大医务人员和患者的一致认可,成为了骨科产品的杰出代表,被纳入2020版国家医保乙类目录,成为《中成药临床应用指南·风湿病分册》推荐用药。
值得一提的是,骨科肌肉系统药物拥有无限广阔的市场,据统计,国内每年新增骨科患者数量在200万人以上,2020年骨骼肌肉系统中成药市场规模接近500亿元,同比增长超过10%。
可以预见,随着社会老龄化程度的不断加深,未来活化高™麝香活血化瘀膏将在骨科中成药领域大展身手,为更多骨科患者减少疼痛做出努力,成为治疗关节炎疾病的知名中成药品牌指日可待。
关节炎“克星” 麝香活血化瘀膏“三效合一”奏奇效
随着人口老龄化的加剧,关节炎的患病率居高不下。数据显示,全世界关节炎患者有3.55亿人,每六个人就有一人在一生的某个阶段患上关节炎。针对此病症,专家建议首选外用药物,选择可化瘀毒之药物,标本同治。由贵州联盛药业有限公司独家出品的活化高™麝香活血化瘀膏(简称“麝香活血化瘀膏”),便是对关节炎标本同治的良药。其中西结合,三效合一,48小时长效止痛,疗效突出,不失为关节炎患者的优选。

关节炎“克星”
麝香活血化瘀膏“三效合一”奏奇效
张秋霞/文
关节炎泛指发生在人体关节及其周围组织,由炎症、感染、退化、创伤或其他因素引起的炎性疾病。数据显示,中国大陆关节炎病人有1亿以上,总发病率13%,致残率高达53%。其中,骨关节炎、风湿/类风湿关节炎的发病率奇高,50岁以上发病率50%,65岁以上90%,70岁以上达到惊人的100%。
如何治疗关节炎?麝香活血化瘀膏交出了高分答卷。据了解,麝香活血化瘀膏由人工麝香、三七、红花、丹参、血竭、樟脑、硼酸、尿素、颠茄流浸膏、盐酸苯海拉明、盐酸普鲁卡因等成分组成。独创中西结合配方,化瘀拔毒、镇痛、抗过敏三效合一,标本兼治,48小时长效止痛,疗效突出。可用于关节扭伤,软组织挫伤,急性腰扭伤,腰肌劳损,肩周炎,未溃冻疮,结节性红斑。三效合一的麝香活血化瘀膏,能有效对抗关节肌肉的疼痛、肿胀,总有效率100%,显效率85%以上。
麝香活血化瘀膏不仅疗效显著,更为患者的安全和舒适性考虑。首创中药贴膏剂ZnO热压工艺法,具有安全无毒、舒肤低敏、有效锁药、黏弹适中的优势。并且不含刺激性成份,安全有效,舒肤低敏抗炎。经临床验证,麝香活血化瘀膏过敏率仅为1.5%,远低于普通贴膏10~25%的致敏率,使用更安全!
据估计,我国每年新增骨科患者数量在200万人以上。对于各年龄层的全体人群而言,包含颈椎病、关节炎、急性扭挫伤、腰肌劳损、肩周炎等的骨骼肌肉疼痛是所有疼痛中最普遍、影响范围最广的疼痛,中国的患病率高达20%,影响3亿人。因此骨科肌肉系统药物拥有无限广阔的市场,据南方所数据,2019年骨骼肌肉系统中成药市场规模为433亿元,同比增长10.63%。
值得一提的是,由于临床用药经验充足,舒肤抗敏,疗效确切,麝香活血化瘀膏已经得到广大医务人员和患者的一致认可,成为了骨科产品的杰出代表,被纳入2020版国家医保乙类目录,成为《中成药临床应用指南·风湿病分册》推荐用药。这些优势将利于麝香活血化瘀膏扩大市场份额和销售规模,进一步巩固贵州联盛药业在中国医药行业的地位。
作为一家致力于践行“大匠精诚”的公司,贵州联盛药业17年来产品质量抽检合格率为100%,至今全厂已有9条生产线通过新版GMP认证,拥有药物制剂国家工程研究中心和全国唯一的“透皮制剂分中心”,是一家医药大健康研发、生产、销售于一体的全产业链公司,更是荣获2020民营企业100强,是一家专业可靠的合作公司。
拥有国内领先的贴膏剂生产线的贵州联盛药业,已持续5年投入进行迭代升级,立志做中国极致贴膏产品!至今,麝香活血化瘀膏已入选多项治疗指南和专家共识,全国已有众多样板区域、样板医院,是骨科骨伤科大品种。凭借中西结合,标本同治,科学组方和独特胶料确保极低过敏率的优势,可以预见,未来麝香活血化瘀膏将在骨科中成药领域大展身手,为广大患者带去福音,为合作伙伴带来机遇!
国际放射日11月8日,向每一位放射医学工作者致敬!愿通过你们,把放射的力量辐射全世界。
为什么幽门螺杆菌杀不死?浅析Hp根除失败的原因






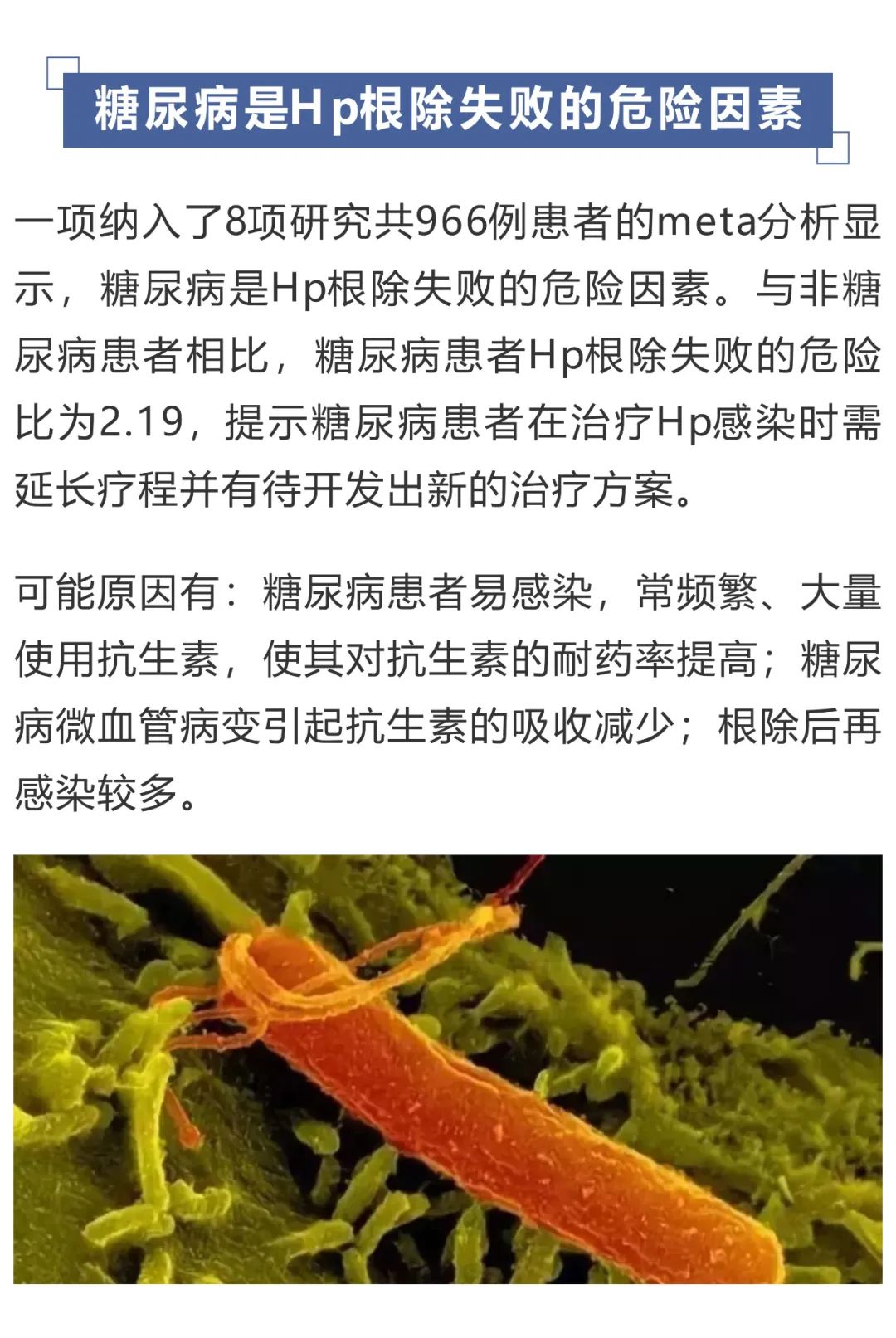


作者:王伯军,宁波大学附院消化内科主任医师 来源:胃肠病
艺术家|Julio Rondo 在玻璃上跳舞

Julio Rondo
b.1952
胡里奥·朗多出生于西班牙索伦迪奥,2000年起,生活、工作于德国斯图加特和柏林。多年来,朗多一直探索在玻璃背面运用丙烯和喷涂进行创作。他特别关注那些无意识涌现出的记忆。对于艺术家而言,重要的并不是对过去的人或事的复原,而是作品中对这些人、事件和场的存储感知的“本质”。

无人关心,2019,玻璃背面丙烯,木板上丙烯及漆
Who Cares,Acrylic behind glass, acrylic and chrome varnish on wood,180 x152 cm

就现实而言,2019,玻璃背面丙烯,木板上丙烯及漆
As far as it gets ,Acrylic behind glass,acrylic and chrome varnish on wood,180-x152cm
胡里奥近期充满松弛圆润笔触的玻璃媒介作品被漂浮的记忆和深刻的情绪活跃和柔软地包裹起来。像是博伊斯规定在玻璃展示箱中,精心排列的时空纪念品——石灰的表情模型与燥热的皮毛大衣、岛礁的沉积、沙滩的遗骸、有着快乐马匹的草原和鸽子血色的酒精、被乳胶稀释的蜜糖以及白色炽光灯下的粉红奶酪……
胡里奥对玻璃媒介的挖掘可以被理解为对传统艺术作品构成的聪明蝶变,混淆了装裱与作品这两块既不十分连贯又需要彼此配合的部分,又拓展了作品的视觉层次与阅读空间,这也使得观者可以用“徜徉”这个词来描述对作品中的表达体验,由物的世界触摸到生动的灵感。





恒星已经死亡,但是它们的光芒依然向着我们照射过来,还有一些恒星的距离,恒星已经闪烁了很久,但它们的光芒至今还没有照到我们。
这就是说还有希望。
让·鲍德里亚《断片集 – 冷记忆》
















胡里奥·朗多,
1952. 出生于西班牙索伦迪奥,
1962. 随父母移民到德国
1974-1980.在德国斯图加特艺术学院学习,
1974-1980.跟随KRH桑德堡教授学习。
1989.任德国斯图加特梅尔兹学院教授一职。
1997-1998 在美国学习,
2000-生活、工作于德国斯图加特和柏林。
Reference
https://pifo.cn/zh/artists/75-julio-rondo/overview/
https://mp.weixin.qq.com/s/GdoK_SI2MItGAqSgGyLROA
©文章版权归属原创作者,如有侵权请后台联系删除
《营养不良的五阶梯治疗》
内容介绍
营养不良(本文特指营养不足)无论在住院患者、还是社区人群都是一个严重问题,老年人、恶性肿瘤及其他良性慢性消耗性疾病患者是营养不良的高发人群。营养不良的严重后果众所周知,而营养不良的规范治疗仍然是一个有待讨论的问题。我们认为:营养不良治疗的基本要求应该是满足能量、蛋白质、液体及微量营养素的目标需要量,即要求四达标;最高目标是调节异常代谢、改善免疫功能、控制疾病(如肿瘤)、提高生活质量、延长生存时间。营养不良的规范治疗应该遵循五阶梯治疗原则:首先选择营养教育,然后依次向上晋级选择口服营养补充(oralnutritional supplements,ONS)、全肠内营养(totalenteral nutrition,TEN)、部分肠外营养(partial parenteral nutrition,PPN)、全肠外营养(total parenteral nutrition,TPN)。参照ESPEN 指南建议,当下一阶梯不能满足60% 目标能量需求3~5 天时,应该选择上一阶梯。
营养不良的规范治疗应该遵循五阶梯治疗原则
(见图 1)首先选择营养教育,然后依次向上晋级选择口服营养补充(oral nutritional supplements,ONS)、全肠内营养(total enteral nutrition,TEN)、 部 分 肠 外 营 养(partial parenteral nutrition,PPN)、全肠外营养(total par_x0002_enteral nutrition,TPN)。参照 ESPEN 指南建议,当下一阶梯不能满足 60% 目标能量需求 3~5 天时,应该选择上一阶梯

第一阶梯:饮食+营养教育
饮食 + 营养教育是所有营养不良患者(不能经口摄食的患者除外)首选的治疗方法,是一项经济、实用而且有效的措施,是所有营养不良治疗的基础。
1.1 评估营养不良严重程度
1.2 判断营养不良类型
1.3 分析营养不良的原因
1.4 提供个体化饮食指导
1.5 讨论或处理营养不良的非饮食原因
第二阶梯:饮食+ONS
2006年ESPEN指南将ONS的英文全称统一为“oral nutritional supplements”,并定义为:“Supplementary oral intake of dietary food for special medical purposes in addition to the normal food,除了正常食物以外,补充性经口摄入特殊医学用途(配方)食品”。顾名思义,口服营养补充是以特殊医学用途(配方)食品(food for special medical purposes,FSMP)经口服途径摄入,补充日常饮食的不足。研究发现,每天通过 ONS 提供的能量大于 400~600kcal 才能更好地发挥 ONS 的作用。
第三阶梯 :TEN
TEN 特指在完全没有进食条件下,所有的营养素完全由肠内营养制剂(FSMP)提供。在饮食+ONS 不能满足目标需要量或者一些完全不能饮食的条件下如食管癌完全梗阻、吞咽障碍、严重胃瘫,TEN 是理想选择

第四阶梯 :PEN+PPN
在 TEN 不能满足目标需要量的条件下,应该选择 PEN+PPN,或者说在肠内营养的基础上补充性增加肠外营养。尽管完全饮食或完全肠内营养是理想的方法,但是,在临床实际工作中 PEN+P_x0002_PN 是更现实的选择,对肿瘤患者尤为如此 。因为厌食、早饱、肿瘤相关性胃肠病、治疗不良反应等使患者不想吃、吃不下、吃不多、消化不了,此时的 PPN 或补充性肠外营养(supplemental par_x0002_enteral nutrition,SPN)就显得特别重要。
第五阶梯 :TPN
在肠道完全不能使用的情况下,TPN 是维持患者生存的唯一营养来源。

小结
一般情况下,我们应该遵循阶梯治疗原则,由下往上依次进行 ;但是阶梯与阶梯之间并非不可逾越,患者可能逾越上一阶梯直接进入上上阶梯,而且不同阶梯常常同时使用,如饮食 + 营养教育 +ONS+PPN。在临床营养工作实践中,我们应该根据患者的具体情况,进行个体化的营养治疗。
捷报传来//3000例关于葛泰治疗混合痔术后的临床疗效研究结果发布

2019国际肛肠高峰论坛暨第十届世界中医药学会联合会肛肠病专业委员会学术年会暨第六届长三角中西医结合学会大肠肛门病专业委员会年会于2019年11月16日在杭州盛大开幕;来自意大利、日本、韩国、泰国、中国等50余位肛肠领域知名专家、学者以及全国各地300余位肛肠医师齐聚钱塘江畔,互相交流,共同促进肛肠事业的发展。
2019年11月16日上午11时许,大会期间举行南京正大天晴大规模混合痔临床研究结果发布会,会议由上海中医药附属龙华医院曹永清教授、江苏省中医院谷云飞教授担任大会主持,杭州师范大学附属医院王绍臣教授进行《3000例关于葛泰®(微粉化地奥司明片)治疗混合痔术后的前瞻性、多中心临床疗效研究结果解读》。
曹永清教授讲到:此项研究是国内目前样本量最大的混合痔术后的前瞻性、多中心临床疗效研究,共计3000例,历时1年半,覆盖15家中心,并取得了可喜的结果。恰逢2019年国际肛肠高峰论坛举办,在此大会上发布,可谓是喜上加喜。

曹永清教授 大会致辞
谷云飞教授讲到:非常有幸加入由世界中医药学会联合会肛肠病专业委员会与南京正大天晴制药有限公司共同组建的肛肠工作室;同时见证了肛肠工作室的逐步壮大以及发展。作为此项研究中心单位之一,我们严格按照试验要求、流程、统计、以及汇总,确实观察到葛泰能促进混合痔术后肛周水肿的消除,并感谢南京正大天晴制药有限公司对肛肠领域发展的鼎力协助。

谷云飞教授 大会致辞
王绍臣教授对《3000例关于葛泰®(微粉化地奥司明片)治疗混合痔术后的前瞻性、多中心临床疗效研究结果》从研究背景、方案、结果、结论等四个方面,进行了详尽而细致地解读。

王绍臣教授 临床研究结果解读
王绍臣教授指出:1.葛泰®能显著缓解混合痔术后肛门肿胀,促进愈合,特别是术后早期;2.葛泰®能抑制炎症,促进静脉回流,延缓复发进程,至少服用3个月(2#,bid);3.葛泰®用于混合痔术后不良事件发生率低,安全性好,是痔病治疗的基础口服药物。

(具体结果详见以下图表)
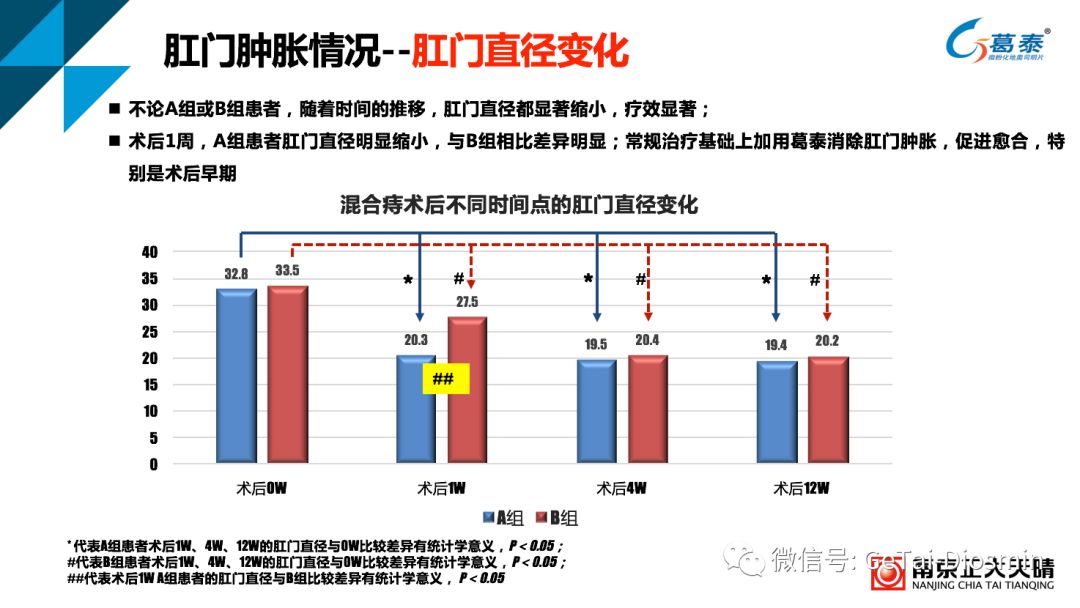
表1 不同时间节点肛门肿胀改善情况–(肛门直径变化)
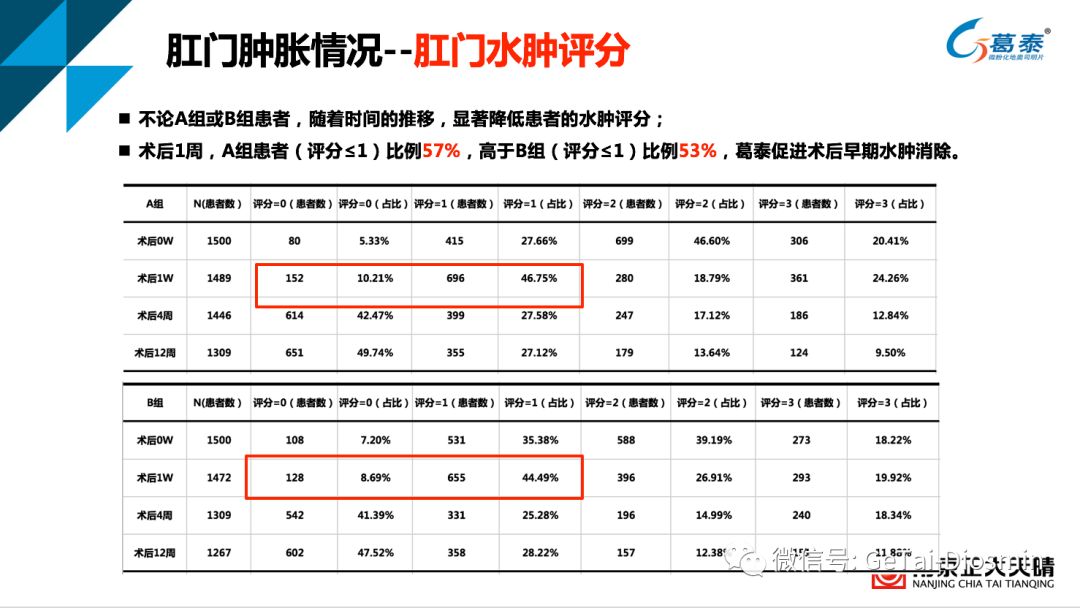
表2 不同时间节点肛门肿胀改善情况–(肛门水肿评分)
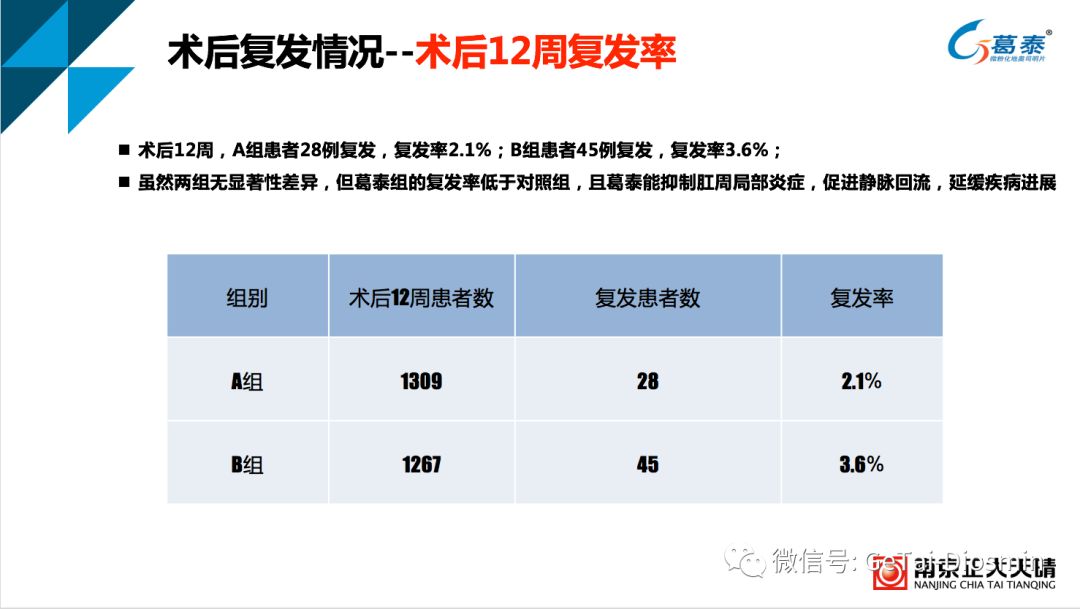
表3 混合痔术后治疗12周复发率
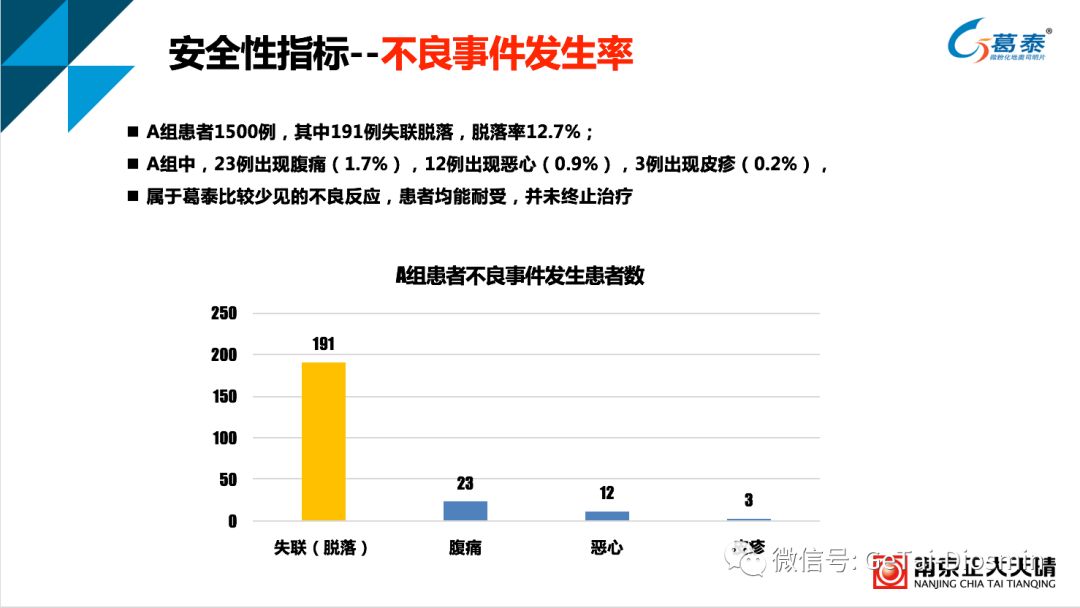
表4 混合痔术后治疗12周不良事件发生率
世界中医药学会联合会肛肠病专业委员与南京正大天晴制药有限公司共同发起的肛肠专家工作室,定将携手同行,共同促进祖国肛肠事业的发展…


更多精彩 扫码关注
第十五届首都血管论坛| 会议速递
由谷涌泉教授担任大会主席的“第三届国际血管联盟中国大会暨第十五届中国首都血管论坛”于昨日在京隆重召开。葛泰(微粉化地奥司明片)专题会于10月25日12:20如约而至。首都医科大学宣武医院谷涌泉教授、山东省立医院吴学君教授担任大会主持,战略支援部队特色医学中心(原306医院)顾洪斌教授、首都医科大学宣武医院郭连瑞教授分别就《炎症与糖尿病足的相关性》、《炎症与DVT的相关性》展开学术汇报。



谷涌泉 教授 吴学君 教授


顾洪斌 教授
《炎症与糖尿病足相关性》
“糖尿病足是糖尿病下肢血管病变的终末阶段,具有发病率高,复发率高的特点,其病因复杂”,顾洪斌教授提出,“糖尿病足应以预防为主、专业化诊疗和多学科协作基础上综合治疗,促进糖尿病足的分级管理。”
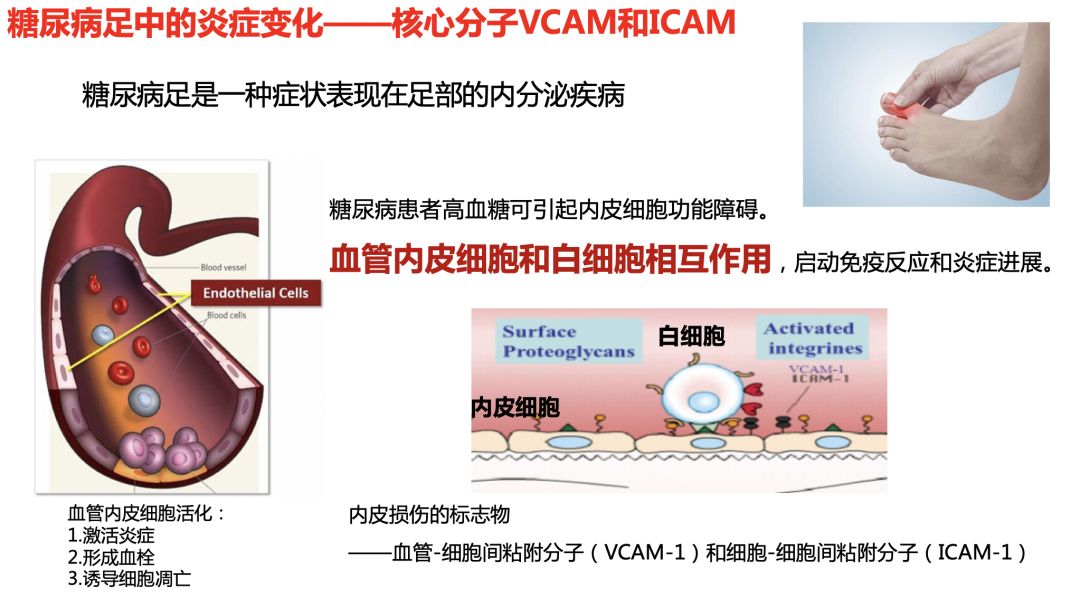
最新研究表明,糖尿病足患者高糖状态可引起内皮细胞功能障碍,引起VCAM和ICAM表达增高,提示炎症在其中发挥重要作用。葛泰作用与炎症起始环节,通过抑制白细胞与内皮细胞相互作用,抑制机体的特异性炎症造成的血管内皮功能障碍。临床研究发现,糖尿病足患者采用地奥司明治疗能够迅速缩小创面面积,良好改善创面愈合,同时可以缓解糖尿病足下肢症状,提高治疗满意度。



郭连瑞 教授
《炎症与DVT的相关性》
近些年,炎症与深静脉血栓的关系备受关注。炎症贯穿血栓始终,对血栓发生、发展及预后起着关键作用。
郭连瑞教授指出:深静脉血栓的发生发展与炎症反应密切相关。血栓始于内皮细胞损伤。血栓形成后造成的血循环阻塞,未能重新疏通的血栓可引起静脉高压,导致静脉返流。单纯抗凝治疗不足以完全阻止血栓的进展,慢性VTE最有效的治疗方案为:抗凝+MPFF,配合压力治疗。

诸多国内外学者在DVT的临床研究中,均证实地奥司明联合抗凝药物,在预防方面,比单独使用抗凝药物更能有效预防术后深静脉血栓。在治疗方面,可降低DVT患者6个月内PTS发生率,提高血管再通畅速度,同时不增加出血风险。地奥司明联合抗凝药物,对静脉血栓具有更好的预防和治疗作用。
互动环节精彩瞬间
<< 滑动查看下一张图片 >>
葛泰(微粉化地奥司明片),作为良好的血管保护剂,将陪伴更多的血管外科医师,携手中国首都血管论坛,期待2020年,我们再相聚!


葛泰公众号
微信号 : GeTai-Diosmin