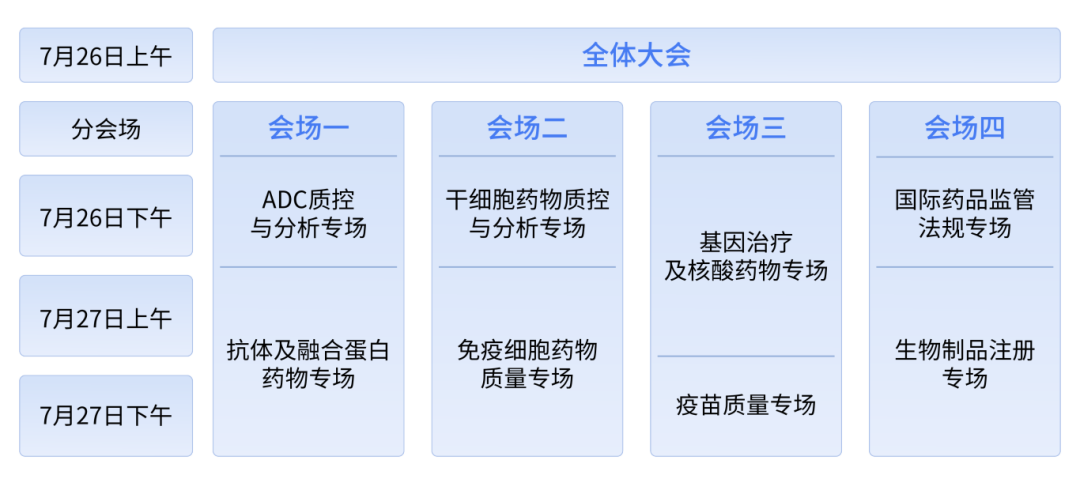
郅敏个展「等待」展览现场,凯旋画廊,中国,2024
Installation View of Waiting for the Inevitable
Triumph Gallery, China, 2024


郅敏讲了一个关于等待的故事,关于一位独居山林的老僧,因不能离开寺院一步,而孤独地等待着自己的继承者,等待着他所守护的寺院的下一任主人。在这样一个故事的结局,这位高僧所等待的是什么呢?或者说,什么是等待?等待是否应拥有属于它的宾语?就此,作为雕塑家的郅敏的回答是,故事中的老僧在静待一个时机的到来,而艺术家的等待则是等待一个更好的自己——因为老僧无法擅自离开、主动去寻求,而艺术家也只能在自己的世界中埋头工作。在同样充满张力的内部体系里,被动的等待取代了积极的创造,一种否定性的力量在过多的肯定的包围中显示了自身的智慧。
这样,故事中的等待便成为一种独立自在的行为,也就是说,等待的所有意义在于等待本身,而等待的主语也同时是它的宾语,这样的等待虽是被动但却充满力量,等待因此具有了自身的创造性,它因没有了目的论的框定而获得了更多的可能,因对于主体的持续反思而内化为艺术的过程。等待作为郅敏的创作方法,以一种潜能的形式塑造了艺术家开展工作的独特节奏。
我们知道,郅敏个人的雕塑创作经历了几个阶段,但各个阶段的分期却非完全按照时序的渐进,恰也包含了较为漫长的空白,在2007年至2011年的时间内,郅敏说他所做的便是等待,他在突飞猛进的工作中决定停下脚步,在自顾不暇的裹挟里选择静心的思考与被动的行止,在此基础上得以开启2011年至今的坚实创作,我们所看到郅敏近作的丰富变化正源于此,这样的突破对于雕塑艺术而言殊为不易。

不均匀的宇宙 An Oblique Universe
陶瓷、金属 Ceramic and metal
D=88cm,2021
可以说,艺术家的等待关乎时间,同样关乎空间,等待的行为实现为具体的作品,也诉说了作品及其创作者之间阶段性的关系,等待需要度过漫长的岁月,也需如故事的老僧般原地不动的坚守。等待行为所同时朝向的时间与空间,构成了艺术家个体所面对的宇宙,实际上,这也正是郅敏近作的主题:在展览中,雕塑作品在展墙上化作了宇宙的平面与七彩的自然,但它们并未企图再现宇宙的广袤,并非是对自然的投射与现实的模仿,而是作品和自然一同发生着变化,雕塑和它的作者一起置身在宇宙当中,等待着生成新的可能;对作品背后的艺术家而言,在其所身处的宇宙和自然面前,郅敏做出了等待的姿态,他对眼前观察的对象报以平静、真诚和敬畏,他不去用创作的行动试图改变自然,而是在自然与作品之间等待着接近真理的感悟,等待一个更好的时机与自我的到来。面对巨大的文脉传统,面对浩瀚的“河图洛书”与“不均匀的宇宙”,郅敏的等待仅在“立表侧影”中拉出了长长的影子,当站在光荣遗产的跟前,当作为时代洪流的注脚,属于东方的基因告诉艺术家,此时更为明智的行动便是等待。

立表侧影 Sundial Silhouettes
陶瓷、金属 Ceramic and metal
480×250×100cm,2021
实际上,在意大利哲学家阿甘本那里,这样的等待已得到充分的讨论,等待既接近一种中国古代思想的无为,也被阿甘本注入了潜能的当代性。在阿甘本那里,潜能意味着不去做,它是对做得太多的警惕,是在内卷之中保持的清醒。潜能的行为因此是一种被动的综合、消极的创造,是阿甘本发展自德勒兹或休谟的凝思与静观,这样的行为催生了一种独特的自我,它让个体在与世界相遇时,瞬间迸发的是艺术的感觉而非理性的知识,让俯仰宇宙所带来的是自然的流露而非技术的雕琢,它让艺术家的工作彰显踟蹰的张力而非盲目的冒进,让创作者在过去与未来之间回望,而不再执迷于求新的幻象;由此,阿甘本的潜能可以是一种等待,因为潜能的意义在于不实现,正如等待是不需要某种结果的过程,换句话说,作为潜能的等待正是因其不实现、因其不主动去做,而换回了自身的多样性与前所未有的自由,它随时积蓄着可能,随时准备在即将到来的未来唤起力量的强度,等待的行为也正因此成为了艺术的行为,它在“最具孕育的顷刻”成为艺术家步入下一阶段的内在驱力。
此外,等待也关乎身体。一方面,等待的行为根植于艺术家身体的局限,消耗着每一个个体的生命,死亡的终点时刻提醒着艺术家对于作品生命的灌注,等待在有限的生命与无限的真理之间,永远折磨着每一个期待创造、怀揣理想的个体——因为时间的紧迫,因为空间的界线,因为来自外部的加速主义与来自内部的身不由己,我们亟需冷静地悬置并选择等待;另一方面,我们的身体也是自然与宇宙的现实化,在《二十四节气》的雕塑形体中,可以看到时间与空间的面向,看到节气的更迭与万物的滋长,同时,也可以看到作品内部多重的身体,看到这些身体与自然一起萌生着阴阳的往复与形态的伸展。


二十四节气——冬至 Twenty Four Solar Terms – Winter Solstice
山西黑大理石 Pastel, acrylic and oil on linen
120×27×25cm,2021
由此,郅敏的等待既在空间中书写了“非线性叙事”,也在时间里显现为“历史的颜色”,郅敏的近作既让人联想起超越个体的“宇宙主义”,让作为雕塑媒介的石头、泥土与陶瓷等材料,上升到宇宙爆炸的时刻与热力学的燃烧定理,同时也在“大千世界”中深入到地层的内部,从太空叙事向下延伸至“深度时间”,或者说,转换成中国人眼中真正的自然。我们看到,郅敏的作品同时展示着欧普艺术式的现代视觉,并且表露属于中国历史的悠久传统,正如“河图洛书”同时连接着大地的河流与天顶的银河,郅敏所思考的雕塑空间及其个人艺术史的时间维度,便这样在一件件作品之间徐徐展开。
本次展览是郅敏的第一次画廊个展,展览来自艺术家的等待,来自主动创作和被动行为的辩证法,来自郅敏多条创作线索的彼此等待与齐头并进。雕塑家与他的作品在宇宙空间的停留,在鸿蒙之中的徘徊,也早已准备好降落回世间,在连贯的创作里进入到下个阶段的新的等待。


非线性叙事 A Nonlinear Narrative
金属、陶瓷、纤维 Ceramic, metal, and plastic fibers
256×87×10cm,2021
Zhi Min tells a story about waiting, about an old monk who lives alone in the mountains and forests, waiting for his successor in solitude. He cannot leave the monastery for a step because he needs to wait for the next owner of the monastery he guards. What is this monk waiting for at the end of such a story? Or rather, what is waiting? Should waiting have its own binomial? In this regard, Zhi Min, as a sculptor, answers that the old monk in the story is waiting for a moment to come while the artist is waiting for a better self because the old monk can't leave without authorization and actively seeks the artist can only bury his head in his own world and work. In the same tension-filled internal system, passive waiting replaces active creation. A negative force reveals itself to be wise, surrounded by too many affirmations.
In this way, the waiting becomes an independent and self-contained act. All the significance of waiting lies in the waiting itself, and the subject of waiting is also its object simultaneously. Such waiting is passive but full of power. Thus, waiting has its own creativity, which gains more possibilities due to the absence of the framing of purposiveness. It is internalized into the process of art due to the continuous reflection of the subject. It is Zhi Min’s creation method, based on the idea that "waiting" is the most effective way to create. Waiting for Zhi Min shapes the unique rhythm of the artist's work in the form of potentiality.
We know that his personal sculpture creation has gone through several stages. We know that his personal sculpture creation has gone through several stages. Each phase does not follow the chronological progression but contains a rather long gap. From 2007 to 2011, Zhi Min said that what he did was wait. He decided to stop amid the rapid progress of his work. In the self-concerned hostage, he meditated on his thinking and passive behavior. On this basis, he has been able to start a solid creation from 2011 to the present, and the rich changes we see in Zhi Min's recent works stem from this, which makes it difficult for sculpture art to make such a breakthrough.


河图洛书——天象
Trigrams of Luo and Yellow Rivers – Heavenly Bodies
陶瓷,金属 Ceramic and metal
250×250×60cm, 2014-2016
It can be said that the artist's waiting is related to time and space. The act of waiting is realized in concrete artwork, conveying the periodical relationship between the artwork and the artist. The waiting must go through a long time. It must also stand still, like the old monk in the story. The time and space towards which the act of waiting is directed simultaneously constitute the universe the artist faces. This is precisely the theme of his recent works: in the exhibition, the sculptures are transformed into the plane of the universe and colorful nature on the exhibition wall, but they do not attempt to reproduce the vastness of the universe; they are not a projection of nature or a mimicry of reality, but rather, the works and the nature are undergoing a change together, and the sculpture is changing along with its author. The sculpture and its author are in the middle of the universe, waiting for new possibilities to be generated. The artist behind the works, in front of the universe and nature in which he is located, makes a gesture of waiting. He reports calmness, sincerity, and reverence to the objects he observes in front of him. Instead of attempting to change nature with his creative actions, he waits for the realization of truth close to the truth and for the arrival of a better time and self. He faces the long-lasting tradition, the arrival of a better time and self, the "Trigrams of Luo and Yellow Rivers," and the "Oblique Universe.” The waiting of Zhi Min only pulls out a long shadow in "Sundial Silhouettes" when standing in front of the glorious heritage, when standing as a footnote to the torrent of the times, the genes belonging to the East tell the artist that the wiser course of action is to wait.
Such waiting has been fully discussed in the Italian philosopher Agamben, where waiting is close to a kind of ancient Chinese thought of inaction but also infused by Agamben with the contemporaneity of potentiality. There, potentiality means not to do. It is a vigilance against doing too much, sobriety maintained amid involution, and the act of potentiality is thus a passive synthesis, a passive creation, a gaze and stillness developed by Agamben from Deleuze or Hume. Such an act gives rise to a unique kind of self, which allows the individual to meet the world with instantaneous outbursts of artistic sensation rather than rational knowledge and allows the overlooking of the universe to be a natural outpouring rather than a technical sculpture. It allows the artist's work to manifest a stumbling tension rather than a blind impulse. It allows the creator to look back between the past and the future rather than obsessing over the illusion of seeking newness. Thus, Agamben's potentiality can be waiting, for the meaning of potentiality lies in its non-realization, just as waiting is the process of not needing some result. In other words, waiting as potentiality is precisely that which, because of its non-realization, because of its lack of initiative, returns its own diversity and unprecedented freedom, which is always accumulating possibilities, always ready to evoke the intensity of power in the upcoming future, and the act of waiting thus becomes an act of art, which, in the "moment of the most nurturing,” becomes the step of the artist.

二十四节气——秋分
Twenty Four Solar Terms – Autumn Equinox
青铜抛光 Polished phosphor bronze
110×110×125cm,2021
On the one hand, the act of waiting is rooted in the limitations of the artist's body, consuming the life of everyone; the end of death is a constant reminder of the artist's infusion of life into his work; waiting is between finite life and infinite truth, forever tormenting everyone who looks forward to creation and harbors ideals–because of the urgency of time, because of the space, because of the intensity of space. Therefore, waiting becomes an act of art. Because of the urgency of time, the boundaries of space, the accelerationism from the outside, and the body’s inability from the inside, we must suspend and choose to wait calmly. On the other hand, our bodies are also the reality of nature and the universe. In the sculptural form of the Twenty-Four Solar Terms, we can see both the time and the space at the same time, we can see the change of the seasons and the nourishment of the things, and we can see the multiple bodies inside the work, we can see these bodies, and we can see that these bodies are the same as the bodies in the sculpture. At the same time, one can also see the multiple bodies within the work and see these bodies sprouting with nature in the repetition of yin and yang and the stretching of forms.

历史的颜色 7 The Color of History 7
陶瓷 Ceramic
55×110cm,2021
As a result, the waiting of Zhi Min writes a "Non-linear Narrative" in space and appears as a "Color of History" in time. Zhi Min's recent works remind people of the "cosmic” that transcends the individual and makes the medium of sculpture the medium of "cosmism.” His recent works are reminiscent of a transcendental "cosmic,” in which materials such as stone, clay, and porcelain, as sculptural mediums, are elevated to the moment of the cosmic explosion and the combustion theorem of thermodynamics while at the same time penetrating deeper into the inner stratum of the earth in the "Boundless Worlds,” and extending downward from the narrative of space to the "Depth of Time.” Or, in other words, to the real nature in the eyes of the Chinese. We can see that his works simultaneously express the modern vision of Op Art and the long tradition of Chinese history, just as "Trigrams of Luo and Yellow Rivers" connects the rivers of the earth and the Milky Way of the zenith at the same time, so the sculptural space and the temporal dimension of his personal art history are unfolding between each work.
This exhibition is Zhi Min’s first solo exhibition in the gallery. It is a testament to the artist’s active waiting, resulting from the back-and-forth and dialectic of active creation and passive behavior and the mutual waiting and simultaneous progress of Zhi Min's multiple creative threads. The sculptor and his works stayed in cosmic space, wandering amid the heavens, and have long been ready to land back in the world, entering the next stage of new waiting in coherent creation.

郅敏个展「等待」展览现场,凯旋画廊,中国,2024
Installation View of Waiting for the Inevitable
Triumph Gallery, China, 2024


郅敏,1975年出生,现工作生活于北京。中国艺术研究院雕塑院常务副院长、教授、博士研究生导师。
郅敏的作品以其观念性特征显著,他将雕塑作为哲学观念的物态形式,与传统艺术表现论有明显区别 。他的作品探索个体与自然、经验与超验的关系,呈现从具象到抽象的转变,跨越传统审美,直接通达于哲学 。郅敏通过雕塑艺术,探讨了自然观、科学观,以及华夏文明的哲学阐释方法,同时也是面向当代创造力的尝试 。
郅敏在中国美术馆、湖北美术馆、上海美术馆、法国巴黎文化中心、北京壹美美术馆等重要学术机构举办过11次个人展览,曾参加“达喀尔双年展"、“法国中法艺术展”、“意大利中国当代艺术展”等国际展事。参加北京双年展、武汉双年展、成都双年展,中国文联、中国美协举办的全国性展览数十次。
作品被中国美术馆、中国美术家协会、上海美术馆、湖北美术馆、宁波美术馆、中国雕塑博物馆、国家艺术基金、清华大学、北京大学、中国艺术研究院、中央美术学院、中央电视台、联合国教科文总部、美国罗德岛设计学院等重要学术机构收藏。
Zhi Min, born in 1975, is currently lives and works in Beijing. He serves as the Vice President, Professor, and PhD Supervisor at the Sculpture Institute of the Chinese Academy of Art.
Zhi Min's work is distinguished by its conceptual nature, using sculpture as a material form of philosophical ideas, distinct from traditional artistic expressions. His pieces explore the relationship between the individual and nature, experience and transcendence, showcasing a transition from figuration to abstraction that transcends traditional aesthetics and delves directly into philosophy. Though sculpture, Zhi Min examine perspectives on nature, science, and the philosophical interpretations of Chinese civilization, while also pioneering creativity in contemporary art.
Zhi Min has held 11 solo exhibitions at prestigious academic institutions such as the National Art Museum of China, Hubei Art Museum, Shanghai Art Museum, Paris Cultural Center, and Beijing One Art Museum. He has also participated in international exhibitions including the Dakar Biennale, Sino-French Art Exhibition, and Italy-China Contemporary Art Exhibition, as well as numerous national exhibitions organized by the China Federation of LIterary and Art Circles and the China Artists Association.
Zhi Min’s works are collected by prominent academic institutions and organizations including the National Art Museum of China, China Artists Association, Shanghai Art Museum, Hubei Art Museum, Ningbo Art Museum, China Sculpture Museum, National Art Fund, Tsinghua University, Peking University, China Academy of Art, Central Academy of Fine Arts, China Central Television, UNESCO Headquarters, and the Rhode Island School of Design in the USA.


张晨,美术学博士,现任中央美术学院人文学院副教授、硕士生导师,研究方向为视觉文化理论、西方艺术史、中外美术比较等。曾赴意大利威尼斯美术学院、法国巴黎艺术史研究中心、哈佛大学意大利文艺复兴研究中心、德国柏林世界文化宫访学交流。获第九届IAAC国际艺术评论奖(2023)、首届新世纪当代艺术基金会“墨缘”艺术史研究与写作资助计划(2023)等奖项。现主持国家社科基金艺术学青年项目“现当代身体艺术理论研究”,完成国家社科基金后期资助优秀博士论文出版项目。专著有:《身体·空间·时间——德勒兹艺术理论研究》(中国社会科学出版社,2020),译著有:《印象主义》(人民美术出版社,2014)、《1985年以来的当代艺术理论》(合译,上海人民美术出版社,2018)、《意大利文艺复兴新艺术史》(合译,江苏凤凰美术出版社,2024)等8部,在《文艺研究》、《美术研究》、《文化研究》等学术期刊发表论文多篇,也从事当代艺术的策展与评论写作。
Zhang Chen, Doctor of Fine Arts, currently an associate professor and master's supervisor at the School of Humanities, Central Academy of Fine Arts. His research interests include visual culture theory, Western art history, and comparison of Chinese and foreign art. He has visited the Academy of Fine Arts in Venice, Italy, the Center for Art History Research in Paris, France, the Center for Italian Renaissance Studies at Harvard University, and the Palace of World Culture in Berlin, Germany. He won the 9th IAAC International Art Critic Award (2023), the first New Century Contemporary Art Foundation "墨缘" Art History Research and Writing Funding Program (2023), and other awards. He is currently the host of the National Social Science Fund Art Youth Project "Research on the Theory of Modern and Contemporary Body Art", and has completed the National Social Science Fund Post-Funding Excellent Doctoral Dissertation Publishing Project.
©文章版权归属原创作者,如有侵权请后台联系删除