面对全球医药产业的激烈竞争,拜耳正在经历一场深刻变革。
近日,拜耳公布2024第二季度财报,更新了其正在进行的裁员计划,称其在2024年上半年裁员超过3000人,主要是管理职位,这一数字不仅标志着拜耳转型的加速,也引发了业界对其未来发展的广泛讨论。

裁员计划是拜耳重组的一部分,目的是优化管理层级,削减官僚作风,将更多决策权下放至一线员工。首席执行官Bill Anderson指出,这与公司长远的成本削减目标——到2026年每年减少20亿欧元开支——紧密相连。
值得注意的是,组织架构重组计划成功与否,不仅取决于成本节约和运营效率的提升,业界对拜耳的这一举措显然有着更多的希望,期待看到其转型带来的长期效果和对行业的影响。
去年亏损近30亿欧元
重组能否挽救拜耳?
2023年对拜耳集团而言,无疑是充满挑战的一年,不仅面临业绩下滑的困境,还承受了亏损的压力。根据发布的财报数据显示,拜耳集团的销售额为476.37亿欧元,较上年同比下滑了1.2%,经汇率与资产组合调整后;而不计特殊项目的息税折旧摊销前利润(EBITDA)更是下降了13.4%,为117.06亿欧元。此外,每股核心收益降至6.39欧元,同比减少了近20%。最引人关注的是,拜耳的净收入出现了29.41亿欧元的亏损。
面对这样的业绩挑战,拜耳在管理层上作出了重大调整。
2023年2月,拜耳宣布前罗氏制药CEO Anderson将成为拜耳下一任CEO。Anderson于同年4月加入拜耳,并在6月正式担任拜耳集团CEO。Anderson上任后,立即着手推动一系列深刻的变革措施,以期扭转不利局面。
在去年的三季度电话会议上,Anderson指出,拜耳虽然收入高达近500亿欧元,但现金流状况不甚理想,股价表现也难以令人满意。他将问题的根源指向了过于复杂的管理体系,认为多达12层的管理岗位严重阻碍了创新的步伐。
正是在这种背景下,拜耳集团在2024年初启动了一项大规模的重组计划。Anderson提出,计划到2024年底取消多个管理层级,将决策权下放,预计约95%的决策将从管理者手中转移到一线工作人员,以此大幅提升拜耳的运营效率。今年1月,拜耳正式推出了DSO(Dynamic Shared Ownership,动态的责任共担)这一创新的运营模式,目标是简化内部等级制度,根除官僚主义,从而实现运营效率的最大化。
Anderson将扁平化管理层级和削减官僚主义视为拜耳复兴的关键策略。2024年第一季度,拜耳已经减少了1500个职位,主要集中于管理岗位。2024年上半年,拜耳累计裁减了3200个职位。据悉,裁员计划预计持续至2025年,届时将完成整个集团的转型。
拜耳2024年第一季度的财报显示,销售额为137.65亿欧元,经汇率与资产组合调整后,轻微下降了0.6%。同时,EBITDA也略有下降,为1.3%,降至44.12亿欧元。
随着DSO模式的深入推进,Anderson为拜耳开出的“良方”开始显现效果。到了2024年上半年,业绩呈现出积极的转变。根据8月6日发布的财报,拜耳在上半年实现了总营收249.09亿欧元,同比增长1%,净利润达到11.23亿欧元。特别是在第二季度,随着战略和结构改革的全面展开,销售额同比增长3.1%,达到111.44亿欧元,这表明拜耳正逐步走出困境,朝着复苏与增长的方向稳步前行。
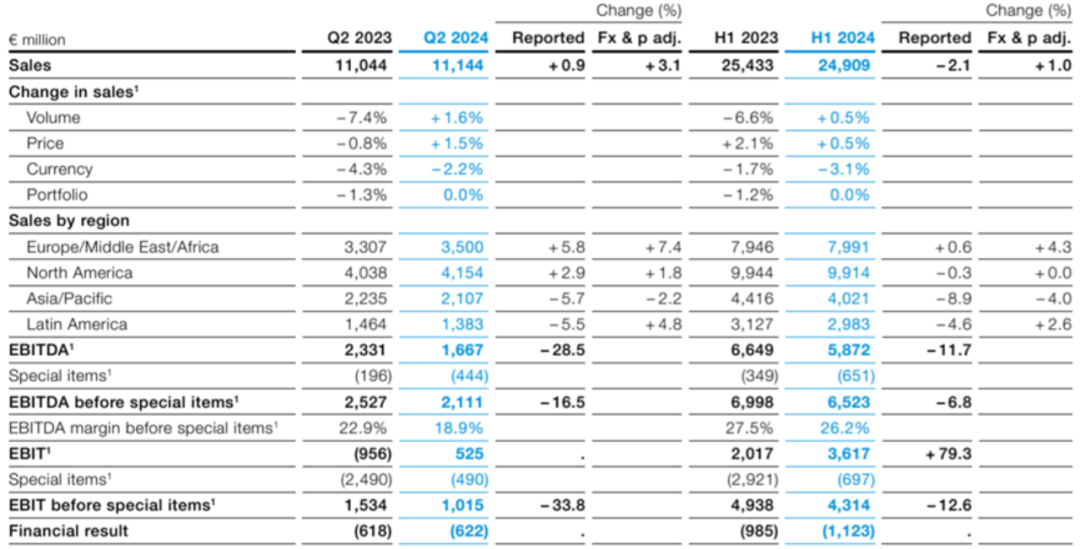
拜耳制药业务全球商业化负责人Christine Roth指出,制药商业化部门的裁员将在今年第四季度初基本完成,这将带来更快的市场响应和更高效的运营模式。同时,拜耳中国也在进行重大运营调整,计划转变为由五大业务板块和六大职能部门组成的新架构,预计相关遴选结果将在9月底前完成。
通过这些连贯的举措,拜耳正逐步构建一个更加精简和高效的企业架构,以期在全球医药行业中保持竞争力,并实现长期的可持续发展。
业内人士指出,拜耳的DSO运营模式预计将减少管理层级、消除官僚主义、精简机构,从而加快决策进程,让拜耳实现更快捷高效的运营管理。但转型的成功与否,还需取决于市场接受度、竞争环境以及公司对新运营模式的适应和执行能力。
寻找新的明星产品
肿瘤“百亿美元”目标如何实现?
拜耳的业务版图由三大支柱构成:处方药、健康消费品和作物科学。在2024年上半年,处方药业务营收达到89.63亿欧元,同比增长4.2%,其中第二季度单季营收46.05亿欧元,同比增长4.5%。这一增长得益于包括Nubeqa(达罗他胺)、Kerendia(非奈利酮)、Eylea(阿柏西普)在内的主要产品线和放射业务的持续增长。
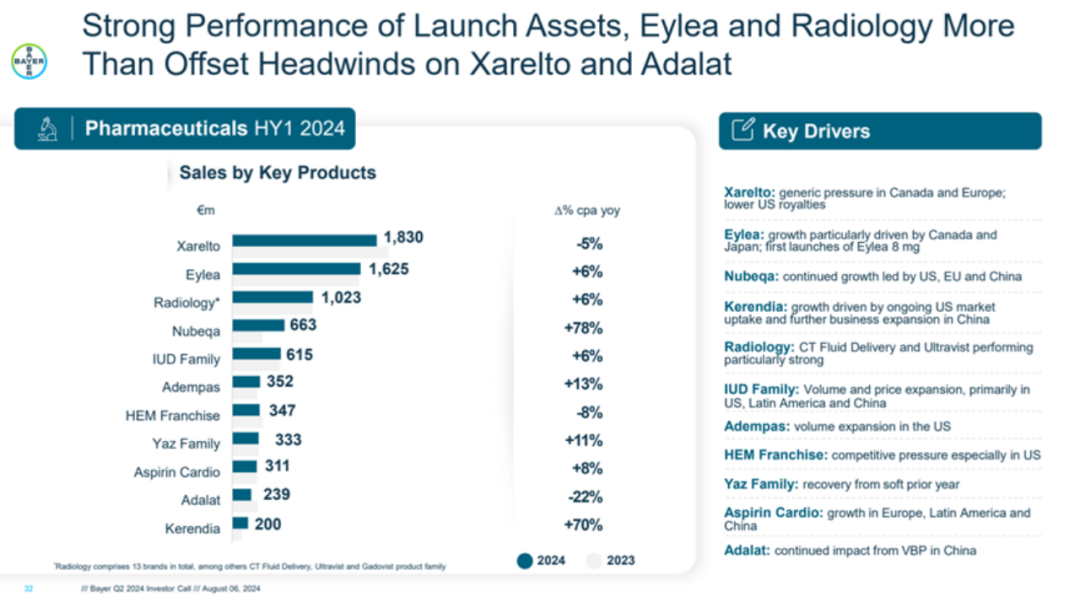
在拜耳的产品组合中,口服抗凝剂Xarelto(利伐沙班)以其18.30亿欧元的销售额在2024年上半年领跑公司产品线,尽管这一数字较去年下降了4.8%,主要受专利到期的影响。
排名第二的是眼科治疗药物Eylea(阿柏西普),同期销售额达到16.25亿欧元,同比增长5.6%。
值得注意的是,这两大拳头产品均遭遇“专利悬崖”危机,随着专利保护的到期,仿制药的入市可能会对原有产品的销售造成冲击。
此外,拜耳的Nubeqa(达罗他胺)和Kerendia(非奈利酮)也展现了卓越的市场表现,分别以6.63亿欧元和2.0亿欧元的销售额,同比增长78.4%和69.9%。这些成绩不仅推动了拜耳的业绩增长,也彰显了拜耳在治疗前列腺癌和慢性肾病等关键医疗需求上的创新能力和市场竞争力。
Nubeqa作为拜耳开发的一种新型非甾体雄激素受体抑制剂,在治疗非转移性去势抵抗性前列腺癌(nmCRPC)和转移性激素敏感性前列腺癌(mHSPC)方面取得了突破,其特异性作用机制和全球获批的广泛认可,使其成为拜耳肿瘤产品线中的关键增长点。7月17日,达罗他胺联合雄激素剥夺疗法(ADT)的Ⅲ期ARANOT研究达到主要终点,为Nubeqa的适应症扩大提供了坚实的基础。
Kerendia在慢性肾病治疗领域的潜力同样不容小觑。8月5日,其治疗心力衰竭的Ⅲ期FINEARTS-HF研究也达到了主要终点,预示着其适应症有望进一步拓宽。此前,Kerendia已被批准用于2型糖尿病相关的慢性肾脏病(CKD)成人患者,为其在心衰治疗领域的应用铺平了道路。这些研究成果的取得,不仅为患者带来了新的治疗选择,也进一步巩固了拜耳在医药创新领域的领导地位。
去年2月,拜耳执行副总裁兼肿瘤学战略业务部负责人Christine Roth在一次采访中表示:拜耳集团正寄望于其蓬勃发展的肿瘤业务板块,以实现其雄心勃勃的财务目标——到2030年,该业务部门的销售额预计将达到100亿美元,占其承诺的300亿美元药品总销售额的三分之一。同时,她表示100亿美元的销售额将使拜耳从当前全球抗癌药物销售的第14位跃进至前10强。

然而,在目前看来,距离这一目标的实现存在不小的压力。在医药行业,创新是企业持续发展的关键,而拜耳目前在创新药物方面依然在加大力度培育能够引领市场的“明星产品”。
拜耳集团的肿瘤治疗产品线包括了几种关键药物,如Nexavar(索拉非尼)、Xofigo(镭-223二氯化物)、Stivarga(雷格非尼)和Nubeqa。这些药物在肿瘤治疗领域扮演着重要角色。然而,随着Nexavar和Stivarga的专利到期,拜耳正面临来自仿制药的激烈市场竞争,这对公司的市场地位和收入构成了挑战。
此外,面对专利悬崖不断逼近,拜耳自2017年起成立了肿瘤战略业务部,专注于加强肿瘤领域的研发和创新,通过积极的战略合作和收购,不断扩充其肿瘤产品管线,以确保持续的产品创新和市场竞争力。
在肿瘤治疗领域,拜耳特别优先考虑了前列腺癌和胃肠道肿瘤等关键领域,致力于开发具有突破性的治疗方案。目前,拜耳正集中资源打造Nubeqa、Vitrakvi(拉罗替尼)和regorafenib(瑞戈非尼)等药物。
面对商业化挑战和产品管线的压力,拜耳能否在2030年实现百亿美元的癌症药物营收目标,裁员和架构调整等转型措施能否提高运营效率和市场竞争力,仍需时间的检验。《医药经济报》将持续关注。
商务合作
130 6172 3098
zakk.cui@siqibest.com




