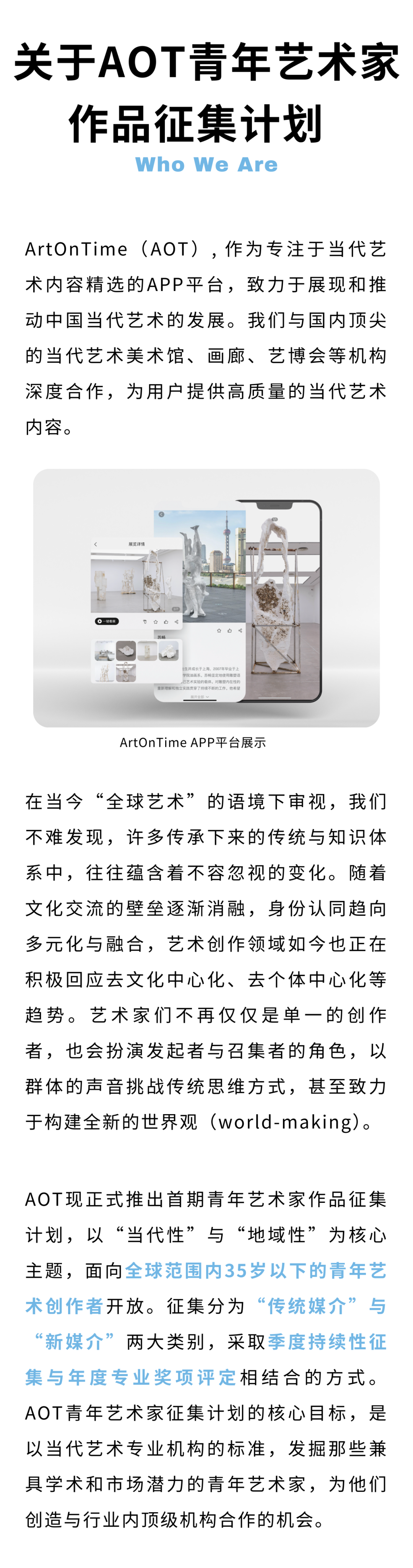
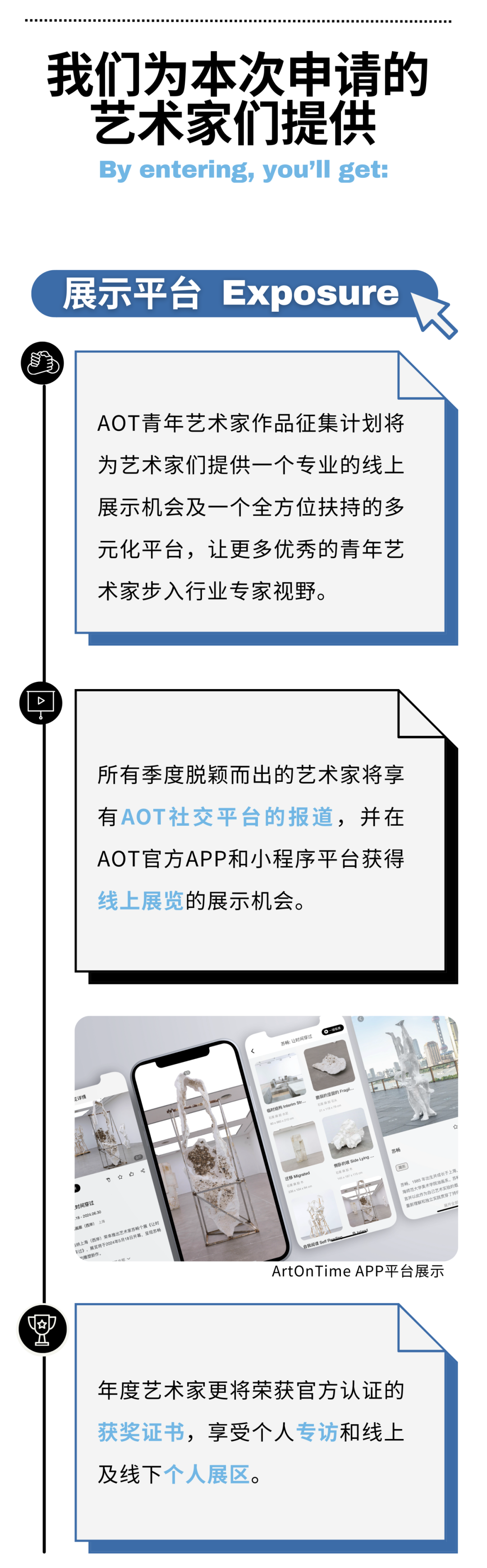
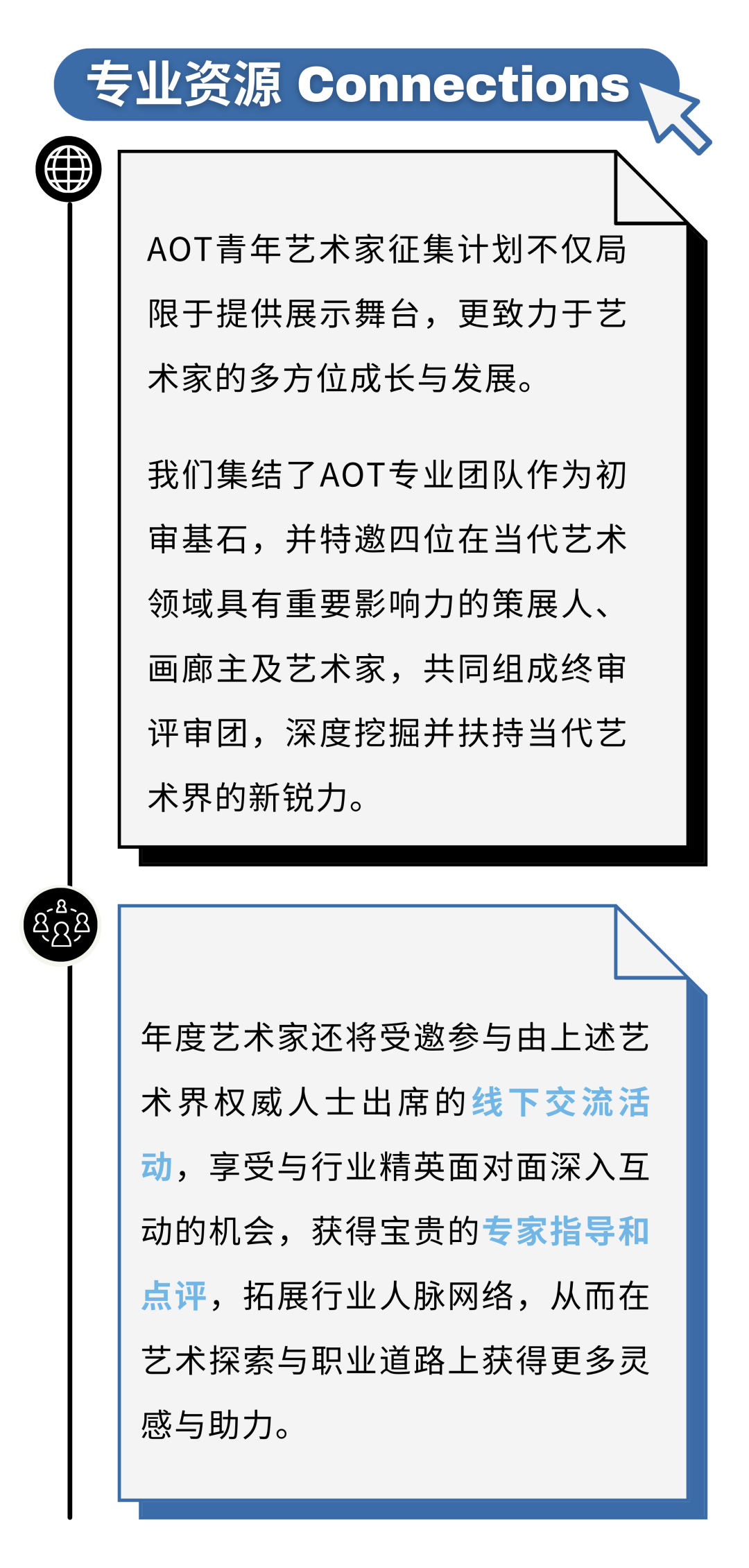
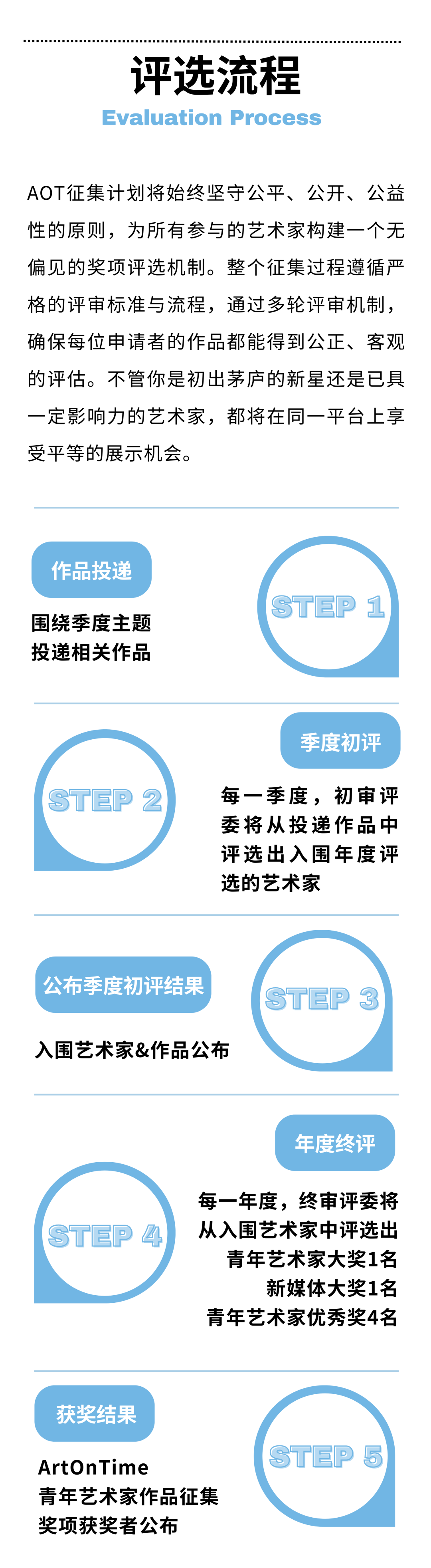
丁世伟
丁世伟(b.1989)硕士毕业于中国美术学院跨媒体艺术学院,现工作生活于杭州。他的作品在基于屏幕经验下的影像装置、雕塑、图像、视频、互动装置等多种媒介形式中展开。他广泛地对意识形态话语、流行图像与哲学符号进行援引和挪用,通过媒体界面开启观者的感知通道,过滤并干预个体降维的用户经验,进而昭示了屏幕景观作为当代政治与信仰的反乌托邦式的自我实现预言。屏显作为处于物质世界与数字拟像的中介,不断在参与观者身体的重塑与规训。他的作品一方面将观众已悄然异化的介面身体与观凝感官重新穿刺,另一方面以可爱化 (kawaiification) 作为模糊对立与矛盾的定言令式,在痛感与诙谐的矛盾知觉中不断缝合现实与虚拟的边界。
近期个展包括::幽灵腹语,拾萬空间,北京,2024;窗,1000 Press,杭州,2023;信仰得来速,Gallery Vacancy,上海,2021;随机预言,想象力学实验室,杭州,2020。近期部分群展机构包括:广东时代美术馆,广州,2024;天目里美术馆,杭州,2023;X美术馆,北京,2023;剩余空间,武汉,2022;山中天艺术中心,北京,2021;K11基金会,上海,2020;银川当代美术馆,银川,2019;中国美术学院,杭州,2018;昂西城堡博物馆,昂西,2017;Castello Di Rivara当代美术馆,都灵,2016;中央美术学院美术馆,北京,2015。他曾于2015获得法国克莱蒙费朗Prix Videoformes特别奖,并在2014年获美国华盛顿华语电影节银奖。他的短片作品在众多国际电影节展出,曾入围法国昂西国际动画节、荷兰国际动画节、鹿特丹国际电影节、坦佩雷电影节等。他的作品也亦被机构收藏包括:路易斯安那现代艺术博物馆,哥本哈根,丹麦;中央美术学院美术馆,北京,中国;四方当代美术馆,南京,中国;天目里美术馆,杭州,中国等。
DING SHIWEI
Ding Shiwei (b.1989) holds an MFA degree from the School of Intermedia Art at the China Academy of Art and now lives and works in Hangzhou, China. His works unfold in various mediums such as video installations, sculptures, images, videos, and interactive installations based on the experience of the screen. He invokes and appropriates a wide range of ideological discourses, popular images, and philosophical symbols, opening up the viewer's perceptual channels through the media interface, filtering and intervening with the individual's degraded user experience, thus revealing the screen landscape as an anti-utopian self-fulfilling prophecy of contemporary politics and beliefs. As a mediator between the material world and the digital simulacrum, the screen is constantly involved in reshaping and disciplining the viewer's body. On the one hand, his works re-pierce the viewer's silently alienated interface body and the observation senses, and on the other hand, ultimately adopting "kawaiification" as the categorical imperative to obscure the fanged structure, they constantly stitch together the real and virtual branching in a paradoxical perception of wit and pain.
His recent solo exhibitions include Specter's Ventriloquism, Hunsand Space, Beijing,2024; The Window, 1000 Press, Hangzhou, 2023; Faith on Tap, Gallery Vacancy, Shanghai, 2021; Enter The Void, Imagokinetics Lab, Hangzhou, 2020. Selected group exhibitions recently include By Times Museum, Guangzhou, 2024; Art Matters, Hangzhou, 2023; X Museum, Beijing, 2023; Surplus Space, Wuhan, 2022; Wind H Art Center, Beijing, 2021; K11 Art Foundation, Shanghai, 2020; MOCA Yinchuan, Yinchuan, 2019; China Academy of Art, Hangzhou, 2018; Musée-Château, Annecy, 2017; Castello Di Rivara Center for Contemporary Art, Turin, 2016; CAFA Art Museum, Beijing, 2015. Ding was the recipient of a special award for the Prix Videoformes in Clermont-Ferrand, France, in 2015 and a silver medalist of the Chinese Film Festival in Washington D.C., US, in 2014. His animated short films had screenings at various international film festivals, including Festival International du Film d’Animation d’Annecy, Holland International Animation Film Festival, International Film Festival Rotterdam, and Tampere Film Festival. His work is featured in the collections of Louisiana Museum of Modern Art, Copenhagen, DK; CAFA Art Museum, Beijing, CN; Sifang Art Museum, Nanjing, CN; By Art Matters, Hangzhou, CN; etc.