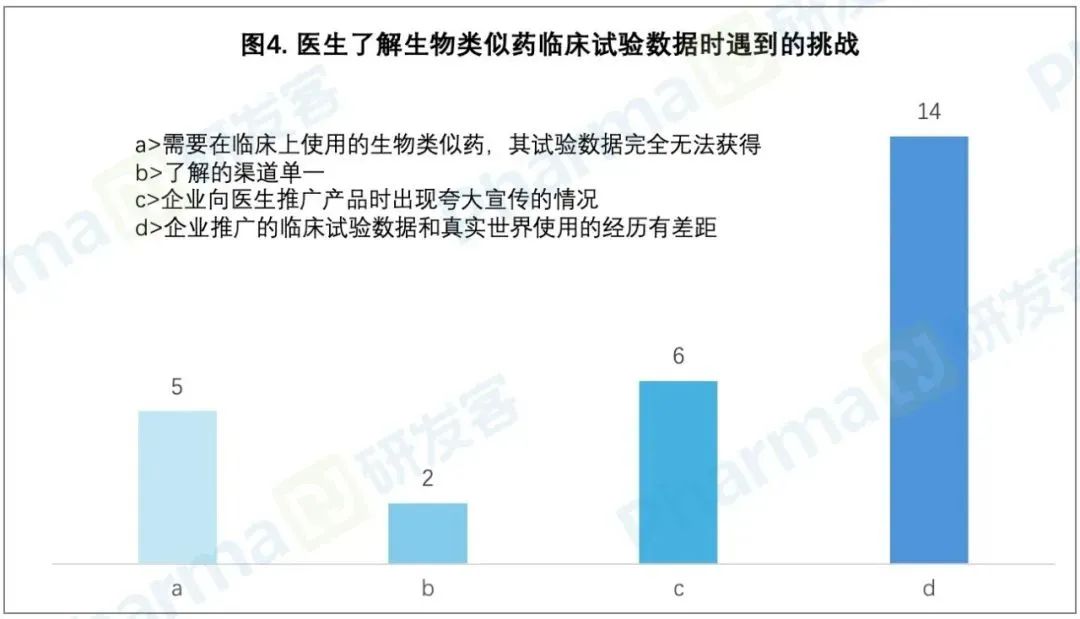
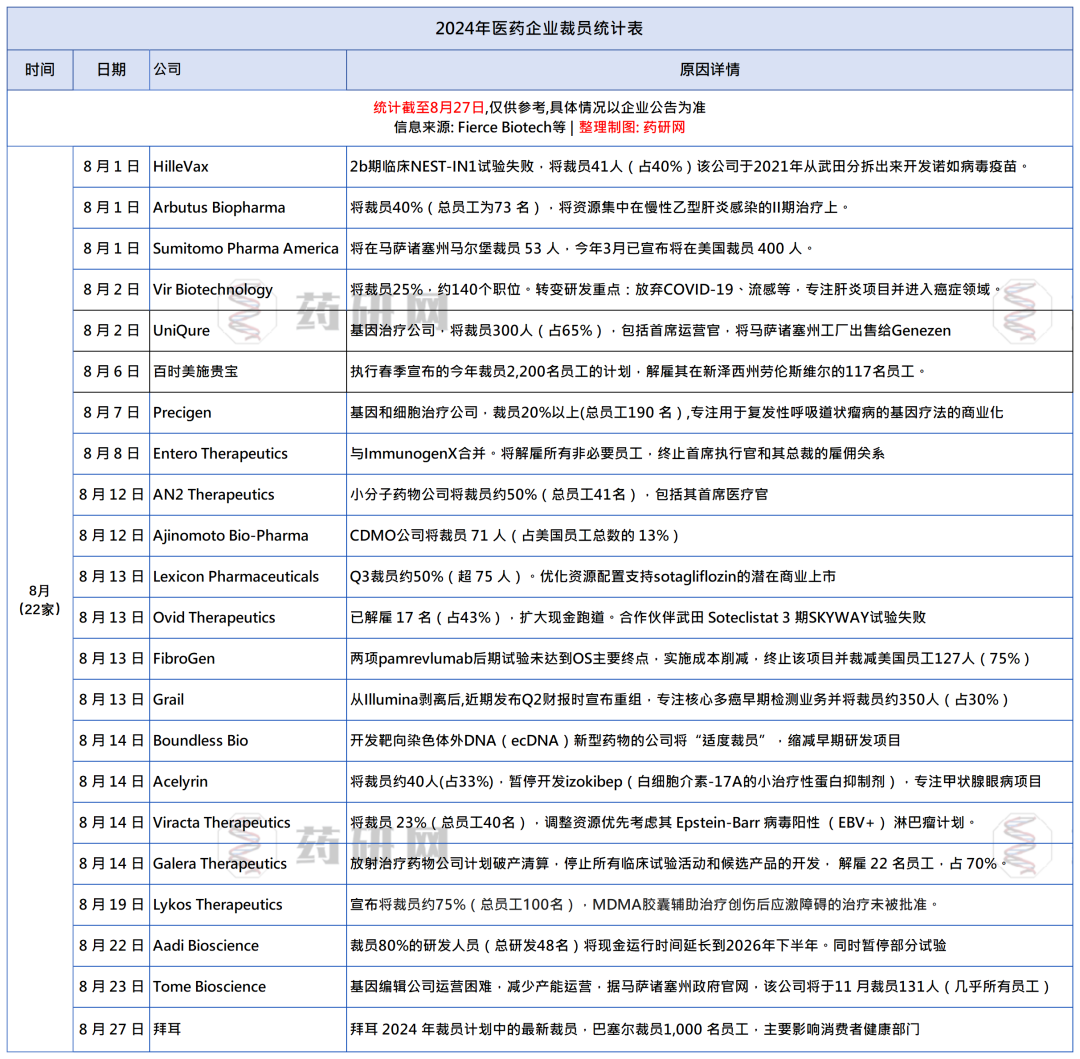
EXPLORER-LTE研究3.5年的累积数据分析显示,患者的超声心动图参数与症状获得持续稳定改善,未观察到新的安全性信号
迈凡妥®是首个且目前唯一获批的心肌肌球蛋白抑制剂,靶向有症状的梗阻性肥厚型心肌病的核心病理生理机制
上海2024年9月1日 /美通社/ — 百时美施贵宝今日公布了MAVA长期扩展研究(MAVA-LTE)中EXPLORER-LTE队列的最新长期随访结果。该研究旨在评估迈凡妥®(玛伐凯泰胶囊)治疗纽约心脏协会(NYHA)心功能分级II-III级、有症状的梗阻性肥厚型心肌病(oHCM)成人患者的长期有效性和安全性。
今日,该研究180周随访结果在伦敦举行的欧洲心脏病学会(ESC)年会上公布,研究结果进一步确证了全球首创心肌肌球蛋白抑制剂玛伐凯泰的疗效和安全性特征。玛伐凯泰已被纳入有症状的梗阻性肥厚型心肌病的标准治疗,获得ESC和AHA/ACC指南推荐,作为一线治疗后症状持续的梗阻性肥厚型心肌病患者的治疗选择。
研究结果显示,经过长达3.5年(180周)的连续治疗,患者的超声心动图参数与生物标志物获得持续稳定改善,这些指标包括静息左心室流出道(LVOT)压差、Valsalva LVOT压差、左心房容积指数、N-末端脑钠肽前体(NT‐proBNP)水平。基于NYHA心功能分级和患者报告结局的评估结果,患者的症状与功能能力同样有所改善,其中大部分患者达到NYHA心功能分级I级。在长达3.5年的随访中,玛伐凯泰的长期安全性与已知的安全性特征一致,未发现新的安全性信号。
西班牙马德里耶罗门大学医院心血管内科遗传性心脏病与心衰负责人、西班牙心血管研究所(CNIC)教授Pablo García-Pavia博士表示:"在超过三年的随访期内,玛伐凯泰治疗组患者的多项心脏指标均获得持续稳定的改善,有力证明了该药物能有效满足有症状的梗阻性肥厚型心肌病患者的重要治疗需求。这些积极的长期数据,连同玛伐凯泰被纳入欧洲心脏病学会(ESC)梗阻性肥厚型心肌病临床指南,均凸显了在此需要持续管理的终身疾病中,玛伐凯泰长期治疗的重要地位与作用。"
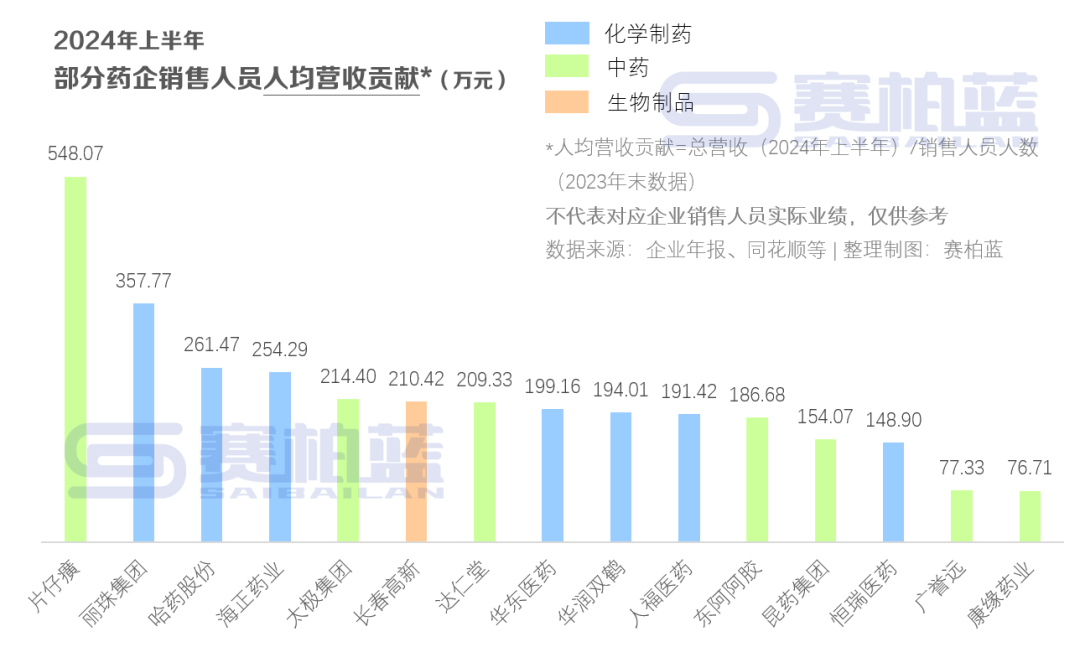
截至数据分析之日,在MAVA-LTE的EXPLORER-LTE队列中,231名患者中有211名仍在接受玛伐凯泰治疗,185名患者的治疗期达到156周,99名患者的治疗期达到180周。EXPLORER-LTE数据分析的主要结果显示,从基线到第156周和第180周,患者的超声心动图参数与生物标志物均获得持续改善。在超声心动图指标中,患者在第156周和第180周的Valsalva LVOT压差降低平均值均为55.3 mmHg,在第156周和第180周的静息LVOT压差降低平均值分别为40.2 mmHg和40.3 mmHg。从基线到第144周和第180周,患者左心房容积指数(LAVI)均获得持续改善,LAVI降低平均值分别为3.5 mL/m2 和5.5 mL/m2。左心室射血分数(LVEF)从基线到第180周平均下降了11%,其均值(63.9%)保持在正常范围内。针对生物标志物数据的评估显示,NT-proBNP中位值在第156周时下降了 504 ng/L,在第180周时下降了 562 ng/L。
在第180周,大部分患者(66.3%)达到NYHA心功能分级I级。总体而言,108名患者(46.8%)在研究期内达到完全缓解,即NYHA心功能分级 I 级,同时Valsalva LVOT压差 ≤ 30 mmHg,并在数据截止前保持完全缓解。基于HCM症状问卷(HCMSQ)的患者报告结局显示,患者的气促评分在治疗的前12周即较基线获得改善,并持续到第156周和180周。
百时美施贵宝高级副总裁,免疫学、心血管与神经科学(ICN)开发负责人Roland Chen博士表示:"这些数据源自玛伐凯泰3期EXPLORER研究迄今最长的随访结果,进一步证实了该药物的既有安全性和疗效。玛伐凯泰是首个且目前唯一获批用于治疗有症状的梗阻性肥厚型心肌病的心肌肌球蛋白抑制剂,已惠及全球数千名患者,其靶向此类疾病的核心病理生理机制,正在重新定义这一患者群体的治疗前景。"
EXPLORER-LTE分析结果显示,玛伐凯泰治疗组患者中未观察到新的安全性信号。共有20名患者(8.7%)的LVEF一过性<50%,在治疗中断后均回升至≥50%,其中14名患者重新启动玛伐凯泰治疗。