苏州2023年6月13日 /美通社/
2023年6月9-10日,由国家生物药技术创新中心指导,中国研究型医院学会医工转化与健康产业融合专业委员会、博腾生物、佰傲谷BioValley 、BioBAY 联合主办的第三届中国基因与细胞治疗青藜风云论坛(CGCT 2023)在苏州圆满落幕。
本届大会持续聚焦中国细胞基因免疫治疗学术的最前沿,站在更高的高度、更深的广度,深度探讨细胞治疗、基因治疗、核酸药物、溶瘤病毒等领域的新成果新突破,共论CGT领域的新时代。本次论坛邀请了生物医药行业领袖、临床IP、科研代表、知名资本方以及日韩美国际嘉宾加盟,共话CGT领域发展,参会规模800+。

苏州工业园区党工委委员、管委会副主任倪乾,中国药品监督管理研究会常务理事、研究会CGT专委会主任委员王越,苏州独墅湖科教创新区党工委副书记、管委会主任陈莉,苏州工业园区科技创新委员会副主任李霁雯,苏州纳米技术大学科技园管理有限公司副总经理孙云鹏等领导出席活动。

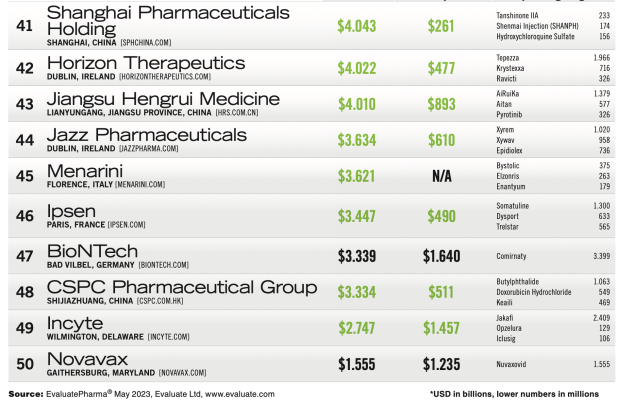
博腾生物首席执行官王泱洲博士为本届大会致欢迎辞。细胞与基因治疗持续发展,在技术、资本和政策的驱动下,基因细胞治疗药物已成为极具前景的新型治疗药物,其影响在行业中不断攀升、备受瞩目。目前,全球CGT研发公司逾1500多家,全球共有2200多项CGT药物进入临床试验阶段。迎着基因细胞治疗的时代潮浪,博腾生物持续布局基因与细胞治疗赛道,不断加强端到端的CDMO服务。目前,博腾生物已经搭建了质粒、细胞治疗、基因治疗、溶瘤病毒、核酸治疗及活菌疗法等CDMO平台。历经三载的沉淀和成长,青藜风云论坛也一直坚持和与会嘉宾一道用心赋能基因细胞治疗,用心助力创新药物在中国乃至全球的快速发展。这也是博腾生物一直努力的目标和方向,并祝愿本次论坛取得圆满成功。
中国研究型医院学会医工转化与健康产业融合专业委员会副主委兼秘书长张苏华先生为大会致辞。中国研究型医院学会医工转化与健康产业融合专委会作为本次活动的主办单位之一,也在持续关注基因与细胞治疗的发展,持续致力于推动政产学研用融合发展,推动医学科技成果加速转化,推动复合型人才不断培养,推动医院发展模式全面创新,更好地满足人民群众日益增长的健康需求。专委会过去也成功推动了包括人工心脏等医疗器械及药品在内的医工转化进程。他期待能够为各位专家和各位企业的事业发展添砖加瓦,一起努力,共谋发展。
中国药品监督管理研究会常务理事、研究会CGT专委会主任委员王越先生为大会致辞。在政策持续加码的保驾护航下,国内细胞与基因治疗领域的研究已经成为全球研发的重要力量。一方面国家有关部门制定了一系列政策法规,加强CGT产品监管,保障产品合规性与安全性。另一方面,多地出台支持性政策,鼓励和支持研究与临床转化,给予了细胞与基因治疗产业高度的关注和扶持。作为细胞与基因治疗的行业标杆峰会,青藜论坛持续聚焦细胞基因治疗学术的最前沿,探讨与分享新成果。相信论坛会为各位来宾带来更多的真知灼见、思想启迪和合作机遇,并祝愿本次论坛取得圆满成功。
苏州工业园区党工委委员、管委会副主任倪乾先生为大会致辞。苏州工业园区是中国和新加坡两国政府间的重要合作项目,经过29年建设发展,在国家级经开区综合考评中实现七连冠,在全国高新区排名中位列第四。园区拥有相关企业2300多家,培育境内外上市企业24家,去年实现产值1368亿元,产业综合竞争力稳居全国第一方阵。园区重点布局发展生物医药产业,在基因与细胞治疗领域,不仅拥有药明巨诺、亘喜生物、纽福斯等业内知名企业,同时也引进了一批以博腾生物为代表的细胞免疫治疗公司,构建了从基因编辑到上下游平台再到商业化生产的全产业链平台。中国基因与细胞治疗青藜风云论坛,三年来已发展成为园区推动细胞基因领域高质量发展的标志性活动。我们也真诚期待,以本届论坛为平台,与各位专家、企业家开展更深层次、更宽领域、更大力度的科技交流与合作,并祝愿本次论坛取得圆满成功!