张丰渊:无尽诱惑 Miranda Fengyuan Zhang: Perpetual Temptation
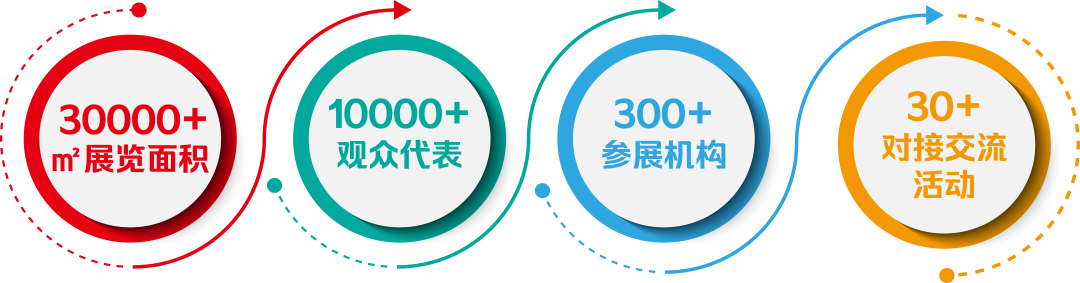
展期 Dates: 2025.11.08 – 12.24
开幕 Opening: 2025.11.08 15:00 – 19:00
地址 Address: 胶囊,上海徐汇区安福路275弄16号1层
Capsule, 1st Floor, Building 16, Anfu Lu 275 Nong, Xuhui District, Shanghai, China
胶囊荣幸呈现常驻纽约的艺术家张丰渊(Miranda Fengyuan Zhang)于画廊的第二次个展“无尽诱惑”,展期为2025年11月8日至12月24日。本次展览标志着艺术家首次正式公开展示雕塑创作。一系列陶瓷雕塑中,截短拇趾的右足为艺术家一任爱人的身体铸模而成,人的脚与鱼尾融为一体。这超现实的混合体从特制玻璃展柜中浮现,为展览中的其他作品铺陈了寓言式的线索。飘浮的蓝色气泡串连起墙上的一系列织物作品,其面貌各不相同——细小而黯哑,饱满而光亮,或像素化或碎裂成片。它们让人想起安徒生《海的女儿》中小美人鱼踏上陆地,双足剧痛,最终化为泡沫的结局。割裂的气泡指向一种不可能:包裹着一团空气的薄膜已被切割成丝带般的条状,但其外缘仍保持着球体原本的弧形,仿佛一颗心执着地留恋着幻肢的记忆。

Miranda Fengyuan Zhang 张丰渊 | Bubble (Chance) 气泡(随机)| 2025 | hand woven cotton 手工编织棉布 | 41.5 x 41.5 cm
张丰渊对这异化的足灌注了近乎教徒般的虔诚,几乎将它视为一种供奉之物,一种精神上的执迷。相比之下,她以平面化的透视、马蒂斯式的色块编织的手的图像则弱化了敬畏之意。灵巧的手指或编织织物、演奏乐器,或在创作间隙完成日常琐事,在凡俗的语境中作为劳作工具被剥削。在《手》(所有作品创作于2025年)中,一双手的旁边写着“HAND”,这看似多此一举的标注令人不安,使人联想到资本主义社会中对劳动者的分类与评估机制。在《肢》中,一根竖起的中指似乎直白地表达着对现状的不满。与此同时,另一只手的空壳了无生气地垂落在《Em》的表面。《格伦握着手》则描绘了一场双手之间的温柔角力。画面上方,一只手托着另一只的侧影;画面下方,两手翻转,被托举的那只反而向下压着另一只的掌心,如同在一场掰手腕中取得了胜利。
Miranda Fengyuan Zhang 张丰渊 | Discipline 戒律 | 2025 | hand woven cotton 手工编织棉布 | 153 x 102.5 cm
一件织物作品上写着“DISCIPLINE(戒律)”,再次唤起身心的秩序与控制的议题。乍看之下,这对高举的双手似是在操纵提线木偶,细看却发现,它们其实是一位钢琴家的手。左手越过右手去按下远处的琴键。这双手出自艺术家长期以来的缪斯、已故加拿大钢琴家格伦·古尔德(Glenn Gould,1932–1982)的一张照片。黑白照片中,这位鬼才音乐家俯身在琴键上,身上发白的格纹衬衫正呼应了张丰渊织物作品中网格状的底纹。编织与钢琴在某种意义上异曲同工——二者的物理基础都是紧绷的纤维,亦都是可被机械化的载体(如动力织机和自动钢琴)。照片里,古尔德专注地弹奏着,露出神秘的粲然一笑。
没有目的的手势即是舞蹈。“空置的手”这一意象「譬如罗丹1877年的雕塑《青铜时代》(L'âge d'airain)中失去长矛的士兵」之所以能在我们的集体想象中经久不衰,部分归结于其模糊性,部分则是由于古迹大多残缺,而我们早已习惯将这视为美的(甚至是理想的)形态。波利克里托斯(Polykleitos)的《持矛者》(Doryphoros)失去了武器,《米洛的维纳斯》缺失双臂,《萨莫色雷斯岛的胜利女神》是一座无头塑像。还有米利都的躯干,赖内·玛利亚·里尔克(Rainer Maria Rilke)在1908年的十四行诗《阿波罗的躯干》(Archaic Torso of Apollo)中吟咏它“胸膛的曲线”和“胯腰的轻旋”正因缺失了“传说中的头颅/熟果般的眼眸”而格外令人目眩。
Miranda Fengyuan Zhang 张丰渊 | Playing on Red 在红色上弹奏 | 2025 | hand woven cotton 手工编织棉布 | 152 x 103 cm
里尔克写下这首诗,是在他于巴黎郊外担任罗丹的私人秘书一年之后。二人初识于1902年,此后不久,这位当时籍籍无名的年轻诗人出版了一部有关这位年长的著名雕塑家的专著。这段工作关系激发了里尔克转变写作风格的愿望。相较那位《思想者》(Le Penseur,1904)和《众神信使伊里斯》(Iris, messagère des Dieux,1891–94)的创作者“高度实体化”的形式,里尔克开始反思自己早期作品“飘渺”“无形”的特质「借用诗人马克·多蒂(Mark Doty)的描述」。但这段合作最终因罗丹众所周知的暴躁性情而戛然而止。在突然被解雇的阴影下,里尔克为他颂扬米利都躯干的诗篇写下了这样的结尾:“此处没有一寸/不在注视你/你必须改变你的生活。”这笔锋突转的尾联被视为诗人面对古代残躯时的顿悟——他必须让自己配得上这充满美感与欲望的碎片。而这,或许正是张丰渊材料探索的核心张力所在。究竟应如何实现蜕变?是通过更精准的控制和更严苛的自律,抑或是彻底臣服于形式与肉身的诱惑?
撰文:Jenny Wu
Miranda Fengyuan Zhang 张丰渊 | FF007 | 2025 | porcelain, acrylic vitrine, wood, mirror 瓷,亚克力罩,木头,镜子 | 121 x 45.2 x 45.2 cm
Capsule is pleased to present New York-based artist Miranda Fengyuan Zhang’s second solo exhibition at the gallery “Perpetual Temptation”, on view from November 8 to December 24, 2025. The exhibition marks Zhang’s first official foray into sculpture, featuring a suite of ceramic works modeled after a large right foot with a truncated big toe. Cast from the body of one of the artist’s acquaintances, each sculpture fuses a human foot with a fish’s tail. The surreal amalgams, partially submerged in the bases of custom-built vitrines, inflect the other works on view with allegory. Faced with two sets of weavings haunted by the recurring image of a blue bubble, which appears in varying guises – small and matte, large and shiny, pixelated, or fragmented – one recalls the bubbles into which Hans Christian Anderson’s little mermaid dissolves after suffering acute pain in her feet while walking on dry land. The works in which the bubble appears fragmented suggest an impossibility: the film holding the pocket of air has been sliced into ribbons, but the edges of the ribbons still trace a curve, like the mind clinging to the memory of a phantom limb.
Zhang devotes almost religious attention to the anomalous foot, transforming it into a votive offering, a fetish in the spiritual sense. By contrast, her woven depictions of hands – flattened as they are into broad, Matisse-like color planes – show little reverence. Nimble fingers used to weave textiles, play musical instruments, and perform mundane tasks between sprints of creative labor are not venerated so much as they appear exploited as instruments of work. In HANDS (all works 2025), a set of hands is labeled “HAND”; this unsettling redundancy evokes the kinds of categorization and assessment that streamline worker exploitation in capitalist societies. In LIMB, a raised middle finger seems fed up with the status quo; meanwhile, the drained shell of another hand clings to the surface of Em. Glenn Holding Hands Posing depicts a tender power struggle between two hands: in the upper portion of the composition, one cups the other shown in profile; below, the hands invert – the cupped hand presses down on its counterpart’s upturned palm, as if it’s won an arm-wrestling match.
One of Zhang’s weavings reads, “DISCIPLINE,” evoking, again, a sense of regulation, both externally and internally imposed. At first blush, the pair of hands held aloft here resembles a puppet master’s. On closer inspection, the hands are actually those of a pianist. The left hand is crossing over the right to ring a key on the other side. These hands are modeled after those of the late Canadian pianist Glenn Gould (1932–1982), Zhang’s longtime muse. They come from a black-and-white photograph in which the maverick musician leans over his keys in a white, faintly checkered shirt that echoes the gridded grounds of Zhang’s weavings. Weaving and piano-playing are comparable in certain respects: both rely on a system of taut fibers, and both are creative acts that can be mechanized (see, for instance, the power loom and the player piano). Photographed mid-recital, hard at work, Gould flashes a broad, enigmatic smile.

Miranda Fengyuan Zhang 张丰渊 | Glenn Holding Hands Posing 格伦握着手 | 2025 | hand woven cotton 手工编织棉布 | 151.5 x 103.5 cm
Gestures without implements become dance. Images of emptied hands – think: the soldier in Auguste Rodin’s L'âge d'airain (1877) without his spear – hold sway over the collective imagination partly because of their ambiguity and partly because so many relics from antiquity are themselves incomplete, and we have been taught to see these fragments as beautiful – even ideal – forms. The Doryphoros of Polykleitos is missing his weapon, the Venus de Milo her arms, the Niké of Samothrace her head, too. Then there is the Miletus torso, the beloved object in Rainer Maria Rilke’s 1908 sonnet “Archaic Torso of Apollo,” which registers the broken sculpture’s “curved breast” and “placid hips” for want of its “legendary head / with eyes like ripening fruit.”
Rilke wrote this poem after spending a year working as Rodin’s private secretary in a suburb of Paris. The two men had met in 1902, shortly after which the young and then-obscure poet published a monograph on the older, celebrated artist. Their working relationship inspired Rilke to want to change his writing style; he started to consider his own early works, in the words of poet Mark Doty, “airy” and “disembodied,” compared to the “highly physicalized forms” conceived by the maker ofLe Penseur (1904) and Iris, messagère des Dieux (1891–94). But Rilke was dismissed suddenly from his post by the notoriously temperamental sculptor. The encomium to the Miletus torso, tinctured by this recent rejection, ends with the oft-quoted lines, “[H]ere there is no place / that does not see you. You must change your life.” The volta is said to represent the speaker’s realization, upon beholding the ancient torso, that he must make himself worthy of the beautiful and erotically charged fragment, which seems also to be the tension that lies at the heart of Zhang’s material investigations. One is left to wonder how this will be accomplished: through greater control and disciplined action, or through total surrender to the temptations of form and flesh?
Text by Jenny Wu
关于艺术家

张丰渊(出生于中国,常驻纽约)将纺织视为一种观念系统,通过这一系统思考秩序与失序、放纵与克制。对她而言,纺织既是方法,也是隐喻。在这过程中,结构与脆弱、精确与偶然被编织在一起。织机成为一个实验场,规则在此被不断测试,让控制随时可能崩塌。
张丰渊的艺术实践始于对材料潜能的探索,她从手工针织转向纺织,以经纬线重构图像。她的早期作品常以单色背景为底,灵感来自亲身旅行经验,以及现代建筑与风景的视觉语言,探讨记忆与感知如何被转译为织物的形式。
随后,她引入了结构化的图案,如条纹、方格、网格,作为图像展开的背景框架。这些图案取材于日常生活中的纺织纹样,暗示那些历来被归类为女性化或装饰性的材料。通过这种视觉秩序的系统,张丰渊不仅在探索形式语言,同时也在质疑材料与工具在社会建构中的角色,即织造、纹样与重复如何体现既有的规训与文化塑形。
这一探索逐渐发展为 “偶然”系列的作品,在创作流程固有的随机性生成了多层次的变化。以《气泡(随机)》为例,艺术家将气泡的图案数字叠加在粉黄条纹背景上,将其织成后拍摄,将照片切割为纸条,再将纸条随机重新排列拼贴,最终织就新的画面。每一步都重塑了图像与其内在逻辑,使结构与偶然得以并存。转译、分解与重构的过程本身成为作品的核心,凸显图像在不同控制与变化系统中的演变。
张丰渊的雕塑作品则将上述探索延伸至三维空间。作品以织物、陶瓷与拾得材料翻模铸造和组合而成,其重复与层叠的内在逻辑与纺织相互呼应,将柔性的系统转译为坚实的结构。无论在二维还是三维的创作中,她都将“形式”视为结构与崩解交汇的场域。
正如评论人Jenny Wu在《Artforum》中写道,张丰渊的创作是“一场从内部瓦解结构的冥想”,展现了一种在系统缓慢解体过程中寻求自由的实践。张丰渊目前的研究将纺织的逻辑延展到织机之外,投入更广泛的探寻:在创造、感知与放任之中,材料、戒律与偶然如何得以共存。
张丰渊曾在胶囊(中国上海)、CLEARING(纽约/洛杉矶)、Mendes Wood DM(巴西圣保罗、比利时布鲁塞尔)、Halsey McKay(美国纽约)以及Candice Madey(美国纽约)等地举办个展,也曾在MASSIMODECARLO(伦敦)、Clearing Gallery (美国纽约、洛杉矶)以及和Chambers Fine Art(美国纽约)等参与群展。
Miranda Fengyuan Zhang (b. China; lives and works in New York) approaches weaving as a conceptual system through which to think about order and disorder, restraint and surrender. For Zhang, weaving is both method and metaphor: a process that binds together structure and fragility, precision and chance. The loom becomes a site where rules are tested and control gives way to the possibility of collapse.
Zhang began her practice through an exploration of material possibilities, moving from hand-knitted forms to weaving as a way to reconstruct images through thread. Her early weavings, often set against monotone grounds, drew from personal travels and the visual language of modern architecture and landscape, examining how memory and perception could be translated into woven form.
She later introduced structured patterns—stripes, checks, and grids—as fixed frameworks within which images unfold. Drawing from domestic textile motifs, these patterns reference everyday materials historically coded as feminine or decorative. Through them, Zhang explores systems of visual order while questioning the material and the tool themselves as social constructs—how acts of weaving, patterning, and repetition embody both discipline and cultural conditioning.
This inquiry evolved into what Zhang calls chance pieces, where procedural rules generate layered transformations. In Bubble (Chance), for instance, a woven field of pink and yellow stripes was digitally overlaid with a drawing of a bubble, re-woven, photographed, dissected into paper strips, rearranged by chance, and finally rewoven as collage. Each stage reconfigures the image and its logic, allowing structure and accident to coexist. The process itself—of translation, fragmentation, and reconstruction—becomes the work’s central subject, tracing how images move through different systems of control and change.
Zhang’s sculptural works extend these investigations into spatial form. Cast or assembled from textile, clay, and found materials, they echo the logic of weaving through repetition and layering, translating soft systems into solid structures. In both two and three dimensions, she treats form as a site where structure meets collapse.
Writing in Artforum, Jenny Wu described her work as “a meditation on structure undone from within,” revealing a practice that finds freedom through the slow unraveling of systems. Zhang’s ongoing research extends weaving’s logic beyond the loom—toward a broader inquiry into how material, discipline, and chance can coexist within acts of making, perception, and surrender.
Zhang has had solo shows at Capsule (Shanghai); CLEARING (New York / Los Angeles); Mendes Wood DM (São Paulo; Brussels); Halsey McKay Gallery (New York); and Candice Mandy Gallery (New York). Other exhibitions include: MASSIMODECARLO (London); Clearing (New York; Los Angeles) and Chambers Fine Art Gallery (New York).
©文章版权归属原创作者,如有侵权请后台联系



 ▎仙山秘境:蓬莱之岛 Penglai Fairyland ,纸本水墨 Ink on Paper,138 x 68 cm,2025
▎仙山秘境:蓬莱之岛 Penglai Fairyland ,纸本水墨 Ink on Paper,138 x 68 cm,2025