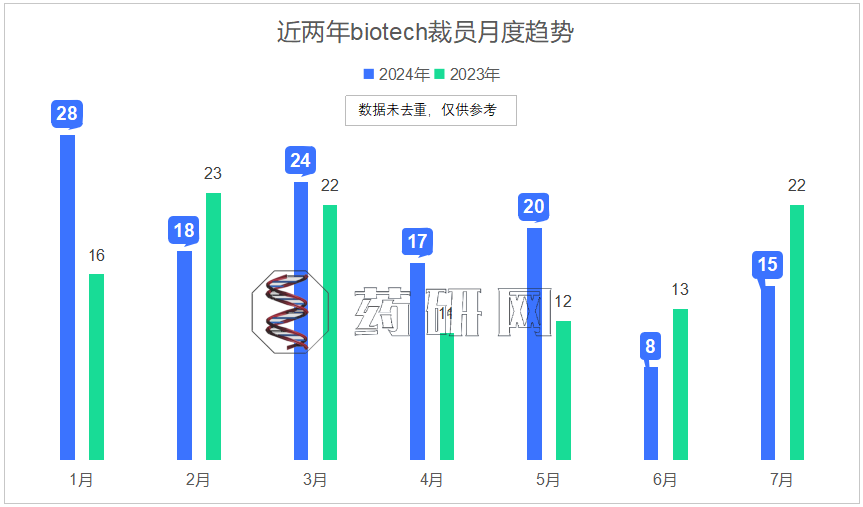
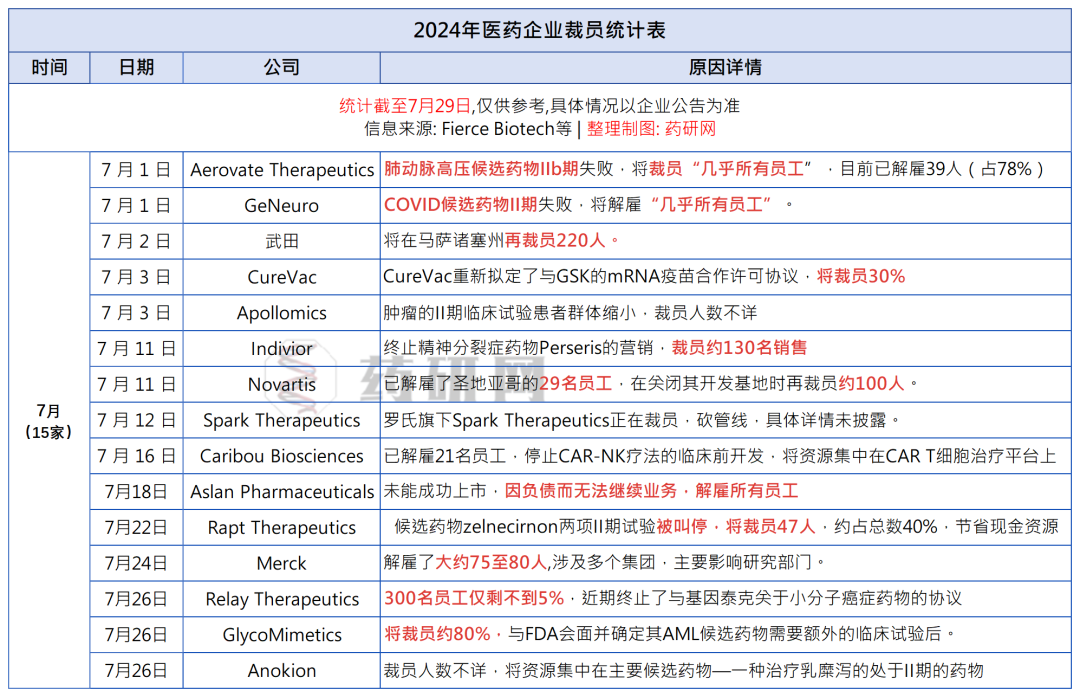
展览现场,闫欣悦:重游,胶囊上海;由凌卫政拍摄
Installation View, Yan Xinyue: Revisit, Capsule Shanghai, Shanghai, China; Photographed by Ling Weizheng
闫欣悦的个展“重游”当前在胶囊上海展出,将持续至2024年8月10日。
Yan Xinyue: Revisit is on view at Capsule Shanghai until August 10, 2024.
“风景一旦确立之后,其起源就被忘却了。这个风景从一开始便仿佛像是存在于外部的客观之物似的。其实,毋宁说这个客观之物是在风景之中确立起来的。主观或者自我亦然。主观(主体)、客观(客体)这一认识论的场也是确立在风景之上的。就是说,并不是一开始就存在着的,而是在风景中派生出来的。”柄谷行人曾在《风景之发现》中分析了从保罗·瓦勒伊(Paul Valery)到弗洛伊德等众多人物对绘画中“风景”的见解,试图反观艺术与文学中“风景”究竟如何体现出创作者的主体性。而在他看来“只有在对周围外部的东西没有关心的‘内在的人’(inner man)那里,风景才能得以发现。风景乃是被无视‘外部’的人发现的。”
展览现场,闫欣悦:重游,胶囊上海;由凌卫政拍摄
Installation View, Yan Xinyue: Revisit, Capsule Shanghai, Shanghai, China; Photographed by Ling Weizheng
闫欣悦的最新个展“重游”呈现了许多“风景”,但那并非简单的山川草木,而是城市生活中极为日常的片段。与过往的创作相比,艺术家从关注在“画什么”逐步转向着重于“怎么画”。这与其过往人生经历中不断迁徙的经历有关,身处于陌生场域,既有的身体习惯未必能够及时适应新的环境,在场域的裹挟下,一种意识上的转化过程开始出现,伴随而来的更是心理层面的投射。闫欣悦选择了以超乎预期的场景与看似渺小而平静的人物相对应,在莫奈、蒙克等印象派艺术家原作中那无法忽视的笔触的影响下,她也在以绘画转化自我心情的过程中,得以让风景承载自己的情绪。作为一个身处于当下的艺术家,她自然地将自己所见所闻的事物入画,以内在的驱动力去破除过往既定的方式方法,在回顾般的“重游”中实现了新的建构。
贺潇
×
闫欣悦
贺潇(以下简称“贺”):当我看到“重游”这个展览标题的时候,我即刻联想到了熟悉与陌生的并存。或许“重游”任何一个我们曾经到访过或居住过的地方,都会带来一种错乱但同时很有吸引力的感受,甚至是一种疏离的归属感。这是你为此次展览设定的感知范畴么?
闫欣悦(以下简称“闫”):这个展览的确是从情感或者抒情的角度去出发的,它像一首回顾自身经历,有许多内心波澜的诗。我最近在看很多德国表现主义绘画,想尝试通过情感来共情观者。我之前的绘画可能很多时候关注在“画什么”,以至于冷落了绘画中的情感传达。现在在创作上,我会更侧重于“怎么画”。例如,绘画过程中,笔和画面产生的触碰是如何传达情绪的,它们之间的撕扯,力量的转变,会产生什么意外的效果。有时候我画画更像去“写”一笔书法,这样的探索充满乐趣。回到展览的主题,我选择了“归属感”的纠结情绪作为出发点,展览标题“重游”也是一个很emo的词。
贺:你曾去欧洲留学,又移居上海,再搬去L.A.,在迁徙的过程中想必也经常往返你成长的城市广州。每次离开和归来都是某种程度上的“重游”,哪些具体的场景会触发既熟悉又陌生的感受?你怎样把现实生活中具体的情景带入到你的作品中?
闫:你提到的“陌生感“对我来说更多表现为“疏离感”。我相信在国内总有一群年轻人,他们在很多地方生活过,却很难在一个地方定居,无论是生活在国内或者国外,他们总在计划下一个搬移的城市,或者长期游离于多个国家之间,为自己设定了漂泊的生活方式。还有很大程度上是,在全球化下这群中国年轻人会更吃力地去寻找自己的精神归宿。这样游离的状态无时无刻不流露在我的作品里。
Yan Xinyue 闫欣悦 | Him and his landscape 他和他的风景 | 2024 | oil on linen 亚麻布面油画 | 165 x 126 cm
贺:在《他和他的风景》和《她和她的风景#1》中呈现的独处的人物,带来了一种“疏离感”。而人与城市的母题常在绘画中被艺术家用一望无际的人群来表达,而非这两件作品中所表现的空无一人。或许这两件作品更多呈现了某种心理层面的“风景”?
闫:在《他和他的风景》和《她和她的风景#1》这系列作品里,画面呈现了个体和所处环境的矛盾。它是一个在独处的时光里与自我对话的状态,这也是我这几年搬到美国的一贯状态。我在标题中用了“风景”一词,更多是为了表达一种心理层面的投射。画中人物的渺小和平静,与包围他/她的笔触快速多变的风景形成对比。它是一个心理上拟造的风景,折射着画中人物的精神孤独和挣扎,所以画面大部分的情感处理都发生在了风景里。
贺:这两件作品中人物与环境的比例关系似乎也拓宽了这种空旷的感受,虽然它们在尺幅上不算庞大,但在比例上的拉伸可能更强调了这种空旷感,这是一种你认为比较有效的构图方式吗?
闫:在一个空大的场景里画一些微小人物融入其中,好像也不算是什么关于人和环境的新颖绘画手法,在画这两幅作品的过程中,我想到了中国古代文人画的构图——布满眼帘的风景包含着简单动态的微小人物。我想到我们背诵过的古诗,其中的抒情以及人在这种环境中的渺小和无奈。
Yan Xinyue 闫欣悦 | Her with her landscape#1 她和她的风景#1 | 2024 | oil on linen 亚麻布面油画 | Two panels in 145 x 45 cm and 80 x 45 cm(双联画)
贺:《她和她的风景#1》的下部对画框做了特殊蜿蜒的处理,有一点从天入地的感受。画框的形式背后是否有具体的指向?
闫:最初是为了打破画挂到墙上的单一呈现方式,弧形画框是一个从墙面到地面的延伸,有点像展开的中国古画卷轴,它有意迎入观者,将观看的时间拉长。直立高悬的画面让人仰望。巴黎橘园美术馆里的大型莫奈睡莲给我带来了很大的震撼,主要惊叹于如何被他的笔触所包围,让人无法抽离。这一幅《她和她的风景#1》的飞扫的大笔触很大程度上参考了莫奈的画法,颜料之间的交叉涂抹扩张成了整个黑夜。这幅作品并不是一张理性计划过的作品,它充满了很多释放和发泄,有一种快速涂抹的力量。
Wang Ximeng 王希孟, A Thousand Li of Rivers and Mountains 千里江山图, 1113 北宋政和三年, Handscroll, ink and color on silk 卷轴绢本设色, 51.5 x 1191.5 cm, Palace Museum, Beijing, China 故宫博物院,中国北京

Claude Monet 克劳德·莫奈, Musée de l'Orangerie 橘园美术馆, Paris, France 法国巴黎
贺:从近期的绘画中不难发现一些印象派画家处理画面的方式,例如《等待》中停机楼前面夕阳洒在地面的处理会让我想起爱德华·蒙克(Edvard Munch)的《夏夜之谜》(The Mystery of a Summer Night)。同时色彩的运用也似乎强化了等待这一动作背后的情感。
闫:《等待》这幅画其实是参考了莫奈的作品——《印象.日出》,约翰·伯格在写到莫奈的作品时提到《印象.日出》这幅画是忧郁的,充满了一种无家可归的形象。当我在这幅作品停留许久时,眼前竟是一片机场,斑斓的夕阳下,漂浮的大地和水般的光影错综交织,奔波的一日后,旅人终于准备在登机后就着落日闭眼小憩,缓解一日的疲惫,等待着下一个到达的地点。蒙克的风景作品对我的影响也贯穿了我整个展览,他作品里的果敢和自由是我所追求的。
Claude Monet 克劳德·莫奈, Impression, Sunrise 印象·日出, 1872, oil on canvas 布面油画, 48 x 63 cm, Musée Marmottan Monet 玛摩丹美术馆, Paris, France 法国巴黎

Edvard Munch 爱德华·蒙克, Beach 沙滩, 1904, oil on canvas 布面油画, 81 x 109.5 cm, Munch Museum 蒙克美术馆, Oslo, Norway 挪威奥斯陆
贺:这次展览的作品中出现了很多未经处理过的亚麻布,留白让色彩与画布的关系更为突出。
闫:在没有石膏底料的亚麻布上画画会把颜色的纯度降低,但却某种程度上收住了每个颜色之间的冲撞。也许这也使得画面产生某种生涩感,却和我这次展览的主题还挺贴切。我经常将亚麻布留空,或者画些颜色透明的笔触在刻画的地方和空白处过渡一下,使得薄薄的颜色和麻布的粗糙纹理形成对比,挑战着画面的完成度。有句形容绘画过程的话:“每一笔可能是机会,每一笔也可能是毁灭”,对我来说利落的笔触,颜色的透明和亚麻布的完美结合是非常珍贵的,在这过程中我会把感知力开启到最大去寻找这一瞬间。
贺:除了留白,《悠闲的下午和“昼颜”》吸引我的地方是你采用的嵌套式的观看方式。它在画面中呈现了一个人看电视的情景,从而提示了观看者的存在。同时,《昼颜》这部日剧隐喻了某种从现实中的逃离。你通过这种方式放大了内外两个层面的感受。这是否也是一种你可能后面会尝试的方式?
闫:我很喜欢嵌套式这个词,对我来说这样的逻辑是“画中画”。其实我之前就有几张类似视角的作品,这样的尝试也会一直沿用——它允许我在一个画面里以不同的绘画方法去画。有些插入了来自现实中的图片,迎合了我对现实的态度,这一部分的处理必须要具有被识别的可能才会为作品带来意义,所以绘画处理上要相对写实一点。而画面别处可以以一个不被计划的方式去探索。我设想以悬殊的绘画力量,不同层次的绘画视角去创作,能让观众因此在我的画面前驻足更久一些哈哈。回到这幅画里,电视里的夕阳的橘色流淌到了现实生活中,幻想和现实中的美妙混为一体,但是我又通过爆米花和吃过的水果刻意地把自己的绘画角度拉回到了旁观者,使得画面里浪漫的情愫就此被打断。这样情感上的收缩处理也是我一贯会在作品里用到的。
Yan Xinyue 闫欣悦 | Peaceful Afternoon & Hirugao: Love Affairs in the Afternoon 悠闲的下午和”昼颜” | 2024 | oil on linen 亚麻布面油画 | 48 x 61 cm; 51 x 65 cm (framed 带框)

Film Still 剧照, Hirugao: Love Affairs in the Afternoon 昼颜, 2017, Directed by Hiroshi Nishitani 由西谷弘执导
贺:虽然人群不是你勾勒的主体,但经常可以看到各式各样的动物,例如灵缇、黑狗和鹦鹉。它们是否也扮演了某种心理角色?
闫:我的作品很多时候从一个更私隐、更孤立的角度在讨论个体和社会集体之间的矛盾,所以确实在我的画面里不常看到人群。画动物对我来说是一件很愉悦的事情。我最近很喜欢看八大山人的画,我非常崇拜他作品里对动物的灵动捕捉。我也会去尝试模仿他的下笔果断和一气呵成的魄力。《笼中鸟》这幅画就是带入了很多这样绘画性的东西,推开一块大笔触已经构成了一只鸟的身体,也许它是虚无的,也许它是被刻画的。我的画面里以不同的绘画方式去画重复的东西,这样画很过瘾,有时候画完一个意犹未尽,可以再以新的方式画画。绘画过程里可能产生意想不到的幽默,我有时候画着画着会笑出来。

Bada Shanren (Zhu Da) 八大山人(朱耷), Bird 鸟, 1627 – 1705
贺:艺术家常在作品中用带有隐喻的方式描绘自己,在自我观照中探寻新的方向,你认为这次个展中是否有哪一件作品可以看做某种状态下的自画像?
闫:其实展览里面有一副我的自画像,我发现以往的画家们在不同的阶段都给自己画一副幅自画像,我也给自己画了一张。实际上我之前很惧怕画自己,这次有这种冲动我也是很意外哈哈。绘画的中途我纠结了好久,参考了好多大师们的作品,连戈雅的画册都翻了好几遍,所以这幅自画像充满了在时间里挣扎的情绪(背景就重涂了好几遍),也可以把它看做一件“写生”。
Yan Xinyue 闫欣悦 | Gaze 凝视 | 2024 | oil on linen 亚麻布面油画 | 150 x 120 cm
贺:你在色彩上似乎有意选用了一些“当代”流行的颜色。例如《无题》中的蒂芙尼蓝,灵缇用了婴儿粉,鹦鹉羽毛更具有五颜六色的“时尚感”。
闫:对,在我的画面里,我非常在意一个颜色是怎么跟另外一个颜色相处的。寻觅颜色之间的碰撞和刺激是我绘画过程中的一大乐趣。有时候我的创作是从草稿里简单搭配的色块一步一步发展成叙事的具象。一片充满力量的色块所带来的震撼甚至可以压盖复杂繁琐的刻画。我现在的作品也在倾向于多把颜色的直觉性放大,让它更多地去体现绘画本身的语言。
贺:我还注意到了《自爱时光#3》由两张小的画框去组成了一张作品的方式。这个物理层面的断裂挺妙的,因为你完全可以用一个长的画框来承载画面,这个人物在网上冲着浪,但在现实中又很孤独地做着美容,断裂的空隙瞬间让人感受到了人物境遇的惨淡。而且这个横幅的形式也会让人想到国画里面的卷轴被打开的样貌。
闫:是的,本身这幅画就是留白较多的,它没有过多的情绪,诡异的红光面具和安静的小狗之外更多的是休憩的闲散,但由于是两幅画框拼贴而成,中间的缝隙意外赋予作品一种孤独感和残缺感,现在想想还挺有意思的。
Yan Xinyue 闫欣悦 | Self care #3 自爱时光#3 | 2024 | oil on linen 亚麻布面油画 | 27 x 81.5 cm; 29 x 83 cm (framed 带框)
贺:你觉得移居L.A.之后,会放大自己对文化背景的意识么?你对流动的身份和不停变化的“归属感”是否有了新的认识?
闫:曾经在欧洲读书的时候,我的确会纠结自己的文化背景和作品之间的关系。现在我更倾向于让创作内容自然而然地发生,这样可以允许我在绘画里有足够的自由去探索。我认为只要保持自我的对话,就不需要刻意去定义自己的文化背景,因为一切关于自己的东西(自己的文化背景,经历)已经自然而然地流露到作品里了。关于文化上,我更倾向去探讨这种游离于不同身份文化之间的状态以及所面临的碰壁或是所得到的更包容的视角和智慧,不强迫自己特意去融入新的文化,也不强迫自己一定要履行原本属于的文化,一切都是为自己选择的,自洽的,从“我”出发。在这个展览里,我画了让我十分上头的日剧场景,还有去年过世的我非常崇拜的华人歌手李玟,这些来自日常里的触动对我是真切的。我觉得这应该算是我表达自己文化处境和归属感的一种方式吧。
Coco Lee performing at the Academy Awards ceremony for Ang Lee's film Crouching Tiger, Hidden Dragon, 李玟在奥斯卡颁奖典礼为李安的电影《卧虎藏龙》表演, 2001
关于艺术家 ABOUT THE ARTIST

闫欣悦(1992年出生于黑龙江,成长在广东)目前常驻于上海与洛杉矶之间。她于2018年取得⽐利时安特卫普皇家美术学院(Royal Academy of Fine Art Antwerp)绘画专业的硕⼠学位。闫欣悦的作品关注着飞速发展的城市化下的人群和他们的状态。她习惯以戏剧化的形式来表达⽇常城市⽣活。闫欣悦的绘画⾥交织着不同的空间层次和⼒量,她⽆意将她的绘画置于明确的叙事⾥,⽽是邀请观者去解读,进⼊⼀个更开放的想象空间。闫欣悦坚持对绘画本身的可能性的探索,同时她的画⾯总以戏谑的态度使观者在严肃的当下现实中挣脱开来,在令⼈沉思的语境下寻找⼀丝玩趣。
闫欣悦的个人和双人展览包括"重游“,胶囊上海,上海(2024);"A Prayer for the Sunset",Sans Titre,巴黎(2023);"To look Is to Eat",Jack Barrett Gallery,纽约(2023);"夏日迷雾",胶囊上海,上海(2020)。群展包括在C L E A R I N G,洛杉矶(2024);Public Gallery,伦敦(2023);Harper's,洛杉矶(2023);Sans Titre,巴黎(2022);Current Plans,香港(2021);胶囊上海,上海(2019);A+亚洲当代艺术空间,上海(2019);De Brakke Grond弗拉芒文化中⼼,阿姆斯特丹(2018)等。
Yan Xinyue (b.1992) is a Chinese artist who's currently based between Shanghai and Los Angeles. She graduated from the Royal Academy of Fine Art Antwerp (Belgium) with an MFA in painting in 2018. Yan's work portrays the tension in everyday life in the context of rapid urban development. She manipulates objects and subjects into different painterly forms – reality and fantasy are mixed on the same canvas, and the dynamic and the tranquil are blended – revealing the conflict between being a part of society and being an individual. The irony and humor in her paintings invite viewers to escape the solemnity of reality and enter a universe of imagination and possibilities.
Yan Xinyue's solo and two-person exhibitions include Revisit, Capsule Shanghai, Shanghai (2024); A Prayer for the Sunset, Sans Titre, Paris (2023); To look Is to Eat, Jack Barrett Gallery, New York (2023); Summer Mist, Capsule Shanghai, Shanghai (2020). Her work has also been shown in group exhibitions at C L E A R I N G, Los Angeles (2024); Public Gallery, London (2023); Harper's, Los Angeles (2023); Sans Titre, Paris (2022); Current Plans, Hong Kong (2021); Capsule Shanghai, Shanghai (2019); A+ Contemporary, Shanghai (2019); De Brakke Grond – Flemish Cultural Center Amsterdam (2018), among others.
©文章版权归属原创作者,如有侵权请后台联系删除