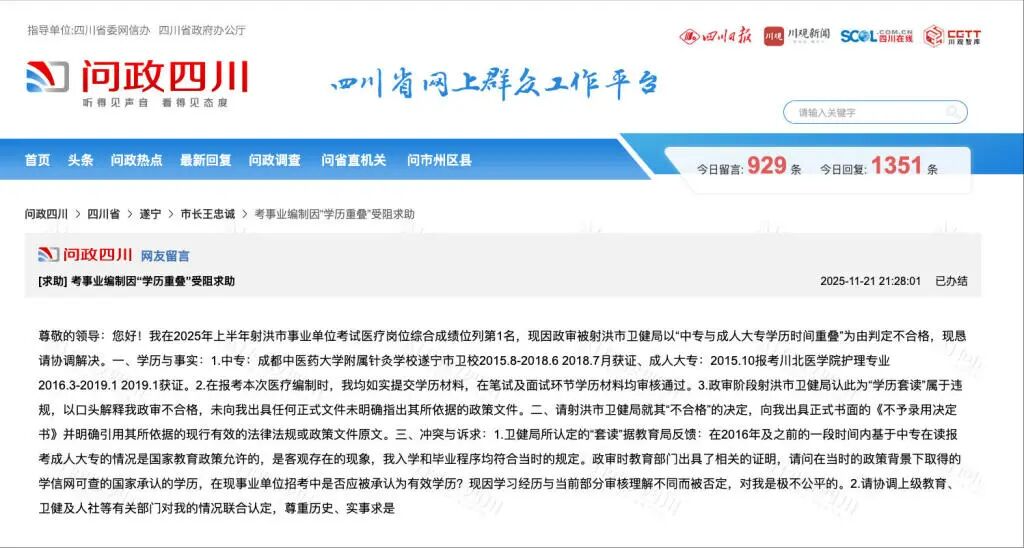
蒲英玮身上有很多人的影子。他善于学习,也长于伪装,像是有能力成为任何人的好朋友,包括成为敌人的好朋友。但今天,我之所以想要写他,不仅因为这些表面功夫,还因为一种有待辨认的野心——他把它遮掩一半,又刻意显露另一半,以及所有那些同样有待辨认的模棱两可。有时候,他似乎走得离艺术太远了,可当别人以为这只是把艺术当作跳板时,他又总会重新回到艺术中来。对蒲英玮来说,艺术不是一条艺术生的退路,艺术有它自身的意义。其实没有人能说清楚这里的“艺术”究竟是什么,只有一点明确,它不是评判高下的所谓“金线”,却始终是一道界河,一道兼顾物理和象征意义的边界,用来区分艺术家和其他人。
去蒲英玮的新工作室之前,我看过一些拍他上一个工作室的照片,印象最深的有两个场景:一个是不大的工作台,上面板正地摆放着三两本中国知名的非营利艺术机构泰康空间主编的出版物,其中有一本书名叫《白求恩:英雄与摄影的成长》,既本土又国际,既革命又浪漫;另一个是穿时装的年轻黑人模特坐像,来自于他与时尚厂牌合作的特别拍摄。
两张照片几乎取自同一角度,所有东西都挤在狭小的空间里,有很多被迫的重叠,必定又经过有意识的布置。正因为这种重叠,你很难区分哪些是工作的日常,哪些是为了他人眼光而摆放的展示。于是我想象,他在更宽敞的工作室里又会怎样安排:哪些部分是对外的舞台,哪些部分是他真正的后台?但我很快发现,如此的提问方式在蒲英玮身上显得过于简单化了。他更像是辩证法的秘密门徒,总能在模棱两可之中游走,混淆舞台与后台。你完全可以说这个由直播间改造而成、带着隔间布局的新空间处处都为展示而设,也可以说这恰恰反映了他真实的工作方式,只不过新的空间更有条件去适配它。
从研究生毕业到现在,蒲英玮做了太多事,以至于不易发现能够反映他工作肌理的核心线索,但这其实是一种错觉,只是因为他对某些清晰的部分从不声张。2018年,深圳OCAT出版了他的艺术家书《群岛》(Archipelago)。这是本小册子,在质感上却硬得像块小方砖,其收录的多则“小故事”已清楚表明了他如何理解艺术与政治的关系:艺术不是孤立的形式,而与革命、教育、科学甚至日常生活的激进转变相互交织。《群岛》中的自述和引用,构成了一以贯之的立场——艺术即一种乌托邦性的介入。因为在艺术的范畴内,某些面向政治的想象性实践反而拥有最高自由度,也是他自我判断有能力触及和处理的对象。
▲ 蒲英玮,《群岛》,2018
由OCAT深圳出版,展览“小说艺术”委任创作
2021年,蒲英玮在尚未正式开馆的星美术馆实施了个人项目“晦涩历险——思辨波普与泛中主义”,将他本人的创作与星馆创始人何炬星的中国当代艺术收藏并置展出。所涵盖的艺术家包括李山(b.1942)、余友涵(1943—2023)、舒群(b.1955)、陈箴(1955—2000)、毛旭辉(b.1956)、王广义(b.1957)、顾德新(b.1962)、刘小东(b.1963)与吴山专(b.1963)。
除此之外,展览还出现了两件与何氏收藏并无直接关系的作品——《父亲草图,或视觉政治序言》和《临摹潘玉良〈黑人男子〉》。它们分别挪用了罗中立(b.1948)和潘玉良(1899—1977)的绘画,用以“补充”中国当代艺术发生的前夜,以及中国现代艺术与全球身份政治初次遭遇的历史时刻。这不是蒲英玮第一次以展览的方式自我“历史化”。他熟悉那些历史的坐标,也擅长采取策展人的视角,把自己和经过挑选的历史时间重新组织在一起。
▲
左:蒲英玮,《帝国字体〈红色与其之间的微妙差别〉》,布面油画、丙烯、油漆,200×120cm,2021
中:蒲英玮,《新政》,布面油画、丙烯,200×200cm,2021
右:吴山专,《三十二个错别字:第3/3次》,200×120cm,1995
“晦涩历险:思辨波谱与泛中主义”展览现场©星美术馆馆藏
在同一面展墙上,布面油画《帝国字体〈红色与其之间的微妙差别〉》(2021)和《新政》(2021)与吴山专的《三十二个错别字:第3/3次》并列展出,构成了类似中世纪三联祭坛画的效果,有中心,也有边缘。
和徐冰的“天书”系列不同,吴山专的“伪字”系列所调动的是人们的完形心理。前者强调阅读的徒劳感及其背后的文化政治,后者则将目光放在与社会和教育有关的日常经验上。这些错别字来自课堂、手写习惯、印刷甚至口语的影响,显现了知识传播与灌输过程中的失误空间。从字形上看,它们并非完全不可读,而是处在可读与不可读之间,激发出人们一种想要纠正的冲动,例如缺一竖的“圳”,或形似“忍”的错误异体。
▲“帝国字体”字⺟表在排版中的应⽤
关键词⽬录系统©《蒲英玮:关于红的⼀切》
相较于这种基于汉字的“错读”,蒲英玮的帝国字体把问题转移到另一种与全球化更加紧密的字母系统上,同时也利用了“错读”产生的空间。他的设计本质仍然是26个拉丁字母,但大量借用了俄语西里尔字母形象,以制造形象与意义的偏移。例如A是Д(/d/)的变体,X对应Ж(/ʐ/)。其中一个特例是字母H,它的大部分“部件”似乎更接近仅在早期使用过的西里尔字母Ψ,却不仅翻转了方向,还多了两条真正用以指代H的竖杠,因而成为整个系统里辨识度最低的一个。这些字母保持着从A到Z的序列,却在视觉和文化意义的层面制造出陌生感。不过,蒲英玮不是在语言内部寻找“错误”和不可读,而是通过字母的跨语际挪用去指向更宏大的历史语境。有时候,他也称这套字体为“革命现实主义字体”,更直接体现出里面的历史化所指。
从文字的形变转向政治术语的再造,蒲英玮在《新政》中再次采用了类似的偏移策略。《新政》尺幅最大,悬挂在《帝国字体》和《错别字》之间。画面中最醒目的元素,是各国共产党共享的符号——锤子和镰刀。它们恰好构成了字母Ψ的形状。如果从这一点回头检视,会发现帝国字体中至少有五个字母(C、H、T、W、Y)呈现出类似的变形,从而在结果上不仅形成了一种字体内部的对话,也隐约构成了对近世政治史的回应。
20世纪以来,“新政”几乎成了现代国家反复借用的政治术语:列宁的“新经济政策”(NEP)、罗斯福的“新政”(New Deal)、邓小平的改革开放、撒切尔夫人与里根的新自由主义改革,以及在巴西、墨西哥等第三世界国家以“新政”的名义开展的各类试验。蒲英玮显然希望将自己的《新政》安置在这条全球政治的谱系之中。然而,正如他创造的帝国字体——一种既保持字母序列稳定,又映射帝国史影子的“超级符号”——他总会让表达在某些时刻变得格外清晰,却又在另外的一些时刻虚化原本的焦点。
▲ 蒲英玮,《中国资本1978》,布面油画、签字笔,70×100cm,2019
▲ 亚历山大·科索拉波夫,《世纪的象征》,石版画,55.88×76.2cm,1982
“晦涩历险”所选的李山、舒群、余友涵、王广义在20世纪80年代都明显受到过波普艺术的影响,其源头既可能来自当时来过中国的劳森伯格、安迪·沃霍尔,也可能与苏联艺术,或更准确地说,与在美国复兴的苏联Sots艺术有关。将社会主义与消费主义的“超级符号”并置,并非这一代中国艺术家的独创。在亚历山大·科索拉波夫(Alexander Kosolapov)的石版画《世纪的象征》(Symbols of the Century, 1982)中,列宁头像与可口可乐商标的蒙太奇已然出现。画面上还附有一句广告语:“货真价实。”(It’s the real thing.)。句子的下方标注有列宁的名字,仿佛这句话出自他之口。然而,这并非列宁所说,而是可口可乐公司在20世纪40年代提出、并于70年代重新流行的广告语,此处属于张冠李戴。
符号拼贴的震惊效果和政治动员力,早在20世纪上半叶约翰·哈特菲尔德(John Heartfield)的拼贴摄影和苏联的蒙太奇电影(爱森斯坦、库里肖夫、特列季亚科夫)中就已充分展现。正如哈特菲尔德的艺术伙伴和政治盟友乔治·格罗兹(George Grosz)所说:“我们在纸板上粘贴了疝气带、学生歌本和狗粮广告的大杂烩,以及烈酒和葡萄酒瓶上的标签,还有从图片报纸上随意剪下的照片,目的是用图像说出那些如果我们用语言表达就会被审查员禁止的内容。”[1] 某种意义上,后来的波普艺术,乃至“政治波普”沿用的正是这些策略,只是弱化了其中的政治属性,更贴合战后消费主义盛行的时代精神。
事实上,作为波普艺术的集大成者,沃霍尔的密钥并不在于对社会表象的反映,而在于他所常用的复制技术本身的悖论逻辑。他曾说:“我想成为一台机器。”(I want to be a machine.)也曾说:“每个人都应该成为一台机器。”(Everybody should be a machine.)但有所误差和损耗的复制技术,如丝网印刷,也包括类似《两百个金宝汤罐头》(Two Hundred Campbell's Soup Cans, 1962)一类的手绘式重复,却让图像在貌似完全相同的重复中暗藏差异,[2] 而这种差异也正是奢侈与稀缺的定义中必要的部分,也因此和消费、时尚的逻辑紧密关联。蒲英玮大约深谙这种深层的波普精神,所以并不担心将自己的作品与成功前辈并置所带来的争议。或者这么说,向他人“借力”的争议也可以成为一种资源,前提是艺术家能有所分寸地把握与前辈之间轻微的偏移与差异。分寸若过,则显得老套,像彻底目盲的堂吉诃德;若不及,又只是拙劣的模仿。
仍以《帝国字体〈红色与其之间的微妙差别〉》《新政》和《三十二个错别字:第3/3次》三联画为例,蒲英玮始终让作品在概括并对话历史的同时,与历史保持距离,而不陷入偏向事件性的上下文。在吴山专的《三十二个错别字》里,我们仍能看到与“文革”这类历史事件直接的对应关系,但在蒲英玮的创作中,这样的指向几乎不存在。
与他私下交谈时,你会发现他的判断可以非常清晰而尖锐。从政治思想人物到当红艺术家,他都能施以冷静的描述与评判,不论是温铁军、汪晖,还是西格玛·波尔克、格哈德·里希特。这样的参照系本身已暗示某种品位与倾向。
相比之下,他的作品却从不显露这种锋利——模棱两可是必要的。正因如此,他既能“借力”于思想与艺术的政治性,又能避免作品过早被锁定在某个标签之下。而如果说在知识层面上有所参照,这些作品并未依循单一的历史、政治或艺术史路径,而是广泛调用了中国本土的批判性知识资源与欧洲的现代经验,把它们铺展在同一张“图集”(atlas)之上,再将其中的清晰与确切,转译为复杂的“图像”(Bild)与话语的蒙太奇,从而孕育出一张张多元变异的新“图集”。
在波普艺术的语境中,被挪用的“超级符号”往往依赖其可辨识度而发挥作用。换句话说,图像能否被迅速识别,直接决定了表达的有效性。对波普来说,模棱两可是表意的敌人。而在中国的“政治波普”中,无论是李山、余友涵,还是年龄稍小的王广义,也都以此为前提:观者必须首先辨认出符号,然后才能进入作品所引导的批评语境。
与此类似,社会主义现实主义也强调视觉的确定性,正面人物、明确主题、典型环境——以确保无歧义的观看路径,这也是中国社会主义革命与建设时期的政治宣传画和波普之间天然的联系。然而,蒲英玮却在绘画中引入多层次拼贴、字体、层状覆盖等混杂语言,刻意制造模糊。观者既会因革命图像的残影而产生似曾相识的感觉,又会因殖民、资本、全球化符号的插入而不断中断对它们的理解,从而在噪音中失去那种曾经明确的历史方向感。但与此同时,他仍然保留了这一类图像本身携带的信仰冲力,因为他要利用这种冲力及其背后的激情。
▲ 蒲英玮,《我想要现代》,布面油画、纸本拼贴、邮票、丝网印刷、金银箔、马克笔、油漆笔、喷漆、矿物颜料、色粉、油画棒,200×200cm×5,2021
这种做法使蒲英玮的“波普”超越了大多数同代艺术家的策略,更接近罗兰·巴特在《符号帝国》中提出的符号观:不执着于中心与解释,而是拥抱空无、差异与开放性。蒲英玮显然意识到“超级符号”的识别度之利,例如李桦的抗战版画《怒吼吧!中国》,但他的兴趣并不在于借此复原原始语境,而是让这些符号化为一种带有历史气息的指引:观者进入一片大体可辨经纬与特征的森林,却找不到一条笔直的通路。
▲
左:蒲英玮,《我想要现代》局部图,2021
右上:李桦,《怒吼吧,中国》,1935
右下:胡一川,《到前线去》,1932
玛格丽塔·图皮岑(Margarita Tupitsyn)曾把Sots艺术家的核心策略概括为“社会主义转换”(Socialist conversion),因为“社会主义现实主义的视觉词汇过于僵化,以至于任何轻微的偏移都可能导致意义的根本改变”[3] 。蒲英玮的做法与之相似,他同样通过符号的偏移制造新的意义,但同时也在走钢丝。一方面,他知晓这些“超级符号”本身在表意层面的脆弱性;另一方面,他却又要借助它们来建构一种更为坚固和确切的东西。
这一点在他近年的展览中表现得尤为清晰。从“晦涩历险”到和美术馆的新个展“新世纪百科”(2024),我们可以看到蒲英玮如何持续通过偏移与转换推进创作的辩证法。比如在“世界图书馆”系列中,他制作了一千本陶瓷空心书——它们既有重量,又极易碎裂。这种质感的对比让作品中关于记忆与知识的隐喻更具触感。
▲ 蒲英玮,《半红半我》,布面油画、丙烯、纸本拼贴、丝网印刷、石墨、煤渣,300×200cm,2022—2024。原作曾于和美术馆个展“新世纪百科”的“第二章节:半红半我:当代中国的意志颜色”中展出。
在大多数情况下,图像是蒲英玮创作的深层基底。他的绘画探索尤其如此。在最新的一批作品中,他不断叠加又不断隐去“超级符号”,例如人格化了的五角星,或者在1950年代的中国有特殊意义的和平鸽,同时置入呼应诸如石涛、吴冠中、赵无极、朱德群等中国名家的笔触、线条与色彩区域(只不过是以波普艺术的语法开展的)。在画面中流动的纵深错觉之中,观者仿佛被引向某种历史的和视觉的记忆边缘,却又在关键时刻被打断,从而进入一种“诡异”(uncanny)的界域。在弗洛伊德的定义中,“诡异”的本质在于:它源自熟悉之物的一部分,但因长期被压抑与疏远,当它重新出现时,便带着令人不安的陌生感。[4]
这种“诡异”效果,在当代中国社会中的位置极其特殊。我们的日常生活中充斥着从革命年代复归或在革命年代经受改造的“超级符号”——主旋律文化、新国格与新国风、美育再启蒙等。人们对它们既熟悉又警惕,既认同又撇清。蒲英玮的艺术正是在这种社会心理的模棱两可中插入,制造冲击效果,使观众意识到自己早已处在一种被政治图像包围却不自知的处境。
在这一点上,他绝对属于同龄人中最敏感的那一类,也比多数人更清楚地知道,审美和艺术的政治属性本就是相互渗透的。本雅明所说的美学政治化和政治美学化或许并非非此即彼的关系,尽管它们所导向的意识形态截然相反。“诡异”的效果正是制造出一个介于宣传与反宣传之间的模糊地带:蒲英玮的绘画一方面呈现出幽灵般的政治冲力,另一方面又像是未来的预言星图。换句话说,它所指向的并不仅仅是遗产或废墟,也不是像1990年代文学界刮起的“再解读”乃至2010年代“社会学视野”的风潮那样,通过将历史对象文本化来开掘其意义在新语境下的潜力,而是在提示一种正在回归、却难以被命名的新意识形态。这使他的绘画在意识形态的回声与未竟的未来之间,保持了一种持续的张力。
与那些在“超级符号”的复归中如坐针毡或雀跃欢呼的知识人不同,蒲英玮似乎没有特别沉重的历史负担。尽管他常常用“时间、历史、我们”这样的字眼来描述自己的工作,但这些字眼的严肃性并不体现为立场的严格历史对应,而更多是一种灵活姿态。某种意义上,他的绘画可被看作强调诗学质地的策展。这一次,他没有依赖明显的叙事性元素来整合画面,而是转向对绘画自身技术逻辑的关注,例如优先的形式考虑和与叙事保持距离的场景编辑,这让他的绘画获得了超越图像的效果,或者说,一定程度上赋予绘画以绘画性。
▲ 蒲英玮,《岁寒四友》,布面油画、丙烯、纸本拼贴、丝网印刷、木刻版画、油画棒,60×40cm,2023—2024
自2020年以来,蒲英玮的作品,尤其是绘画,逐渐显现出更为风格化的特征。然而,观众往往很难准确记住某一件具体作品——他们更多记住的,只是那种总体上的感觉,这是人们对抽象画家的记忆方式。可辨识度在这里表现为一种气息而非细节,一旦观者受到引诱,进入了“可辨识”的领域,蒲英玮却又和他们玩起了捉迷藏。
从结果上来看,这种有意在意义的最终抵达处保持模棱两可的策略,有利也有弊。利处显而易见,因为模糊的确保留了一些左右逢源的可能性。弊端则要复杂得多。曾有一位艺术家同行说过,如果“小蒲”在2010年前后进入行业,可能会成为一个特别有意思的案例,并且会比现在得到更多展览机会(此处指的是国外美术馆展览,以及全球范围内重要的双年展、文献展)。言下之意是,他的出道和自我运营策略有些不合时宜。
现实情况是,蒲英玮生于1989年,又因语言学习和法国研究生学制的缘故,直到2018年才毕业。彼时西方世界针对中国当代艺术的风向已然转变。比他更早走向世界的中国同行,在2016年前后陆续作出了不同的选择:有人回归本土语境,有人坚持国际路线,也有人干脆退出。只有极少数人能够在本土性与国际化之间取得平衡,并在近年持续获得重要的展览机会与市场位置,但这种兼顾不是没有代价的。尤其是那些同时挑战新自由主义及其右翼民粹对手的历史议题(如社会主义现实主义),几乎完全失去了进入全球展览体系或市场的可能。
▲ Instagram里的蒲英玮。2025年9月,他的绘画《半红半我:资本论》由法国里昂当代艺术博物馆收藏,并且在群展“个人故事∕政治现实”中展出。
与此同时,近年来已有越来越多的新议题在南北方国家的艺术界同时获得讨论空间,例如人工智能与数据主权、“双碳”、数字货币与金融去中心化。或许正因它们带有某种技术“黑盒效应”,并在表层伦理上相对容易被理解,其背后的深层政治性往往被有意无意地忽略。与这些新议题相比,被贴上冷战“失败”印记的社会主义现实主义显得格外失语,而这恰恰是蒲英玮持续关注的核心。尽管他并非没有感受到同侪压力,也在最新的个人项目《红色计算机》中尝试使用人工智能技术来解决问题,但他的核心议题并未发生根本转移,仍旧是社会主义现实主义——或者更确切地说,是一个在历史上曾经出现、却与“社会主义现实主义”存在微妙差异的概念:“革命现实主义”。
作为一名以勤奋和注重策略著称的艺术家,蒲英玮不可能不了解这些“前辈”如何规划职业生涯,也清楚跻身他们行列的捷径。扪心而问,他肯定也有过“生不逢时”的不甘。但这种不甘并未将他推向急于求成的阵营,而是让他坚持循序渐进。从国外具有实验性的独立空间、少数有含金量的美术馆(如德累斯顿美术馆),到国内各种不限于展览的表达平台,如时尚杂志、官方电视台、中外合作的金融媒体等,他都有所挑选地参与其中。与差不多同时入行的中国艺术家相比,他的步伐确实显得偏快,而且步履不停,这在一定程度上掩盖了他在面对机会时的耐心。可以说,他走过的每一步都带着策略性的考量;也可以说,这是在中国当代艺术新的处境下,面对更少的选择,他所能做出的最优安排。
▲ 蒲英玮,参加CGTN(中国环球电视网)法语频道节目,2024
正如他在许多方面所表现的那样,蒲英玮往往能在关键环节展现出灵活性。“小蒲”最具争议之处,在于他的一切似乎都经过设计,显得过于圆滑和讨巧,缺少浑然天成的感觉。这正如足球界梅西与C罗、篮球界乔丹与科比的争论——人们常常只看到勤奋背后的技巧,却忽视了天赋与本能的作用。这里可以援引奥尔罕·帕慕克在《天真与感伤的小说家》中的区分:所谓“感伤”的创作者,往往清醒地意识到自己所处的传统和体制,因而带着反思与自觉去创作;而“天真”的创作者则更多依赖直觉与激情,不加修饰地流露创作欲望。从外界的眼光来看,蒲英玮似乎总是“感伤”的:他太过在意策略、历史参照和外部语境。但如果仅仅以此来定义他,就会遮蔽掉另一面——他在绘画中的冲动、在概念发明上的率性,以及对某种乌托邦理想的执着追求。毕竟,他是拿过约翰·莫尔绘画奖的“那一类”艺术家。在那些高度图像化的巨幅绘画里,他不可能完全忽视媒介与技术的挑战,只是在当前的情形下,他必须付出更多努力,不仅限于那些超越媒介、技术乃至于主题的方面,才能抵达十年前中国当代艺术可以抵达的位置。
也正是在这里,我们需要从策略过渡到欲望的维度来理解蒲英玮。策略塑造了他在现实处境中的行动方式,而欲望则揭示了他更深层的驱力。
艺术是少数对欲望给予宽容的行业,或者说,凡是对欲望给予宽容的地方,都可以成为艺术发生的场域,包括政治。所谓的“欲望”,并不能简单等同于对名利的渴求。若读过一些政治人物、企业家,或其他成功人士的传记,就会发现名利并非他们的首要追求。他们渴望的往往是别的东西:有些看起来高尚,有些则复杂难言。比如朱嘉汉在小说《里面的里面》中塑造的“台共”分子潘钦信。某种程度上,潘是个失败者,是逃兵,但他从未放弃信仰。即便被追兵吓破了胆,他依然选择坚持到底,并非因为信仰的牢不可破,而是多重复杂的缘由导致,其中就有欲望的痕迹,并且在具体的行动中表现得和高尚无关。
正因如此,名与利更像是一架梯子——用维特根斯坦的说法就是,登高或问题解决之后即可抛弃。这样的叙事当然带有成功神话的成分,难免有虚构的嫌疑。然而历史已证明,虚构的理念同样能成为推动人们行动的重要力量。蒲英玮毫不掩饰自己也在此之列,这使得他的创作在表现得矫饰的同时,又具有十足的政治性。我一度想用“赌国运”来形容他,就像一部分当代中国左翼知识人所表现的姿态,却最终放弃了,因为蒲英玮并非完全在“赌国运”。尽管他的目光始终注视中国的发展,并且懂得“借力”,也的确受惠于此,但从理念上,他的野心更多指向一种更为宏大的乌托邦理想。无论这种理想的真诚与否,它确实在他的作品主题选择与概念建构中发挥着强烈的指引和整合作用。
如果我们观察2016年以来“后特朗普时代”全球当代艺术的新趋势,就会发现有一支与众不同的强劲力量,比如斯拉夫人和鞑靼人(Slavs and Tatars,东欧与中亚)、法证建筑(Forensic Architecture,英国)、西蒙·德尼(Simon Denny,德国∕新西兰)和黑特·史德耶尔(Hito Steyerl,德国)。他们都将视觉艺术视为重塑政治主体的领域,企图通过“图像—权力—历史—未来”的重新缝合来应对当下政治现实中的极端化与碎片化。我无意评判这些主张的优劣或作品有效性,而是要指出其中存在一种区别于名与利,却仍可称之为“欲望”的动力。
从这个意义上说,蒲英玮无疑属于这一谱系。在这一点上,“小蒲”(2009级)颇像他在川美的学长鄢醒(2005级),两人都更关注全球语境,以及中国在这一语境下的历史与实时位置,而非仅仅局限在国内——早在十年前,鄢醒即有聚焦俄国前卫主义和苏联社会主义历史的《反抗美学》(2015)、《列宁在1918》(2013)等作品扣门。回到“小蒲”,无论是“思辨波普”“泛中主义”,还是“华文码头”,这些概念的发明都像“伪字”一样跻身更为广阔的既有语境,或者直接唤起历史记忆,而蒲英玮却始终点到为止。若要寻找它们的最终指向,或者说在总体上牵引着“小蒲”创作的线索,尽管尚不清晰,但最接近的说法或许正是,一种面向全球的新政治主体想象。
艺术是梯子吗?文章的最后再次回到这句话。蒲英玮不止一次和我说过,艺术只是他的手段,他有他的在乎,和更多超出一般认识的不在乎。这似乎已经做出了回答:是的,艺术是梯子。但就像沃霍尔的“我想成为一台机器”一样,对“小蒲”来说,“艺术是梯子”同样可以是一个很波普的回答。
▲ 蒲英玮,《艺术与国运》草图,纸本水彩、马克笔、胶带,12×20cm,2024
[1] George Grosz, quoted in Hans Richter, Dada: Kunst und Antikunst, Cologne: Dumont, 1963. English translation from Dawn Ades, Photomontage, N.Y.: Phaidon, 1976, p. 10. 转引自:Benjamin H. D. Buchloh, ‘Allegorical Procedures: Appropriation and Montage in Contemporary Art’, N.Y.: Artforum, Sept. 1982, p.43
[2] 这个充满辩证的观点受惠于哈尔·福斯特对沃霍尔的讨论。“这意味着沃霍尔的重复手法往往要么催生出趋同性,要么释放出差异性,而这两种效应都会侵蚀图像的本质特性。有时,这种效果还会字面意义上地遮蔽图像——当丝网油墨因网版反复使用逐渐稀薄,或在画布上施印不均形成墨渍斑驳时,这种遮蔽效应便尤为明显。”(This is to say that repetition in Warhol often either produces a sameness or releases a difference, and that both can be corrosive of the identity of the image. Sometimes, too, the effect is to obscure the image, literally, as the silk-screen ink thins with repeated use of the screen or blots with uneven application on the canvas.)具体参见:Hal Foster, The First Pop Age: Painting and Subjectivity in the Art of Hamilton, Lichtenstein, Warhol, Richter, and Ruscha, Princeton and Oxford: Princeton University Press, 2012, pp:130-131
[3] Margarita Tupitsyn, ‘Sots Art: The Russian Deconstructive Force’, Sots Art, The New Museum of Contemporary Art, 1987, p.7
[4] Sigmund Freud, ‘The Uncanny’, Translated by David McLintock with an Introduction by Hugh Haughton, The Uncanny, London: Penguin Books, 2003, p.152
©文章版权归属原创作者,如有侵权请后台联系