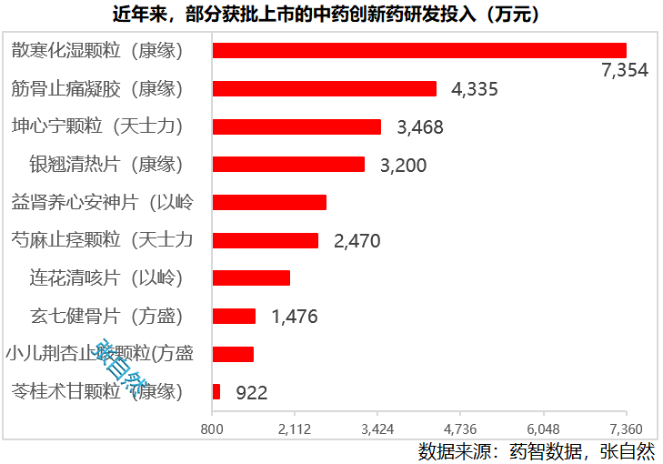
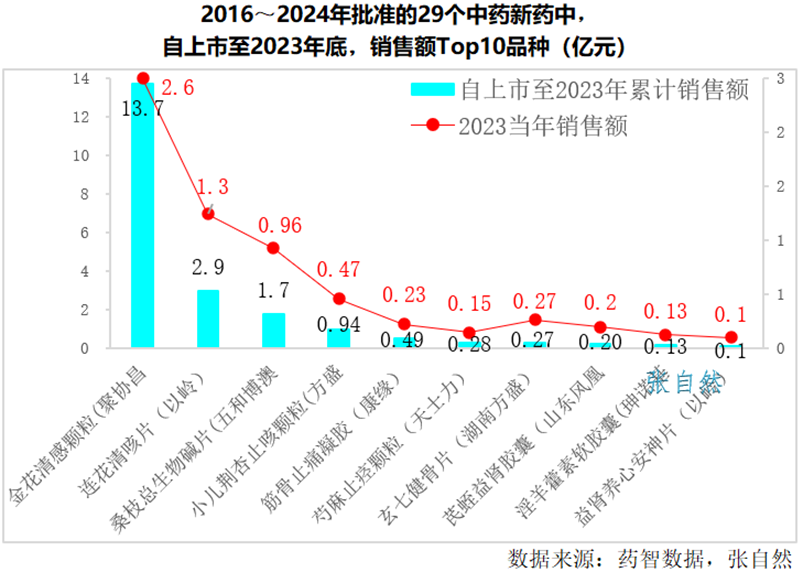
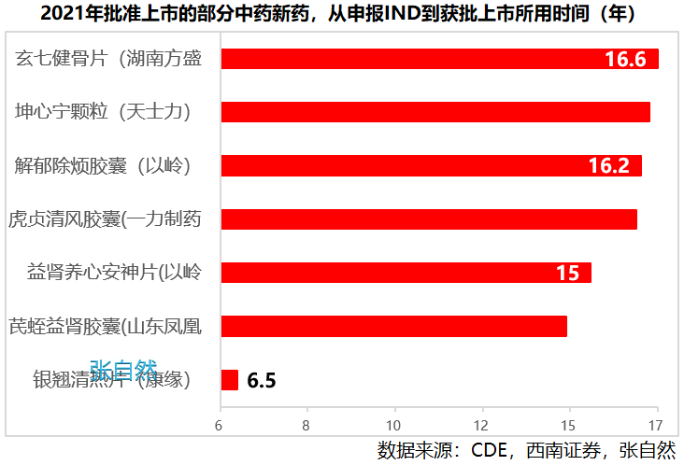
近日,阿斯利康公布了其高血压在研创新药Baxdrostat临床III期BaxHTN试验的阳性完整结果。结果显示:与安慰剂相比,难控制(未控制和难治性)高血压患者在标准降压疗法基础上接受Baxdrostat两种剂量(2毫克和1毫克)治疗12周时,平均坐位收缩压均出现具有统计学意义和临床意义的显著降低。
阿斯利康对Baxdrostat寄予厚望,在2024年研发日演示材料中,预测该药物年销售额峰值有望超过50亿美元(约合人民币357亿元)。
全新机制
Baxdrostat是一种高选择性、强效口服小分子醛固酮合成酶抑制剂(ASI),是阿斯利康收购CinCor Pharma所得。醛固酮合成酶由CYP11B2基因编码,负责肾上腺中醛固酮的合成。醛固酮是导致血压升高及心血管和肾脏风险增加的激素之一。
与传统RAAS通路阻断药物不同,Baxdrostat能够在不影响皮质醇水平的前提下有效降低醛固酮,展现出优越的靶向选择性,选择性是皮质醇合成酶的100倍以上。这意味着它能精准降低醛固酮水平,却不影响皮质醇的正常生理功能,而皮质醇紊乱往往是传统盐皮质激素受体阻断剂(如螺内酯)的常见副作用。
BaxHTN是一项多中心、随机、双盲、安慰剂对照、平行分组的III期研究,共纳入796例患者。结果显示:
在治疗第12周时,Baxdrostat 2毫克剂量组平均坐位收缩压较基线的绝对降幅为15.7mmHg,经安慰剂校正后的降幅为9.8mmHg。1毫克剂量组平均坐位收缩压的绝对降幅为14.5mmHg,经安慰剂校正后降幅为8.7mmHg。安慰剂组平均坐位收缩压下降5.8mmHg。上述结果在未控制和难治性高血压亚组中表现一致。Baxdrostat整体耐受性良好,未发现非预期的安全性事件。
此外,Baxdrostat也达到了所有确认性次要终点。其中,Baxdrostat 2毫克剂量组展现出了持久的长期降压效果。2毫克和1毫克剂量组均实现了更显著的舒张压降低,且患者收缩压<130mmHg的达标率较安慰剂组提升近三倍。
在一项预设的探索性亚组分析中,Baxdrostat相比安慰剂显著降低了患者24小时和夜间动态收缩压,这些都是持续控制血压和降低心血管风险的重要指标。
目前,该试验结果已在2025年欧洲心脏病学会年会公布,并同步发表于《新英格兰医学杂志》,这一学术背书进一步夯实了其临床价值。
阿斯利康对Baxdrostat的布局远不止高血压,目前该药正以单药疗法评估原发性醛固酮增多症(一种因醛固酮过量分泌导致的继发性高血压)的治疗效果,还在与达格列净联合探索慢性肾脏病合并高血压、高血压患者心力衰竭预防等适应症。这些适应症一旦成功,将进一步扩大药物的患者覆盖范围。
治疗困境
要理解Baxdrostat的市场潜力,首先要正视全球高血压治疗的“困境”。
高血压是一种以血压持续升高为特征的临床综合征,影响全球约13亿人。长期高血压会持续损伤血管、心脏、肾脏等重要器官,导致心梗、卒中、心衰、肾衰竭等严重并发症,而难控制高血压更是其中的“硬骨头”,即便患者坚持生活方式干预和多药联合治疗,血压仍难以达标。数据显示,美国约50%经过治疗的高血压患者仍未能实现血压控制。
在上述庞大患者基数的支撑下,高血压药物市场规模也已不可小觑。数据显示,2024年全球降压药市场规模已超300亿美元,国内降压药市场也超过600亿元。
现有降压药市场虽规模庞大,但药物类型多年来未有根本性革新,仍以β受体阻滞剂、CCB、ARB等传统药物为主。患者用药依从性低、达标率不足,成为临床一大痛点。
醛固酮作为调控血压的关键激素,通过促进钠水潴留机制升高血压,是难控制高血压的重要致病因素。
从生理机制来看,醛固酮是由人体肾上腺皮质球状带分泌的盐皮质激素,其核心功能是调控肾脏对钠离子的重吸收过程,进而维持机体水盐稳态。当醛固酮分泌过量时,会过度激活盐皮质激素受体,引发血浆容量增多,最终导致血压升高;同时,这种激素失衡也是造成高血压控制不佳、诱发难治性高血压的核心因素。
在治疗领域,醛固酮合成酶抑制剂展现出独特优势,它借助特异性抑制CYP11B2酶活性,阻断醛固酮的生物合成途径,从病因源头干预了难治性高血压的发生机制,属于与传统盐皮质激素受体阻断剂(如螺内酯)作用路径不同的创新治疗方案。
越来越多证据表明,醛固酮失调是高血压的关键生物学驱动因素之一,可导致患者心血管和肾脏风险升高。一项大型荟萃分析发现,收缩压每降低10mmHg可使主要心血管不良事件风险降低约20%。
除了Baxdrostat外,目前全球范围内进展较快的ASI抑制剂还包括Mineralys Therapeutics的Lorundrostat(已处于III期临床)、勃林格殷格翰的BI 690517(III期临床)等。Lorundrostat也在2025年3月公布了关键III期研究的数据,显示市场竞争正在加剧。
阿斯利康本次公布的BaxHTN III期临床数据不错,经过与安慰剂对比校正后,Baxdrostat能让收缩压降低近10mmHg。从临床效果来看,这样的降压幅度能明显降低心脏病发作、脑卒中、心力衰竭以及肾脏疾病的发病风险。
这些研究数据也清楚地说明,醛固酮在难治性高血压里的作用,实际上比以往学界认知的更为关键。也更进一步凸显了Baxdrostat创新作用机制的核心价值与潜在应用影响力。对于那些已接受多种治疗方案,却依旧难以将血压控制在理想范围的高血压患者而言,这款药可能会给他们带来新的治疗希望。
阿斯利康CVRM布局
仅次于肿瘤业务,心血管、肾脏和代谢(CVRM)是阿斯利康第二大业务板块。2024年CVRM板块收入125.17亿美元(同比增长20%),2025年上半年同比增长7%至65.12亿美元。
该业务板块主要由多个重磅炸弹药物贡献,包括支柱产品Farxiga(达格列净)、抗凝药Brilinta(替格瑞洛)、降脂药Crestor(瑞舒伐他汀),2025年上半年销售额分别为42.09亿美元(+13%)、5.2亿美元(-21%)、6.36亿美元(+10%)。
然而,阿斯利康CVRM领域也存在“隐忧”。
达格列净作为SGLT2抑制剂,最初用于糖尿病治疗,后拓展至心衰、慢性肾病等适应症,成为CVRM板块的“顶梁柱”。达格列净2025年上半年销售额达42.09亿美元(同比增加13%),占CVRM板块收入超60%,占公司总营收(280.45亿美元)的15%。
达格列净的制剂专利和晶型专利将在2027年至2029年到期,届时仿制药的冲击可能削弱达格列净的增长动能。因此,补全管线、减少单一产品依赖,成为阿斯利康近年来的核心战略。
近年来,阿斯利康明显加快实施“并购+引进”双轨策略,填补CVRM产品线。
2023年1月以18亿美元收购CinCor Pharma,拿下Baxdrostat;2023年11月以超18亿美元引进诚益生物的小分子GLP-1受体激动剂ECC5004(AZD5004);2024年先后引进心衰药物ION826、石药集团降脂药YS2302018、Quell Therapeutics的1型糖尿病细胞疗法QEL-0027;2025年3月又以1.6亿美元收购珐博进中国业务,获得肾性贫血药物罗沙司他的中国独家权利。
在并购的同时,阿斯利康也持续推进现有药物的适应症拓展,如达格列净从糖尿病延伸至心衰、慢性肾病,替格瑞洛、瑞舒伐他汀等传统药物也通过联合用药方案提升临床价值。
如今,在CVRM领域,除高血压外,阿斯利康涉及的方向还包括慢性心衰、慢性肾病、血脂异常、ATTR-CM(转甲状腺素蛋白淀粉样变性心肌病)、糖尿病、肝硬化等适应症,构建起“心-肾-代谢”协同治疗的生态。这种布局不仅能提升患者依从性,更能形成“管线护城河”,抵御单一药物专利到期的风险。
在阿斯利康2030年达成800亿美元收入的战略规划中,肿瘤业务虽依旧是营收核心支柱,但CVRM板块的增长潜力更显突出,备受关注。对CVRM板块的增长而言,Baxdrostat的推进节奏尤为关键。
若这款药物能在2026年顺利获批上市,且后续逐步将适应症拓展至心力衰竭、慢性肾病等领域,不仅能直接带动CVRM板块的业绩提升,更有望成为阿斯利康实现800亿美元营收目标的重要支撑力量。
结语
接下来,阿斯利康将在2026年推动Baxdrostat向多国提交注册申报,同时加速其在心衰、慢性肾病、原发性醛固酮增多症等适应症的临床开发。若这些进程顺利,Baxdrostat有望在未来成为阿斯利康CVRM领域的重磅药物。
来源:药智网
作者:小铃铛