
每一年的美国血液学会年会(ASH)都精彩纷呈,在刚刚结束的第64届ASH会议上,中国科学院大学附属肿瘤医院杨海燕教授团队的西达本胺联合方案治疗复发/难治性血管免疫母细胞性T细胞淋巴瘤(AITL)的研究成功入选,该方案表现出不俗的疗效和良好的耐受性,引起了血液学同行的广泛关注。
为此CCMTV血液频道特邀杨海燕教授为我们深入解读该项研究。



血管免疫母细胞性T细胞淋巴瘤 (AITL) 是外周 T 细胞淋巴瘤(PTCL) 的第二常见亚型,约占所有T细胞淋巴瘤19%。多数AITL患者确诊时已经进展到晚期,全身症状和免疫失调表现突出。目前,环磷酰胺、多柔比星、长春新碱和泼尼松 (CHOP)方案是最常见的一线化疗方案,其他化疗方案包括 CHOP-E(CHOP+依托泊苷加)、DA-EPOCH(依托泊苷、泼尼松、长春新碱、环磷酰胺和多柔比星)、Hyper-CVAD(环磷酰胺、长春新碱、多柔比星和泼尼松)和 MINE(美司钠、异环磷酰胺、米托蒽醌、依托泊苷)。然而,这些方案的疗效并不令人满意,大多数患者会出现复发或疾病进展。AITL的5年PFS率为13%-23%,5年OS率为33%-36%。
西达本胺是一种苯甲酰胺类组蛋白去乙酰化酶抑制剂(HDACi),是中国第一个被批准用于治疗复发/难治性PTCL的新药,对TFH表型PTCL(包含AITL)的疗效尤为突出。来那度胺是靶向肿瘤细胞和肿瘤微环境的第二代免疫调节化合物。大约70%-100%的AITL患者伴有EBV感染,这可能导致宿主免疫功能异常。EB病毒(EBV)感染免疫细胞(如B细胞、T细胞和自然杀伤细胞),并损害免疫功能,导致免疫细胞无法抵抗肿瘤。利妥昔单抗可以清除EBV感染的B细胞和活化的B细胞,并可能阻止AITL的进展。当与利妥昔单抗联合使用时,西达本胺通过恢复或上调CD20表达来协同增效CD20单抗,而来那度胺通过增强NK细胞来增强抗体依赖性细胞介导的细胞毒性,从而共同克服了淋巴瘤患者的利妥昔单抗耐药性。本研究是为了探讨利妥昔单抗、来那度胺联合西达本胺在复发/难治性 AITL 患者中的疗效和安全性[1]。


至少一线化疗后复发/难治性 AITL 患者,每3周最多接受6个周期的利妥昔单抗和来那度胺加西达本胺 (RLC) 方案治疗。利妥昔单抗在第1天静脉给药,剂量为375mg/m2,联合来那度胺(15mg/天,第1-14天)和西达本胺(30mg/次,每周两次)。每两个周期进行一次影像学检查,以评估治疗效果。该研究的主要终点是无进展生存期(PFS),次要终点包括总缓解率(ORR)、总生存期(OS)和不良事件(AE)。


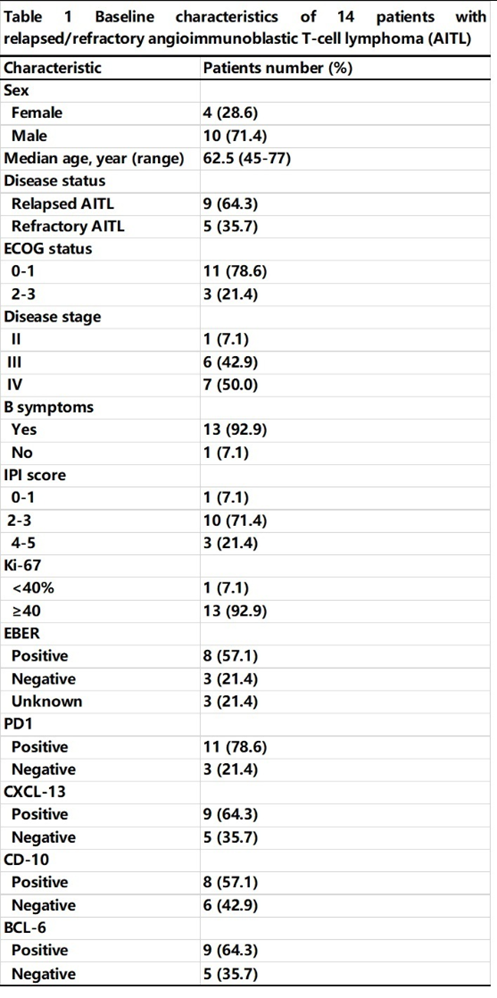
2019年8月至2022年5月,共入组了14例复发/难治性AITL患者。入组时,8例(57.1%)患者接受了一线化疗,5例(35.7%)患者接受了二线化疗,1例(7.1%)患者接受了三线化疗。中位年龄为62.5岁(范围45-77),4例(28.6%)患者为女性。13例(92.9%)患者为III/IV期疾病,仅有1例(7.1%)为II期。13例(92.9%)患者出现B症状,包括3例(21.4%)体重减轻、1例(7.1%)出现盗汗、9例(64.3%)出现发热。8例(57.1%)患者血清乳酸脱氢酶(LDH)升高,13例(92.9%)IPI评分≥2分。
所有患者均已完成至少1个周期的RLC治疗并接受了影像学评估。ORR为71.4%(10/14),CR率为35.7%(5/14),另有1例(7.1%)患者病情稳定(SD),3例(21.4%)患者病情进展(PD)。2例患者在RLC化疗获得CR后接受自体造血干细胞移植作为巩固治疗。中位随访24.4个月后,8例患者死亡。中位PFS为6.3个月(95%置信区间<CI>,4.6至8.0个月),中位OS为7.5个月(95%CI,4.0至11.0个月)。
西达本胺的治疗耐受性良好,并且在联合治疗中没有患者出现5级不良事件(AE)。最常见的所有级别血液学毒性是白细胞减少(35.7%,5/14),其次是贫血(21.4%,3/14)和血小板减少(35.7%,5/14)。其他常见的毒性包括输液反应(14.3%,2/14),皮疹(21.4%,3/14),肺炎(42.9%,6/14)和恶心(7.1%,1/14)。4例患者因此减少了剂量。
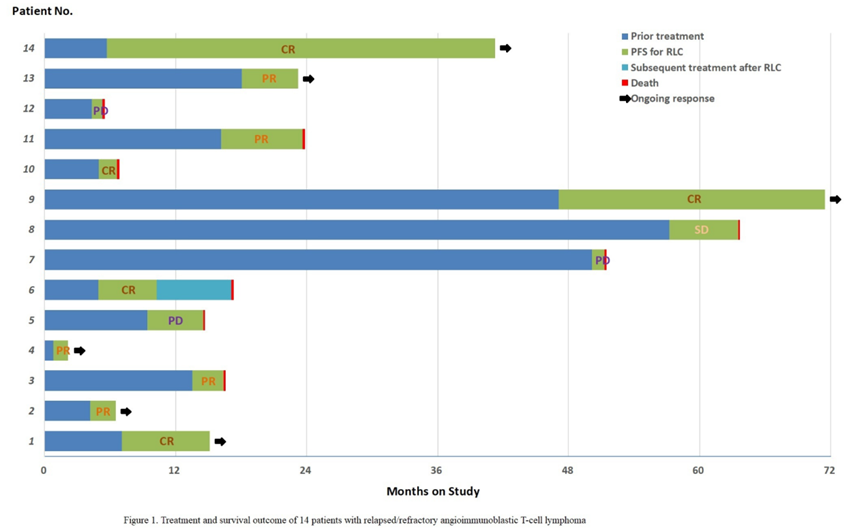


该研究表明,利妥昔单抗和来那度胺加西达本胺 (RLC) 方案在复发/难治性 AITL 患者中具有高缓解率和可控毒性。


PTCL缺乏标准的治疗选择,尤其是复发和难治性患者,文献报道二线治疗后中位PFS和OS仅3.1和5.5个月[2]。PTCL靶向治疗的发展一直落后于B细胞淋巴瘤的靶向治疗。以HDACi为基础的联合治疗方案是R/R PTCL的一种安全有效的方法,特别是在AITL和具有滤泡辅助表型的T细胞淋巴瘤(TFH-PTCL)中。这可能与AITL和TFH-PTCL具有相似的突变模式和基因表达谱有关,这些突变模式和基因表达谱被认为与表观遗传调控密切相关,赋予该亚型对HDACi的治疗敏感性[3]。
AITL肿瘤微环境与TFH细胞的相互作用与AITL的发生发展密切相关,TFH细胞分泌高水平趋化因子CXCL-13与其受体CXCR5结合,从而促进B细胞和滤泡树突状细胞(FDC)募集到AITL组织中。Tfh细胞还分泌IL-21和IL-4并有助于生发中心的B细胞增殖[4],而CD20在AITL中的表达亦有据可查[5-7]。当联合治疗时,HDACi西达本胺与利妥昔单抗和来那度胺均存在相互协同作用[8-9]。
对于我们而言,更好地联合新药以提升CR率是重中之重。在这项小样本研究中,西达本胺联合方案(RLC)治疗复发/难治性AITL的ORR高达71.4%,CR率为35.7%,2例患者经RLC方案治疗获得CR后进行了ASCT,且作为一种去化疗方案,RLC具有良好的耐受性和可控性。综上所述,RLC方案有望成为AITL患者获得更大生存获益的可选方案之一,特别是不耐受强化疗和CD20表达阳性患者。未来需要进一步扩大样本量、进行多中心合作研究,以充分佐证西达本胺联合方案的优越性。
杨海燕 教授
中国科学院大学附属肿瘤医院
参考文献:
[1] Li C, Lei T, Yu H, et al. Rituximab and Lenalidomide Plus Chidamide Can be an Effective Chemotherapy Regimen for Patients with Relapsed/Refractory Angioimmunoblastic T-Cell Lymphoma[J]. Blood, 2022, 140(Supplement 1): 3689-3690.
[2] Mak V, Hamm J, Chhanabhai M, Shenkier T, Klasa R, Sehn LH, Villa D, Gascoyne RD, Connors JM, Savage KJ. Survival of patients with peripheral T-cell lymphoma after first relapse or progression: spectrum of disease and rare long-term survivors. J Clin Oncol. 2013 Jun 1;31(16):1970-6. doi: 10.1200/JCO.2012.44.7524. Epub 2013 Apr 22. PMID: 23610113.
[3] Ghione P, Faruque P, Mehta-Shah N, Seshan V, Ozkaya N, Bhaskar S, Yeung J, Spinner MA, Lunning M, Inghirami G, Moskowitz A, Galasso N, Ganesan N, van der Weyden C, Ruan J, Prince HM, Trotman J, Advani R, Dogan A, Horwitz S. T follicular helper phenotype predicts response to histone deacetylase inhibitors in relapsed/refractory peripheral T-cell lymphoma. Blood Adv. 2020 Oct 13;4(19):4640-4647. doi: 10.1182/bloodadvances.2020002396. PMID: 33002132; PMCID: PMC7556143.
[4] Mhaidly R, Krug A, Gaulard P, Lemonnier F, Ricci JE, Verhoeyen E. New preclinical models for angioimmunoblastic T-cell lymphoma: filling the GAP. Oncogenesis. 2020 Aug 14;9(8):73. doi: 10.1038/s41389-020-00259-x. PMID: 32796826; PMCID: PMC7427806.
[5] Tachibana T, Tomita N, Furuya M, et al. Aberrant CD20 expression in angioimmunoblastic T-cell lymphoma[J]. Internal medicine, 2011, 50(5): 495-499.
[6] Foukas P G, Kefala M, Papageorgiou S, et al. CD20 expression in angioimmunoblastic T cell lymphoma[J]. Leukemia & Lymphoma, 2012, 53(2): 345-347.
[7] Banz Y, Krasniqi F, Dirnhofer S, et al. Relapsed angioimmunoblastic T-cell lymphoma with acquired expression of CD20: a case report and review of the literature[J]. BMC clinical pathology, 2013, 13(1): 1-6.
[8] Guan X W, Wang H Q, Ban W W, et al. Novel HDAC inhibitor Chidamide synergizes with Rituximab to inhibit diffuse large B-cell lymphoma tumour growth by upregulating CD20[J]. Cell death & disease, 2020, 11(1): 1-18.
[9] Cosenza M, Civallero M, Fiorcari S, et al. The histone deacetylase inhibitor romidepsin synergizes with lenalidomide and enhances tumor cell death in T-cell lymphoma cell lines[J]. Cancer biology & therapy, 2016, 17(10): 1094-1106.

【2022 ESMO IO】西达本胺联合替雷利珠单抗和化疗一线治疗晚期NSCLC实现ORR和PFS双突破
ASH速递|2022年ASH年会盘点之HDACi西达本胺:厚积薄发,多点开花
张薇教授:回顾性分析中国血管免疫母细胞淋巴瘤,构建新型预后模型
蔡真教授:西达本胺联合方案可以通过上调BIM表达而发挥抗MM作用
孙自敏教授团队:西达本胺联合方案为R/R AML患者的桥接移植创造可能
1种维持选择,2年mPFS:HDAC抑制剂为淋巴瘤患者长期生存助力
苏州大学附属第一医院血液团队最新发表复发难治AML研究结果:双表观方案为复发/难治AML治疗另辟蹊径

