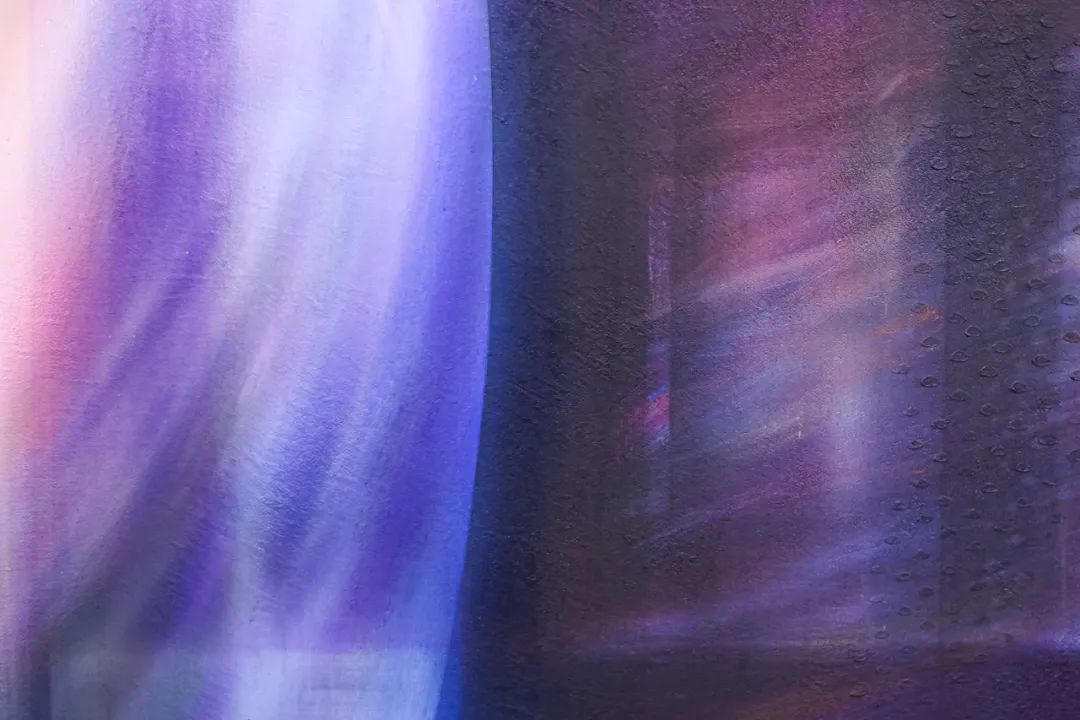——黄羽婷
七十多年前的一个冬夜,弗吉尼亚·伍尔夫驱车穿越苏塞克斯乡间,夕阳隐去,暮色逐渐深重,面对眼前的风景,她这样写道,“就像一只充气的气球那样,感知觉迅速地膨胀起来。”自我在这场冒险中流转、游荡与分裂,徘徊在意识的能动边界。
每天结束工作后的深夜,刘璐也如此乘车或驾车,从转塘的工作室回到住所,这是她感官格外松弛与充盈的珍贵时刻。转塘,既是中国美术学院所在的生活社区,也是杭州在飞速城市化进程中难得留白的空间段落。在这里,水雾里的森林远山能透过天际线从容地袒露,茂密的植被枝叶与冷峻的金属钢筋外立面同等程度地抢眼。在统一的规制之外,野生状态谦卑地隐匿其间,但其实却随处可见。

展览现场
暗夜中,观看愈明晰
和伍尔夫共享着某种对日常环境和运动的敏感,但和前者所沉思的小汽车带来的现代主义语法不同,观看技术的迭代让刘璐在车窗内外有了更多层次的感官纹理和观察角度。转塘本身在空间上的细腻与复杂,让她的眼光得以在不同质感间的空间中穿行与捕获。更为特别的是,她习惯用数码相机去体味和记录这一切。

刘璐 瞳孔 2024 布面丙烯 180x140cm
摄影是刘璐与周遭发生关系的一种关键方法。相机不仅能捕捉分秒瞬间,通过手动控制快门、细致地调整参数,选择合宜的角度与姿态,我们对真实时空的感知也被图像技术所改写和形塑着。从摄影到绘画,在电子屏幕、相纸与画布之间来回,刘璐将观看这个基本的行为进行细致的拆解、填充和反思。在这个过程中,原本单一的视觉模态在不断地裂变与叠加——肉眼下一闪而过的明暗在快门的控制下留存,变成镜头照片里的光斑,继而又成为画布上神秘且自成规制的几何单元。
刘璐 镜中湍流1 2024 布面丙烯 120x80cm
在平面溢出的世代里,我们该如何观看周遭?又如何在数种屏幕中找回属于自己的视觉?从镜头到肉眼,媒介之间转换交错,技术的介入使得观看本身变成了创造性的行为,影像不再是单纯的记录,而成为艺术家动态的思考方式:每一次快门的按下都是对时间的微妙干预,以及对现实的重新想象。视觉被提炼和协调,悄然蜕变成新的感知形态。这是一个不断解构与重构的过程,在捕捉与流失之间,在断裂与连续之中,刘璐编织出一张张细密的感知网络。
对刘璐而言,“家-工作室”两点一线的位移路程既是稳定的,但同时因为观看的变动而充满不确定的神秘。这样诚恳的观看回应着伍尔夫式的检视,又召唤着一种新的诗学——既是对有形瞬间的捕捉,又是对无形世界的探测;既是对外在景观的记录,又是内在意识流的映射。刘璐的创作将媒材、感知、地理编织成复杂而敏感的图像系统。

刘璐 红房间1 2023 布面丙烯 100x120cm
刘璐 红房间2 2024 布面丙烯 165x115cm
月光如昼,世界失焦了
月光下的飞地、都会荒野与霓虹灯影,这些意象很难不让人联想到很多强叙事性的现代文本。但在刘璐的眼光和笔下,起伏的情节及其具体的情绪似乎无关紧要。
刘璐 白昼月光 2024 布面丙烯 210x125cmx2
这次艺术家的新展名为“感官之月”,这似乎是个有意为之的“蜃景”——月亮常被赋予过多的感性隐喻,变成滥情而随性的象征。但月球同时也是极度精确的数学天体,其运行轨迹实际上蕴含着宇宙间最为严谨的数理逻辑。揭开看似抒情或柔软的紫色帘幕,你会看到的是艺术家在严谨控制的下所构建的直觉空间。在这里,对抗和计算,偶然与利落错落交织,穿透朦胧的纱绸,月夜的冷冽与精准同样令人着迷。
刘璐 流星 2024 布面丙烯 120x120cm
艺术家将私人的情感波动微妙地悬置,甚至削弱,她去制造的是在感知时空与情境中的共鸣和慷慨邀约。用石英砂组成的固定图形排列成梦境般的几何阵列,飘浮在氤氲幻影的柔情表面。近看时,它们的肌理有意图地引导观者目光的节奏与律动,给人以视觉上直觉性的愉悦。在此次的个展空间中,当你面对更多的作品序列时,单个作品与作品间构成一种更加宏观的言说和意象,如同迷雾,也近乎音墙。

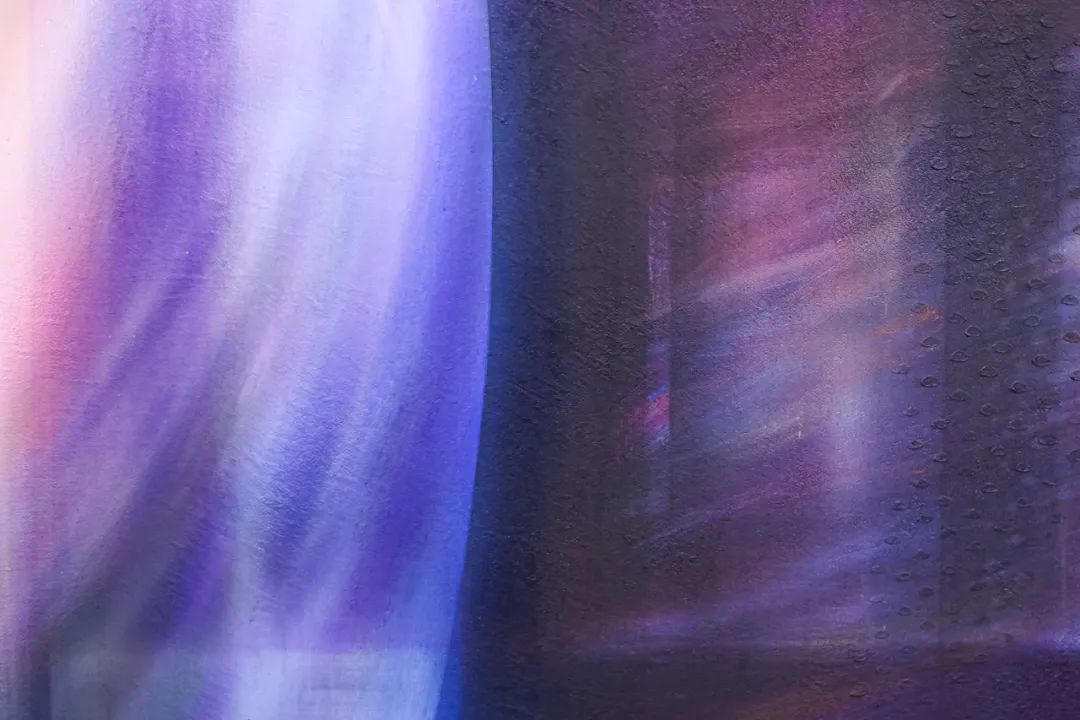
刘璐 银色边界 2024 布面丙烯 160x120cm
在画布上,摒绝多余的抒情和遐想,刘璐进行的是秩序和直觉上的冒险与演绎。这让画面里这些“失焦”的夜晚指向的不仅是对自我意识的坦然测量,而且能够刺激和扰动更加开阔的知性时空。夜晚的可能性和广度因由如此的悬置与游离中展开。
刘璐 月移1 2024 布面丙烯 215x125cm
未来是此刻的幕间
在她的最后一本小说《幕间》里,伍尔夫这样写道,“未来的阴影投射到现在的时刻,像太阳光穿过脉络丰富的透明葡萄叶,形成一些纵横交错的线,不构成任何图案。”这句话出现在展览“感官之月”墙面的末尾,仿佛书写着关于时间的耐人寻味的寓言。

刘璐 镜中湍流3 2024 布面丙烯 120×80cm
刘璐 镜中湍流2 2024 布面丙烯 120×80cm
不过,追踪画面里的线条与笔触,你得到的当然不是文学文本里时间线的某种隐喻,而是刘璐通过记忆与预感编织的潜在图示。在这些作品中,过去、现在与未来不再是线性的,而是如同多维空间中流动的光影,观看的目光之间彼此穿透,它们的强度互相映射。
刘璐 照向过去的镜头 2024 布面丙烯 150×120cm
刘璐 红色感应 2024 布面丙烯 150x120cm
刘璐的作品不仅构成一个开放而流动的感知情境,而且也是驱策着秩序和结构的智性制图系统,后者隐在帘幕之后,当你识别到她尤其精进的感知结构和表达策略之后,有种不合时宜的信念会悄然生出:对此刻此时的体验从来不是一种被动的接受与虚无的沉没。即便只是坐在疾驰的车辆上的平常一夜,也值得被感知全部的深度和复杂性所发现与记得。
刘璐 面纱 2024 布面丙烯 150×120cm

关于艺术家
刘璐,1991年生于浙江台州,2017年毕业于中国美术学院油画系并获得硕士学位,现工作和生活于杭州。刘璐的绘画基于这个时代一种朦胧迷幻的视觉体验,围绕虚拟与现实之间的重叠的光影展开,她发现多重曝光会将不同时光的物象串联起来产生新的幻像。同时她把滤镜中的“高斯模糊”这种虚假失真却细腻的质感渗透到了画面当中,她运用抽象化的图形、符号、线条,来呈现那些虚拟而日常的存在。刘璐向我们展示出在这个真实与虚假、精确与模糊的边界逐渐消融的世界中,重新建立真实描述与表达的另一种可能性。

关于艺评人
黄羽婷,写作者和策展人,现生活和工作在杭州。她获得北京大学艺术史论和哲学双学士学位(2018),莱顿大学艺术与文化研究型硕士学位(2020)。她的近期写作和评论散见于 Artforum(中文版)、打边炉、Artreview China等地。
©文章版权归属原创作者,如有侵权请后台联系删除