近年来,随着靶向治疗药物等前沿药物的崛起与广泛应用,血液肿瘤领域的治疗格局迎来了显著的进展。其中,西达本胺作为一种口服、新型亚型选择性HDACi,具有对肿瘤异常表观遗传功能的调控作用。作为“First-in-class”原创抗肿瘤新药,西达本胺历经二十余年风雨,仍不忘初心,其在白血病等多种血液系统肿瘤的研究中正在如火如荼地进行。
中国医学科学院血液病医院(中国医学科学院血液学研究所)姜尔烈教授团队长期致力于AML、T-ALL/ LBL等血液肿瘤疾病的治疗方案的探索,旨在为急性白血病患者带来更好的治疗选择。并于近期发表旨在降低RUNX1:: RUNXT1阳性高危AML患者在移植后的复发风险的应用表观遗传药物的预防与抢先治疗研究,以及T-ALL/LBL患者在接受异基因造血干细胞移植后,应用西达本胺进行维持治疗的可行性和安全性的研究,为血液肿瘤治疗开辟了更为广阔的前景。
RUNX1:: RUNXT1阳性高危AML
在allo-HSCT后应用表观遗传药物
预防治疗1

一、研究背景
疾病复发是RUNX1::RUNXT1阳性急性髓系白血病(AML)患者接受异基因造血干细胞移植(allo-HSCT)后治疗失败的主要原因。移植后,通常依据最小残留疾病(MRD)的监测结果来指导抢先治疗。然而,复发率仍然居高不下。在姜尔烈教授团队的前期研究中,发现西达本胺和阿扎胞苷(AZA)在allo-HSCT后的急性白血病患者中均具有良好的耐受性。基于此,姜尔烈教授带领其团队发起了一项前瞻性研究,旨在评估高风险RUNX1::RUNX1T1阳性AML患者移植后使用西达本胺或阿扎胞苷预防性治疗的有效性和安全性。
二、研究目的
评估高风险RUNX1::RUNX1T1阳性AML患者移植后使用西达本胺或阿扎胞苷预防性治疗的有效性,包括无复发生存期(RFS)、总生存期(OS)、累积复发发生率(CIR),以及AZA和西达本胺预防性治疗的安全性。
三、研究方法
前瞻性研究纳入2019年1月至2023年7月期间,根据患者的身体状况,于allo-HSCT后1个月、2个月、3个月、4.5个月、6个月、9个月和12个月时间点,对骨髓MRD进行检测。维持治疗的策略取决于移植后MRD水平,特别是2个月这一关键时间节点。对于allo-HSCT后MRD检测呈阴性的患者,给予AZA或西达本胺进行预防性治疗。相反,对于那些在移植后早期出现分子复发但尚未发生血液学复发的患者,则启动抢先治疗策略。
AZA和西达本胺在移植后约60天开始给药,持续给药至少一年。在初始阶段,当中性粒细胞绝对值连续3天>0.5×109/L,血小板计数连续7天>20×109/L时,AZA以50 mg/m2的剂量皮下或静脉注射给药,每日给药持续5天,共28天;口服西达本胺5mg每天,每周连续五天。当中性粒细胞绝对值连续3天>0.5×109/L,血小板计数连续7天>20×109/L,且未出现其他不良反应时,剂量可增至10mg,并在治疗期间根据不良反应的发生情况随时调整剂量。本研究采用Kaplan-Meier、Gray检验等多种统计方法,对RFS、OS、CIR及变量进行分析,评估各组患者的治疗效果和安全性。
四、研究结果
1. 患者特征
研究纳入30例高危患者接受预防性治疗(西达本胺组n=17,AZA组n=13),其中移植时25例(83.3%)达到CR,其中CR1 24例,CR2 1例;5例(16.7%)在异基因造血干细胞移植时处于未缓解(NR)状态。在抢先治疗组中(n=34),31 例患者 (91.2%) 处于 CR1 状态,1 例患者 (2.9%) 处于 CR2 状态,2 例患者 (5.9%) 在异基因 HSCT 时处于 NR 状态。
预防性治疗的起始中位时间为92天(IQR,62-120天)。具体而言,西达本胺组和AZA组预防性治疗的起始中位时间分别为93天(IQR, 46-125)和91天 (IQR, 68.5-119)。在预防性治疗期间,药物剂量可根据血细胞减少、感染或其他潜在不良反应的发生情况进行适时调整。最终,西达本胺组的中位治疗持续时间为302天(136.5-398.5),其中9/17(52.9%)患者从开始治疗到完成西达本胺治疗的持续时间>300天。而对于AZA组,给药周期的中位数为5个(IQR, 5.0 ~ 6.5),仅3/13(23.7%)的患者接受了>8个周期的AZA治疗。
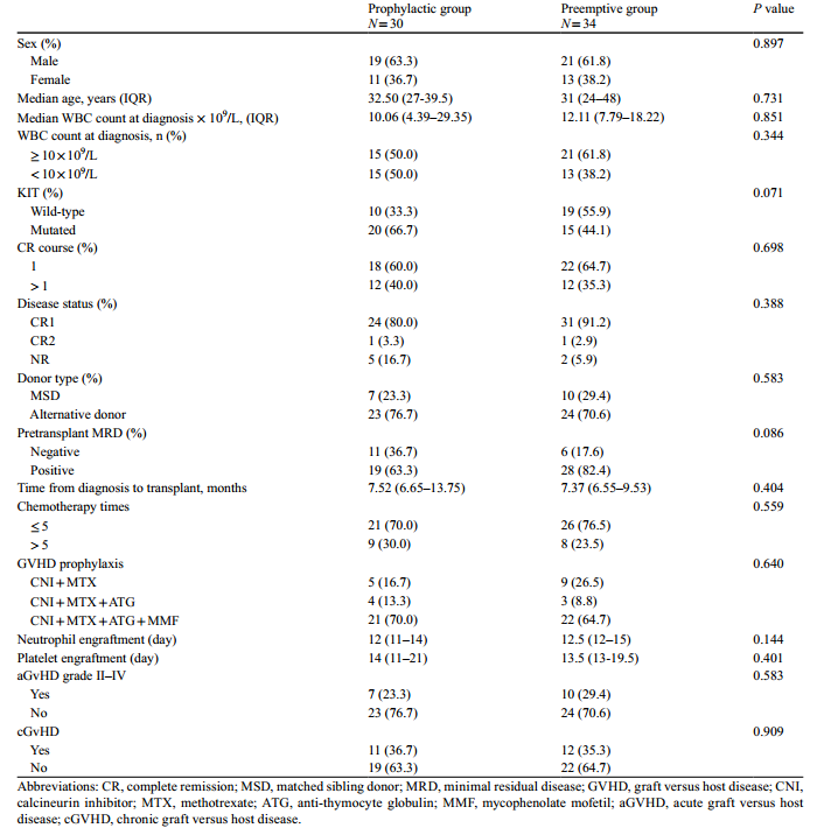
患者特征
2. MRD数据
在预防治疗组中,30例患者中有6例(20.0%)出现了分子复发,其中3例来自西达本胺组,另3例来自AZA组(图1)。从预防性治疗开始到分子复发的中位时间间隔为168天(IQR,107.8–332),且在这6例出现分子复发的患者中,有3例(50.0%)最终进展为血液学复发。此外,在这3例从分子复发进展到血液学复发的患者中,有2例(66.7%)在移植前未能达到完全缓解(CR)状态。
抢先治疗组患者从治疗开始到出现分子复发的中位时间为56天(IQR,42–90)。在接受抢先治疗的患者中,27/34(79.4%)患者成功实现了MRD转阴,从抢先治疗给药到MRD转为阴性的中位时间为35天(IQR,14–55)。然而,在最后一次随访时,这27例MRD转阴的患者中有7例(25.9%)出现了复发。
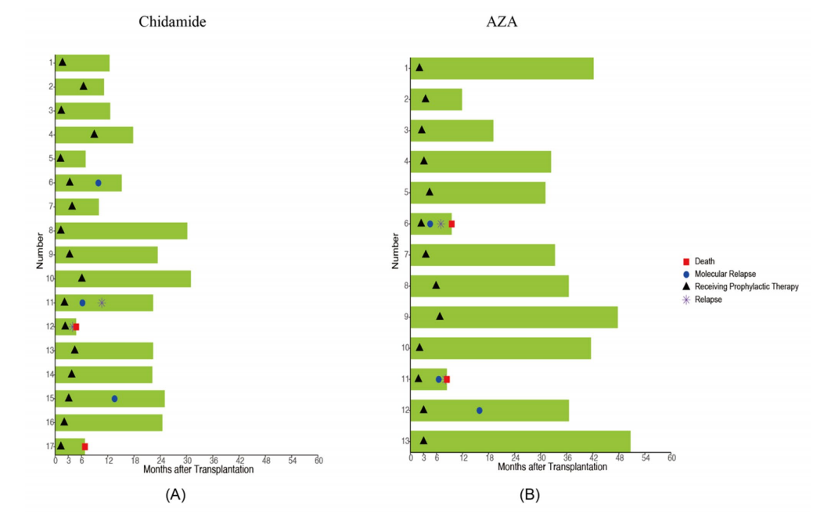
图1:接受西达本胺(A)和AZA(B)
作为预防性治疗的患者个体反应的泳道图
3.RFS、OS、CIR数据
在接受预防性或抢先性治疗的患者中,均未出现移植后2个月内复发或在3个月内死亡的情况。预防组的2年RFS为82.82%(95% CI,70.17-97.75%),而抢先组的2年RFS为51.38%(95%CI,36.75-71.84%),两组间差异显著(p=0.014,图2A)。同样地,预防组和抢先组的2年OS分别为86.42%(95%CI,74.88-99.73%)和56.16%(95%CI,41.26-76.44%),差异也具有统计学意义(p=0.025,图2B)。
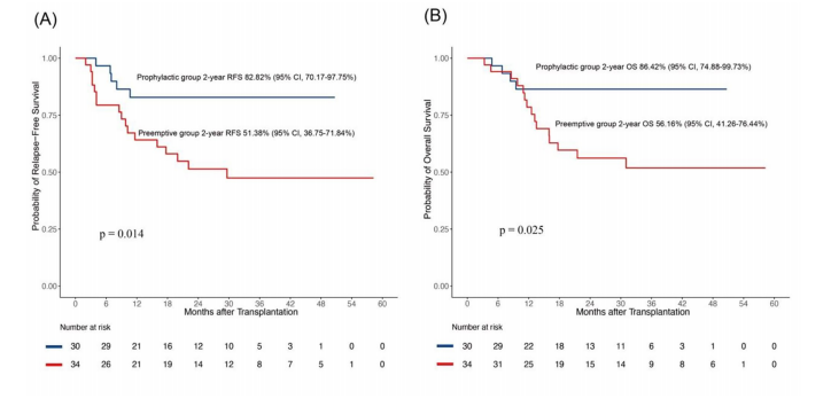
图2:(A)无复发生存期(RFS)、(B)总生存期(OS)
进一步分析显示,在预防组中,有4/30(13.3%)的患者在移植后发生了复发,复发时间分别为8.1、7.0、4.0和10.7个月,其中,接受西达本胺和AZA作为预防性治疗的患者中各有2例复发,分别占各自亚组的11.8%(2/17)和15.4%(2/13)。相比之下,抢先组中有13/34(38.2%)的患者发生了复发,复发中位时间为移植后4.10(3.27-15.08)个月。预防组的2年CIR为13.8%(95%CI,4.23-29.06%),显著低于抢先组的36.40%(95%CI,20.19-52.81%)(p=0.037;图3)。如图3所示,抢先组患者在移植后6个月内出现了快速复发的趋势,随后复发逐渐放缓,而预防组在移植后12个月后复发率保持稳定水平。
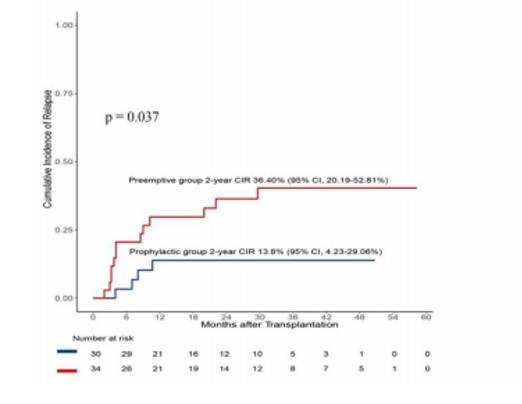
图3:预防治疗组和抢先治疗组累积复发率(CIR)
4.安全性数据
在安全性方面,预防组中有7/30(23.3%)例患者出现了II-IV级急性移植物抗宿主病(aGVHD),特别地,有1例患者在接受AZA预防性治疗给药后一个月出现了涉及皮肤的II级aGVHD。此外,11/30(36.7%)例患者出现了慢性移植物抗宿主病(cGVHD),其中7例为局限性,4例为广泛性。在发生cGVHD的11例患者中,有9例(81.8%)是在预防性治疗后被确诊的。西达本胺组和AZA组最常见的不良反应为血液学毒性,西达本胺组包括中性粒细胞减少症(所有级别,94.1%)、血小板减少症(所有级别,88.2%)和贫血(所有级别,52.9%)。AZA组包括中性粒细胞减少症(所有级别,76.9%)、血小板减少症(所有级别,61.5%)和贫血(所有级别,53.8%)。
五. 结论
本项研究中,对于RUNX1:: RUNX1T1阳性的高危AML患者,通过定期监测MRD,应用包括AZA和西达本胺在内的表观遗传药物进行allo-HSCT后的预防性治疗安全且有效,不良反应可接受。与抢先治疗组相比,预防组患者的RFS和OS显著升高,分别为82.82% vs. 51.38%,P=0.014;86.42% vs. 56.16%,P=0.025;CIR显著降低,分别为13.8% vs. 36.40%,P=0.037。因此,在身体条件允许的情况下,建议高危RUNX1::RUNX1T1阳性的AML患者应积极接受预防性治疗。

高危T-ALL/T-LBL患者
aIlo-HSCT后西达本胺维持治疗2

一、研究背景
T细胞急性淋巴细胞白血病(T-ALL)和T细胞淋巴母细胞淋巴瘤(T-LBL)是成人罕见疾病,且预后不佳。疾病复发是异基因造血干细胞移植(aIlo-HSCT)失败的主要原因。由于缺乏有效的挽救疗法,T-ALL患者的治疗结局令人沮丧。鉴于治疗移植后复发患者的难度,我们迫切需要探索T-ALL/LBL患者在接受allo-HSCT后预防复发的新型治疗策略。
因此,姜尔烈教授团队于2019年10月-2022年3月开展了一项前瞻性、单中心、单臂研究,旨在评估西达本胺作为T-ALL/LBL患者allo-HSCT后维持治疗的疗效。
二、研究目的
评估T-ALL/LBL患者allo-HSCT后,应用西达本胺作为维持治疗的疗效,包括总生存期(OS)、累积复发率(CIR)和无事件生存期(EFS)MRD,其中,EFS事件包括死亡、血液学复发和分子学复发,并同时关注西达本胺维持治疗的安全性。
三、研究方法
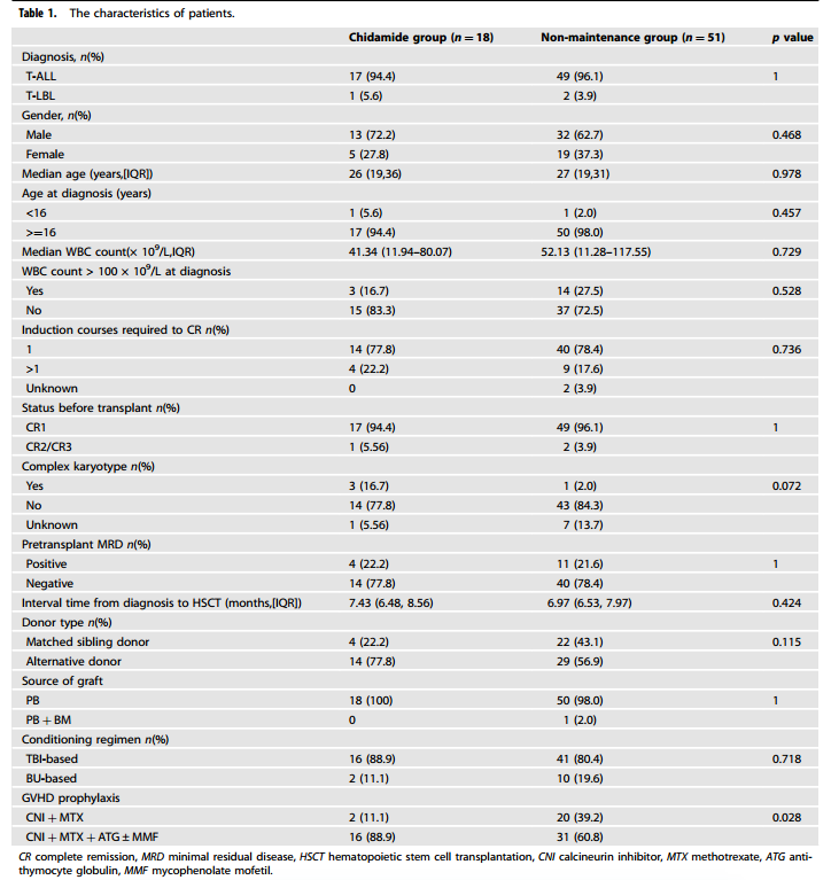
本研究纳入18例高危T-ALL/LBL患者接受西达本胺作为移植后维持治疗。此外,研究团队还纳入2012年4月-2019年12月期间51例生存时间超过2个月、无复发迹象且未接受任何维持治疗的患者作为无维持治疗组。
西达本胺的初始剂量为5mg/d,患者需在餐后约30分钟口服一次,每周连续用药5次。待血液学指标恢复后,剂量增加至10mg,并在治疗期间根据不良反应的发生情况随时调整剂量。西达本胺的治疗应持续至少1年,直至患者出现复发或不可接受的毒性反应为止。在治疗期间,需定期进行常规血液学指标、骨髓穿刺活检和细胞遗传学检查。
四、研究结果
1. 患者特征
在接受西达维持治疗的患者中,有17例被诊断为T-ALL,1例被诊断为T-LBL且骨髓中原始细胞占比6%,患者的中位年龄为26岁(IQR, 19–36),在移植后平均3.08(IQR, 2.68-8.65)个月开始使用西达本胺,西达本胺的中位给药时间为9.65个月(IQR, 5.57-16.84)。
患者特征
2. OS、CIR数据
15例(83.33%)患者存活,中位随访时间为20.47(IQR, 12.77–22.80) 个月。西达本胺组的1年OS率为88.89%(95%CI, 75.49–100%),非维持治疗组的1年OS率为74.00%(95%CI, 62.79–87.21%)(P=0.076, 图4a)。此外,西达本胺组的1年CIR为5.56%,非维持治疗组为18.00%(P=0.285, 图4b)。
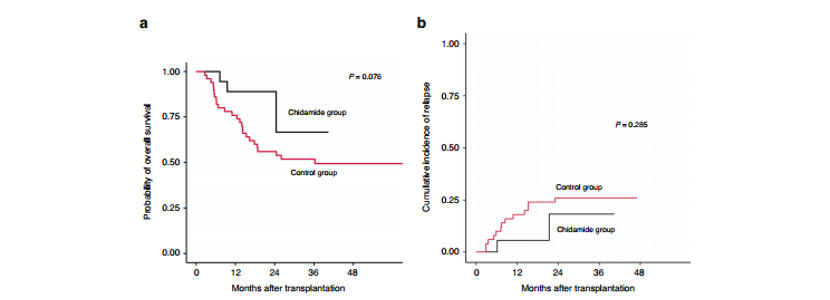
图4:a.西达本胺维持治疗OS;
b西达本胺维持治疗CIR
3. EFSMRD数据
西达本胺组中,1例(5.6%)患者在移植后9.30个月出现分子复发。在无维持治疗组中,共有11例(11/51, 21.6%)患者出现了分子复发,这些患者从移植到分子复发的中位随访时间为3.57个月(IQR, 3.00-9.03)。除无维持治疗组中出现分子复发的3例患者外,所有患者均接受了供体淋巴细胞输注(DLI)以预防血液学复发。与无维持治疗组相比,西达本胺组1年EFSMRD显著改善(83.33% vs. 62.02%, P=.047; 图5)。
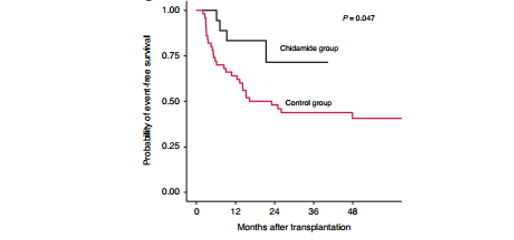
图5:西达本胺维持治疗EFSMRD
4. 安全性数据
在西达本胺组中,3/18(16.7%)患者出现I-II级急性移植物抗宿主病(aGVHD),其中累及皮肤2例,累及肠道1例,;只有1例(5.6%)患者在接受西达本胺治疗后出现aGVHD,该患者经过强化免疫抑制治疗后,症状有所改善。西达本胺组未观察到III/IV级aGVHD的发生。8/18(44.4%)的患者出现慢性移植物抗宿主病(cGVHD),其中6例(33.3%)是在西达本胺治疗后出现的,根据cGVHD的分级,有5例为轻度,3例为中度。西达本胺组中未出现严重的cGVHD,经医生评估后,患者继续接受西达本胺治疗。在无维持治疗组中,10/51(19.6%)患者出现II-IV级aGVHD,其中3例患者在DLI后发生了aGVHD。3/51(3.9%)患者在DLI后出现III-IV级aGVHD,并因aGVHD和/或严重感染而死亡。在无维持治疗组中,共有15/51(29.4%)患者出现cGVHD,其中轻度6例,中度8例,重度1例。
本研究中最常见的AE是血液学毒性,包括中性粒细胞减少(所有级别,88.9%)、血小板减少(所有级别,77.8%)和贫血(所有级别,38.9%)。16例患者 (88.9%)发生II级或以上血液学AE,11例患者(61.1%)经历了III-IV级血液学AE。没有患者因血液学AE而停止西达本胺的维持治疗,因为这些毒性反应在剂量调整或暂时停药后是可逆的。
五. 结论
该研究首次报道了T-ALL/LBL患者在接受allo-HSCT后应用西达本胺进行维持治疗的可行性和安全性。这一创新疗法显著优化了患者的OS和EFSMRD,预示着其或将成为allo-HSCT后T-ALL/LBL患者预防疾病复发、提升长期生存率的极具前景的治疗策略。

专家点评
在血液疾病的治疗领域,T-ALL/LBL、AML一直是研究的热点和难点。这些疾病具有高度异质性,其治疗需求一直在不断地推动着研究者们探索新的治疗策略和药物。近年来,随着对疾病生物学特性的深入认识以及新型治疗手段的不断涌现,特别是免疫治疗和靶向治疗的快速发展,为患者带来了新的治疗希望。西达本胺作为我国自主研发的HDACi,其在血液疾病治疗中的潜力正逐渐被发掘。西达本胺通过调节表观遗传学机制,影响肿瘤细胞的增殖、分化和凋亡过程,在多种类型的血液疾病中展现出良好的治疗前景。未来的研究方向应进一步明确其在不同血液疾病中的疗效和安全性,以优化治疗方案,从而达到更好的治疗效果和提升患者生存质量。
总体而言,随着医学技术的不断进步,我们有理由相信,包括西达本胺在内的新型治疗手段将引领血液疾病治疗领域的革命性变革,为患者带来更多的生存希望。然而,这一过程离不开医学界同仁们的共同努力。我们需要继续秉持科学精神,勇攀科研高峰,为血液肿瘤治疗注入更多“中国智慧”,照亮患者重获健康的希望之路。
专家简介
姜尔烈 教授
中国医学科学院血液病医院
(中国医学科学院血液学研究所)
干细胞移植中心主任
医学博士、主任医师
中国初级卫生保健基金会造血干细胞移植
专委会主任委员
中国血液病专科联盟白血病自体移植协作组组长
中华医学会血液学分会造血干细胞应用学组副组长
中国抗癌协会血液肿瘤专业委员会常务委员
造血干细胞移植与细胞治疗学组副组长
CSCO自体造血干细胞移植工作组副组长
天津市抗癌协会常务理事
天津市血液与再生医学学会副理事长
中华血液学杂志、白血病&淋巴瘤等杂志编委
参考文献:
1.Guo W, et al. Prophylactic therapy using epigenetic agents for RUNX1::RUNXT1-positive high-risk AML after Allo-HSCT. Ann Hematol. 2024 Jun 22.
2.Guo W, et al. Chidamide maintenance therapy in high-risk T-ALL/T-LBL after allo-HSCT: a prospective, single-center, single-arm study. Bone Marrow Transplant. 2023 Oct;58(10):1163-1166.
荟萃名家 聚焦临床
欢迎关注CCMTV·血液频道!

本文来源于互联网:医学前沿——西达本胺在预防移植后复发与维持治疗中的创新应用