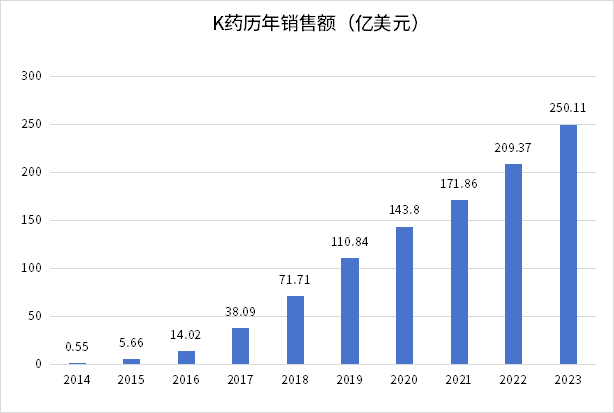
打响药王保卫战。

-
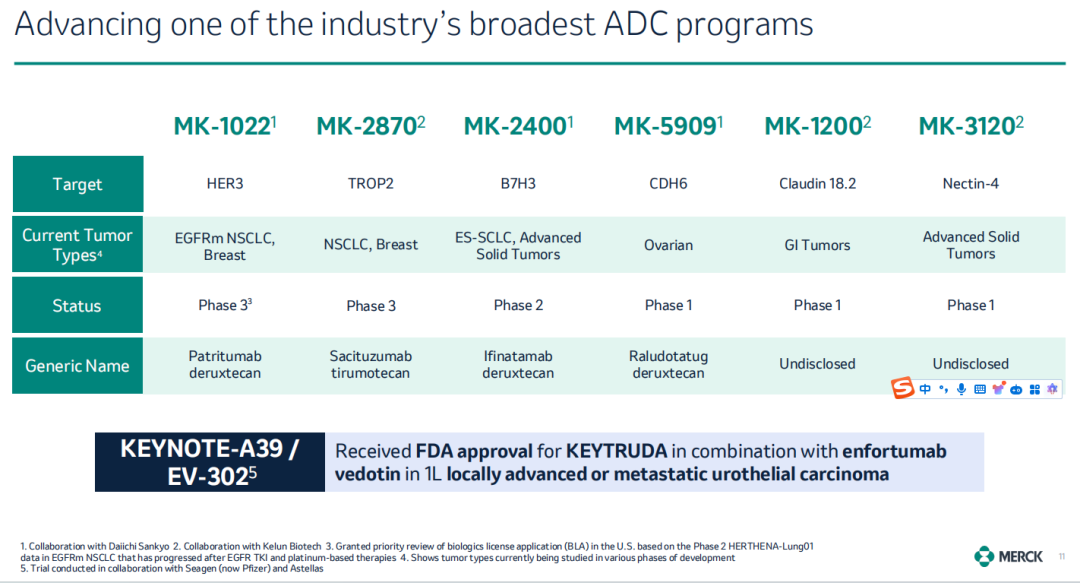
2022年,默沙东与科伦博泰签订三项许可及合作协议,以118亿美元达成多个 ADC 合作,包括已推进至临床阶段的3项 ADC 资产,分别为MK-2870(SKB264,Trop2 ADC)、MK-1200(Claudin18.2 ADC)、MK-3120(Nectin-4 ADC)及多个临床前 ADC 资产。
-
2023年10月,默沙东以40亿美元的前期付款,220亿美元的合作总金额,与第一三共达成合作,开发三款ADC药物候选药物:MK-1022(HER3 ADC)、MK-2400(B7H3 ADC)和MK-5909(CDH6 ADC)。