表观遗传学机制在急性髓系白血病(AML)的治疗中起着重要作用,但高危型AML患者仍是临床治疗较为棘手的一大难题。厦门大学附属第一医院徐兵教授团队开展的一项西达本胺联合维奈克拉的临床前研究,该治疗方案在一定程度上为高危型AML患者带来了福音。
为此,CCMTV临床频道-血液科第一时间邀请到厦门大学附属第一医院徐兵教授为我们详细解读这项令人振奋的研究情况。
徐 兵 教授








尽管急性髓系白血病(AML)的治疗在近些年有所进展,但AML预后仍然不容乐观。
ABT-199(维奈克拉)联合去甲基化药物或者阿糖胞苷,在新诊断的、不适合高强度化疗的AML患者中的疗效已得以证实,但由于患者选择性抗凋亡蛋白表达上调,患者往往产生耐药性。
组蛋白脱乙酰酶(HDAC)抑制剂可增加肿瘤细胞的敏感性,其中,CS055(西达本胺),于2015年被CFDA批准治疗复发/难治性外周T细胞淋巴瘤。徐兵教授课题组前期研究证实,CS055在AML中亦有较好的疗效。
在此基础上,徐兵教授课题组进行了系列临床前研究,最终证实ABT-199与CS055联合方案对治疗AML的有极好的效果。

课题组先进行了体外细胞实验。在Molm-13细胞系、MV4;11细胞系、NB4细胞系、OCI-AML2、OCI-AML3细胞系等诸多经典的AML细胞系中证实,低剂量CS055不但增强ABT-199抗AML的细胞毒性以及抑制AML细胞增殖的能力,而且可明显缩短AML细胞的S期、完全抑制AML细胞的生长(p<0.01)。
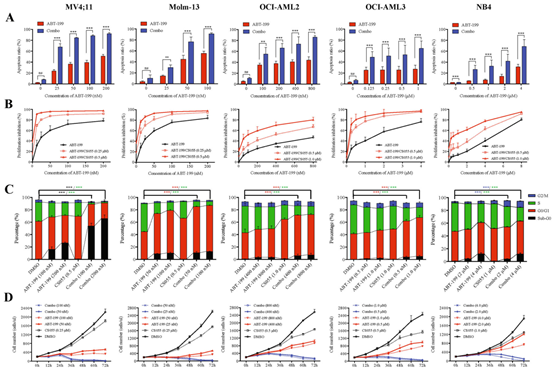
图1:低剂量CS055即可增强ABT-199的抗AML活性
罗米地辛(romidepsin)是一种有效的、选择性的HDACs抑制剂,2011年被FDA批准用于已接受过至少一次系统治疗的PTCL患者。与ABT-199/罗米地辛联合方案相比,ABT-199/CS055显示出更强的促AML细胞凋亡(p<0.05)。
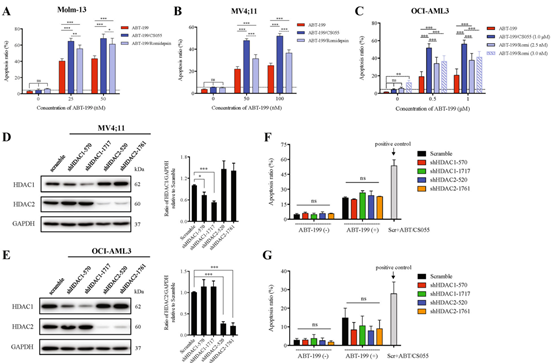
图2:CS055较罗米地辛显示出更强的再敏效果,
从而增强ABT-199的抗AML活性
ABT-199/CS055联合方案有显著的优点,即仅抑制AML原始细胞、造血干/细胞,而对正常的造血干/祖细胞则基本无影响。
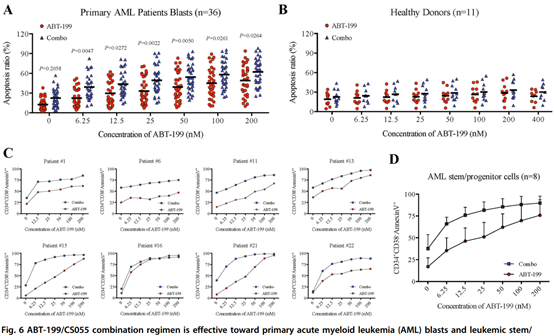
图3:ABT-199/CS055联合方案仅抑制AML造血干/祖细胞,而对正常的造血干/祖细胞基本无影响
ABT-199/CS055联合不仅增强了ABT-199的抗AML细胞活性,亦增强了ABT-199的抑制AML细胞集落形成的能力,而且,课题组用裸鼠模型,进一步证实联合方案极大改善了小鼠的AML肿瘤负荷——缩小了肿瘤体积、减轻了肿瘤质量。
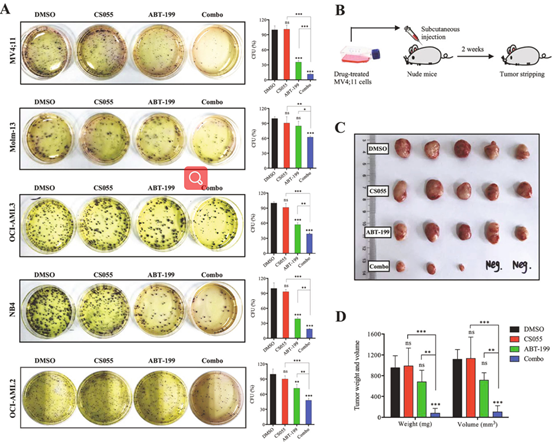
图4:ABT-199/CS055联合方案在体外抑制了AML集落形成、在体内抑制了肿瘤生长
最后,课题组进行了体内动物实验。课题组给辐照后的NPI小鼠输注来源于AML患者(带有FLT3-ITD突变)的细胞,成功制作了患者来源的异种移植(PDX)小鼠模型。利用该小鼠模型,课题组发现,ABT-199/CS055联合方案,显著缩小了小鼠的巨脾(p=0007)、明显降低了小鼠的肿瘤负荷(小鼠骨髓、脾脏、肾脏、肝脏、外周血等的人源CD45+细胞明显减少)、增加了AML细胞的凋亡(脾脏切片的TUNEL染色),而且,大幅度延长了小鼠的生存。
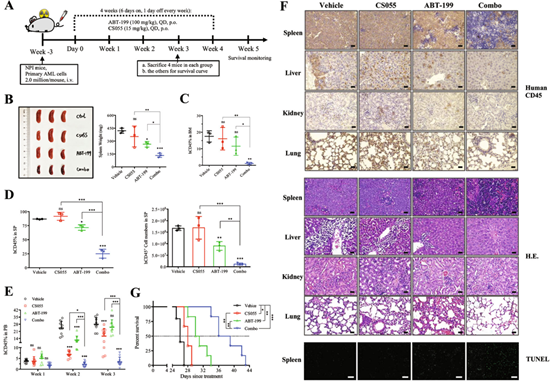
图5:ABT-199/CS055联合方案对PDX小鼠模型
具有极好的疗效

AML患者长期应用ABT-199后往往产生耐药性,HDACs抑制剂可增加肿瘤细胞的敏感性。徐兵教授课题组创新性地联合ABT-199与CS055,发现该方案有极好的抗白血病活性、而不影响正常造血干/祖细胞。课题组进一步探究了其中机制,发现CS055下调了Mcl-1分子(一种关键性的促生长蛋白)的表达,从而降低了ABT-199的耐药性,同时,CS055诱导表达更多的γH2AX,表现出更强的DNA损伤再应答,从而增加了ABT-199的抗AML活性。
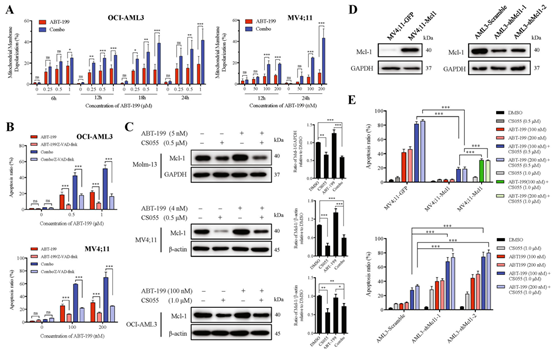
图6:CS055通过下调Mcl-1而增强
ABT-199的抗AML活性
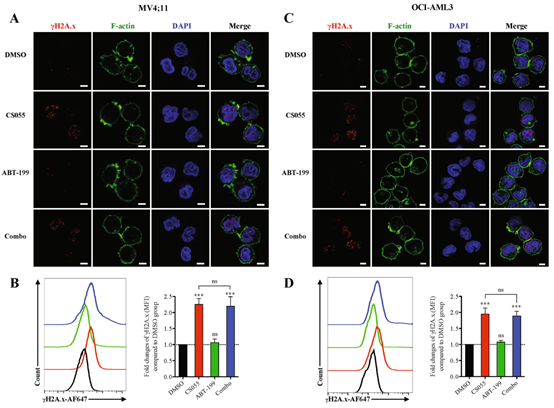
图7:CS055诱导表达更多的γH2AX,
而ABT-199则无此活性
NCCN指南提出,带有FLT3-ITD突变的AML患者,其预后往往较差。ABT-199/CS055联合方案在FLT3-ITD突变的AML细胞系(MV4;11和Molm-13)以及FLT3-ITD突变的患者白血病细胞均有明显的疗效。而且,该方案疗效在PDX小鼠模型上亦得到证实。

该研究提供了足够的临床前证据,证实ABT-199/CS055联合方案对高危型AML非常有效。该方案需要进一步临床试验,以期改善高危型AML患者的生存、预后。