转自:良医汇-肿瘤医生APP
汇报医生:复旦大学附属肿瘤医院 王雅君
点评专家:复旦大学附属肿瘤医院 王碧芸
激素受体阳性(HR+)乳腺癌是最常见的乳腺癌亚型,HR+乳腺癌的治疗中最重要的部分就是内分泌治疗,尽管内分泌治疗已经大大降低乳腺癌的复发和死亡,但内分泌耐药仍然是其主要的挑战。随着HDAC抑制剂等新型靶向药物的出现,突破了现有的治疗瓶颈,联合治疗已逐渐成为晚期乳腺癌的首选治疗方案。以下带来一例绝经后HR+/HER2-的晚期乳腺癌案例,患者接受一线CDK4/6抑制剂+氟维司群进展后,使用西达本胺联合依西美坦治疗,疗效达到CR,目前已获得15个月的PFS。

王雅君 医生
复旦大学附属肿瘤医院肿瘤内科 硕士研究生
中国临床肿瘤学会(CSCO)会员
中国抗癌协会乳腺癌专业委员会会员
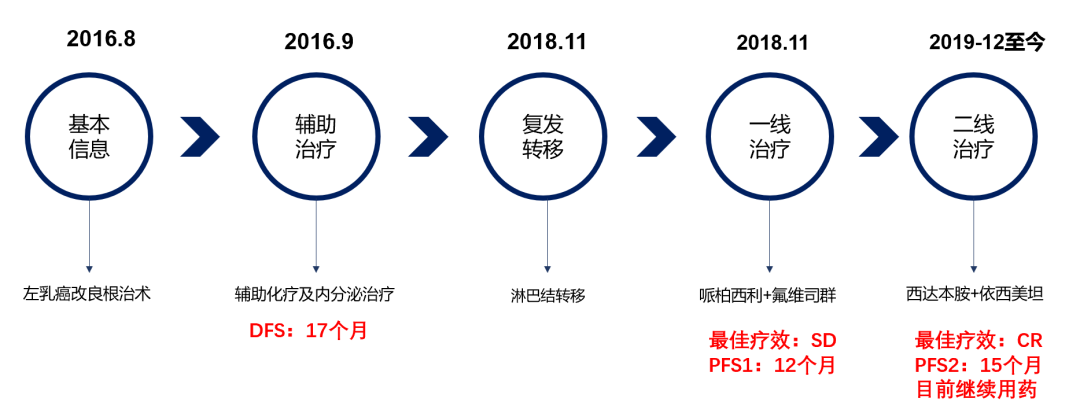
基本情况
患者,女,54岁。
ECOG 1,已绝经,无肿瘤相关家族史。
2016年8月因左乳肿块当地医院行左乳癌改良根治术,术后病理提示:LN1/16,ER(10%+),PR(10%+),Ki-67(70%+),HER-2(2+),FISH(-)。
诊断:左乳浸润性导管癌(部分为乳头状癌) pTxN1M0;Luminal B型。
术后辅助治疗
辅助化疗:2016年9月至2017年6月外院行AC*4-T*4,共化疗8周期。
辅助放疗:未行。
辅助内分泌治疗:2017年6月起开始阿那曲唑内分泌治疗。
首次进展及治疗
2018年11月外院PET-CT:右侧腋窝、右锁骨上及上纵隔多发高代谢淋巴结,考虑转移。右锁骨上淋巴结穿刺病理示:转移性癌,倾向腺癌,ER(15%+),PR(10%+), HER-2(+),Ki-67(70%+)。
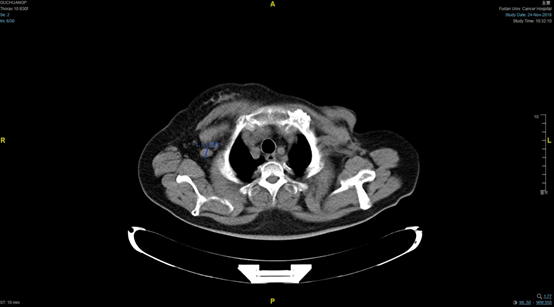
转入我院后行胸部CT示:左乳癌术后,右腋窝、右锁骨区及纵隔淋巴结转移(见图1、图2)。病程中多次复查右乳腺MR未见异常。
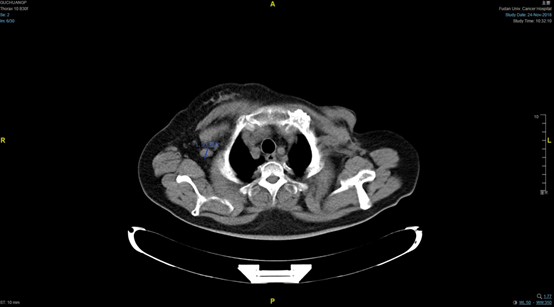
图1. 基线靶病灶:右腋窝淋巴结转移灶(1.5cm)
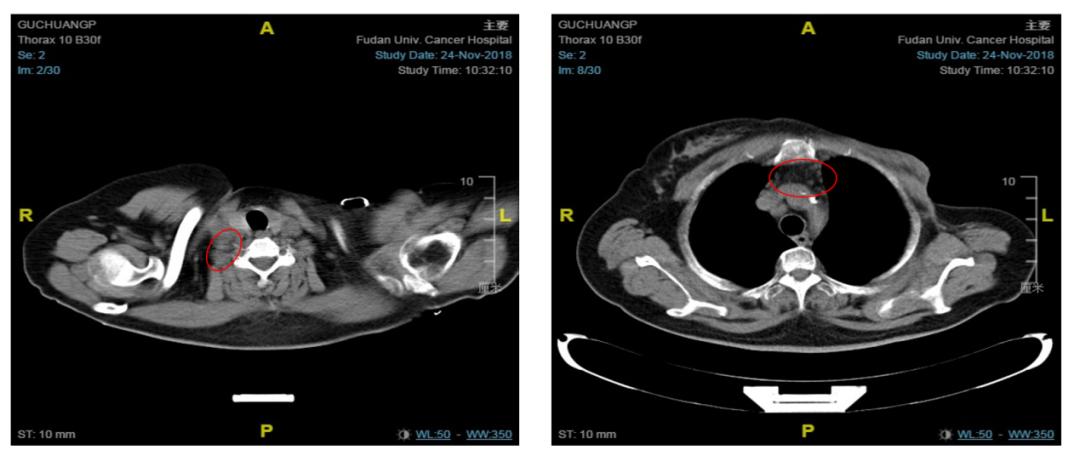
图2. 基线非靶病灶:右锁骨上淋巴结(左),上纵隔淋巴结(右)
诊断:左乳癌术后(pTxN1M1 Ⅳ期),右腋窝、右锁骨上及上纵隔淋巴结转移。
2018年11月27日至2019年12月03日行哌柏西利+氟维司群治疗,开始联合治疗4周期后复查胸部CT示靶病灶右腋窝淋巴结从1.5cm缩小至1.08cm(见图3),非靶病灶右锁骨上淋巴结和上纵膈淋巴结未见明显改变(见图4、图5),疗效评价SD。2019年11月再次复查胸部CT示靶病灶右腋窝淋巴结从1.08cm增大至1.89cm(见图3),非靶病灶右锁骨上淋巴结和上纵膈淋巴结未见明显改变,无内脏转移,疗效评价PD(见图4、图5)。患者治疗过程中不良反应为3级骨髓抑制(HGB),未进行特殊处理。
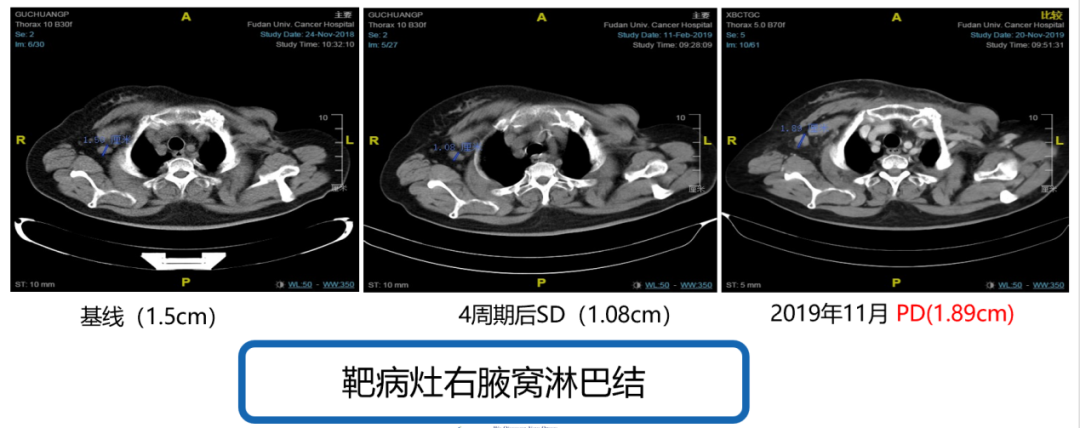
图3. 2018年1月至2019年11月,靶病灶右腋窝淋巴结影像学检查
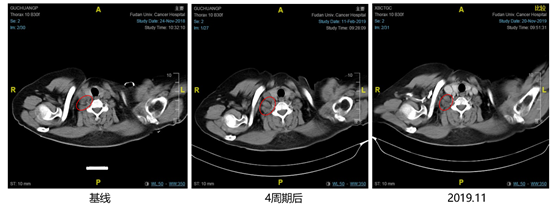
图4. 2018年1月至2019年11月,右锁骨上淋巴结影像学检查
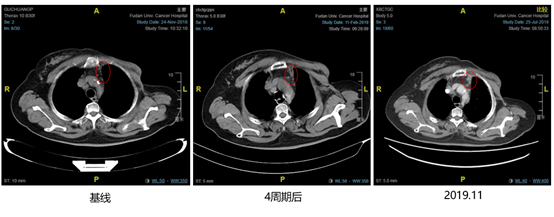
图5. 2018年1月至2019年11月,上纵膈淋巴结影像学检查
二线治疗方案
自2019年11月,患者复查胸部CT示右腋窝淋巴结疾病进展后,2019年12月3日至今行西达本胺(30mg po biw)+依西美坦(25mg po qd),治疗6周期后靶病灶右腋窝淋巴结从1.89cm缩小至0.61cm(见图6),疗效评价PR。2020年12月再次复查胸部CT,靶病灶右腋窝淋巴结缩小至0.41cm(见图6),经测量,全部病理淋巴结(包括靶结节和非靶结节)短直径均减少至<10 mm,疗效评估CR。患者治疗过程中不良反应为1级骨髓抑制(PLT),可耐受,未见严重的血液学不良反应。目前仍在持续获益中。
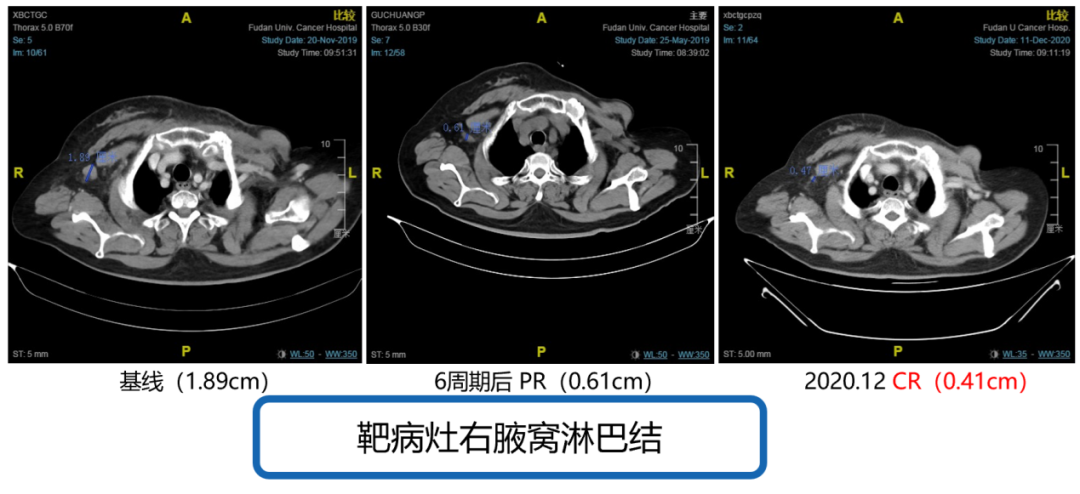
图6. 2019年12月至2020年12月,靶病灶右腋窝淋巴结影像学检查
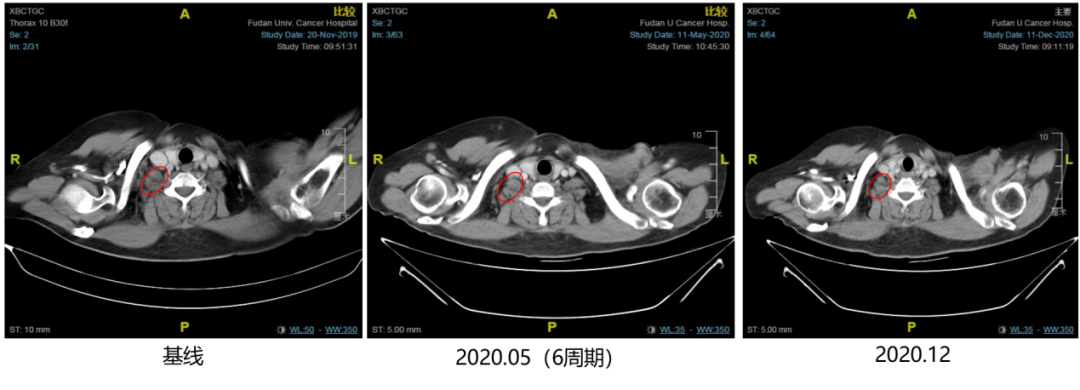
图7. 2019年12月至2020年12月,右锁骨上淋巴结影像学检查
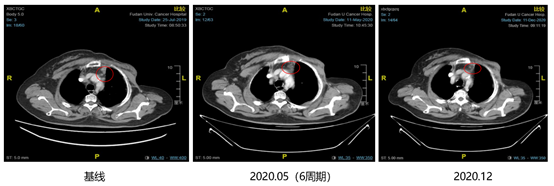
图8. 2019年12月至2020年12月,上纵膈淋巴结影像学检查

王碧芸 教授
复旦大学附属肿瘤医院主任医师,硕士生导师
中国临床肿瘤学会CSCO青委会候任主任委员
中国临床肿瘤学会CSCO乳腺癌专家委员会委员
中国临床肿瘤学会CSCO患教专家委员会常务委员
上海抗癌协会癌症康复与姑息治疗专委会CRPC副主任委员兼秘书长,侯任主委,青委主任委员
上海市抗癌协会乳腺癌专业委员会常务委员
上海市抗癌协会青年理事会常务理事
这是一例首诊早期,后出现复发转移的激素受体阳性(HR+)乳腺癌病例。患者于2016年初次就诊,发病时54岁,已绝经,接受左乳癌改良根治术,术后予以辅助化疗及内分泌治疗,未行辅助放疗。于2018年11月首次复发,表现为右侧腋窝、右锁骨区及纵膈淋巴结转移,DFS 小于2年。复发后分子病理检测为HR+/HER2-,一线治疗接受CDK4/6抑制剂联合氟维司群,12个月后靶病灶右腋窝淋巴结增大,无内脏转移,治疗过程中最佳疗效SD,不良反应为3级骨髓抑制(HGB);二线治疗予以西达本胺+依西美坦,靶病灶右腋窝淋巴结缩小,疗效达到CR,治疗过程中仅出现1级骨髓抑制(PLT),已取得PFS 15个月。在这例患者的治疗过程中,有如下几点值得思考和总结:
1.非甾体类AI治疗失败的患者,一线内分泌治疗联合靶向药物如何选择
根据2020 CSCO乳腺癌诊疗指南,对于HR+晚期乳腺癌,不伴有内脏危象的患者,可以优先选择靶向联合内分泌治疗。在内分泌药物的选择时,可以结合患者既往使用的内分泌药物,治疗敏感性等,选择合适的药物。上述患者在辅助内分泌治疗2年内出现复发进展,且辅助治疗使用的阿那曲唑,根据2020 CSCO BC指南推荐,非甾体类AI治疗失败的患者,可使用HDAC抑制剂联合甾体类AI或者CDK4/6抑制剂联合氟维司群,同为I级 IA类推荐。根据本患者的具体情况和自身意愿等,最终一线治疗选择了CDK4/6抑制剂联合氟维司群,但患者在治疗12个月后即出现了靶病灶腋窝淋巴结增大,最佳疗效仅为SD,同时患者出现了3级骨髓抑制,整体疗效不尽如人意。
2. 一线使用CDK4/6抑制剂进展后,使用西达本胺可延缓和克服耐药,其仍是晚期乳腺癌重要选择
根据临床前研究提示,表观遗传修饰的改变可能会导致抗肿瘤治疗中耐药的发生,包括乳腺癌在内的不同类型癌症的复发。组蛋白修饰是表观遗传调控的重要机制,其异常改变与肿瘤发生发展密切相关,也与肿瘤免疫调节异常、复发密切相关。既往研究证实,口服选择性HDAC抑制剂西达本胺除了阻滞肿瘤的细胞周期、诱导凋亡,增加抗肿瘤细胞免疫活性、改善肿瘤微环境改变等一般性抗肿瘤机制外,还对乳腺癌细胞的激素受体通路、芳香化酶活性、NF-κB通路具有显著抑制作用,与抗激素治疗药物具有明确的机制互补作用。
另一方面,回顾现有的基础与临床研究数据,可发现CDK4/6抑制剂耐药的分子机理非常复杂。首先,CyclinD-CDK4/6-Rb调控轴本身的关键分子异常会导致耐药;其次,细胞周期通路的上游调控因子异常也是常见的耐药原因;然后,Cyclin E过表达也是CDK4/6抑制剂耐药机制之一,等等。其中,细胞周期通路上游调控因子异常,如CiP/KiP家族表达的缺失,包括p21表达缺失是乳腺癌发生CDK4/6抑制剂耐药的机制之一。研究表明,组蛋白去乙酰化酶(HDACs)对p21有抑制作用,而HDAC抑制剂可上调p21表达,激活CDK抑制因子p21,进而增强CDK4/6抑制剂耐药细胞后续联合内分泌治疗的疗效。同时,抑制HDAC可诱导促凋亡蛋白(如Noxa和Bim),与CDK4/6抑制剂产生协同作用,导致细胞凋亡(不依赖p21)。体外试验证实CDK4/6抑制剂联合HDAC抑制剂可恢复CDK4/6抑制剂耐药细胞对药物的敏感性。
总体而言,HDAC抑制剂西达本胺本身可与抗激素治疗协同互补,阻滞肿瘤细胞周期,诱导凋亡。本案例患者使用非甾体类AI辅助内分泌治疗2年内进展,且CDK4/6抑制剂联合氟维司群一线治疗疗效不佳。结合西达本胺的关键III期临床研究ACE和目前临床可选用的方案,CDK4/6抑制剂联合治疗进展后,选择HDAC抑制剂西达本胺联合治疗方案是当前HR+/HER2晚期乳腺癌的重要选择。在患者使用西达本胺联合依西美坦后,右腋窝淋巴结持续缩小,疗效达到CR,且临床耐受性良好,不良反应轻微。目前患者已获得15个月PFS且继续用药中。
参考文献:
1.《CSCO乳腺癌临床诊疗指南2020版》
2. Jiang ZF et al. Tucidinostat plus exemestane for postmenopausal patients with advanced, hormone receptor-positive breast cancer (ACE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2019; 20: 806–15.
3. Zhou Y, Wang YN, Zhang K, et al. Chidamide reverses epidermal growth factor induced endocrine resistance in estrogen receptor-positive breast cancer. J Shenzhen Univ Sci Eng 2018;35: 339–44.
4. Lee J, Lim B, et al. The synergistic antitumor activity of entinostat (MS-275) in combination with palbociclib (PD 0332991) in estrogen receptor-positive and triple-negative breast cancer. Cancer Res 2018;78:P5-21-15-P5-21-15.
5. Zupkovitz G, Grausenburger R, Brunmeir R, et al. The cyclin-dependent kinase inhibitor p21 is a crucial target for histone deacetylase 1 as a regulator of cellular proliferation[J]. Mol Cell Biol. 2010;30(5):1171-81.
6. Pandey K, An HJ, Kim SK, Lee SA, et al. Molecular mechanisms of resistance to CDK4/6 inhibitors in breast cancer: A review. Int J Cancer. 2019 Sep 1;145(5):1179-1188. doi: 10.1002/ijc.32020. Epub 2019 Jan 7.
责任编辑:Jo
排版编辑:Jason
版权声明
版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明。