转自:良医汇-肿瘤医生APP
汇报医生:哈尔滨医科大学附属肿瘤医院 宋英
内分泌治疗是HR+乳腺癌治疗的重要手段,近年来虽然内分泌治疗不断更新发展,但约30%~40%的HR+乳腺癌患者经内分泌治疗后发展成内分泌耐药,导致治疗失败,成为亟待解决的临床困境,在过去,内分泌单药治疗是指南推荐的HR+晚期乳腺癌的一线治疗方案,但随着CDK4/6抑制剂、mTOR抑制剂和HDAC抑制剂等靶向治疗的问世,突破了现有的治疗瓶颈,开启了HR+乳腺癌靶向治疗的新时代。以下带来一例复发的HR+/HER2-内分泌治疗敏感的晚期乳腺癌,患者接受一线化疗序贯内分泌维持治疗,后线化疗、放疗、内分泌治疗及CDK4/6抑制剂靶向治疗进展后,使用西达本胺联合他莫昔芬内分泌治疗,肝脏最大转移灶缩小,目前已经累计超过60个月的临床获益。
哈尔滨医科大学附属肿瘤医院 内三科
黑龙江省医学会淋巴瘤分会委员
黑龙江省医师协会乳腺疾病青年专业委员会委员
黑龙江抗癌药物专业委员会委员
主持省自然科学基金二项,参与完成国家自然科学基金六项
主要从事抗肿瘤领域的临床及研究工作,在肿瘤的综合诊治方面积累近二十年经验,擅长于乳腺癌、恶性淋巴瘤等肿瘤的化疗、生物、靶向、内分泌治疗等,尤其对复发难治性乳腺癌、恶性淋巴瘤的治疗方面能够与国际接轨,积累了丰富的临床经验。
基本情况
患者,女,50岁,2010年无意间发现左乳房肿块于哈尔滨医科大学附属第二医院就诊,行“左乳癌根治术”。
术后病理:左乳浸润性导管癌(部分为粘液癌)II级,肿物面积1.8×1.6cm,LN1/12。
IHC:ER(+++),PR(++),HER2(-),Ki67<10%,P53<5%,syn(-),CD56(-),NSE部分细胞(+),CgA(-)。
术后辅助治疗:
辅助化疗:TEC方案(多西他赛+表柔比星+环磷酰胺)6周期;内分泌治疗:待化疗6周期结束后开始枸橼酸托瑞米芬内分泌治疗。
首次进展及治疗:
2014-08-29 CT提示:左侧肋骨改变,转移瘤不除外;右侧肱骨结节,请结合骨ECT检查;左乳术后改变;右肺结节,左侧胸壁结节,转移瘤待除外,建议复查。行左侧胸壁结节穿刺活检。病理结果:<左胸壁>内见腺癌伴粘液癌组织(结合病史,符合乳腺来源)。IHC:ER(+ 95%)PR(+ 30%),CerbB-2(2+) Ki67约10%,P53(-)。FISH:阴性。
2014年8月开始于我院行TP方案化疗6周期,具体用药:紫杉醇270mg+卡铂600mg。2015年1月初至2月底于我院行左侧锁骨上下区、左侧胸壁及内乳淋巴结针对性放疗25次,DT:50Gy;后左侧胸壁及内乳淋巴结继续放疗5次,DT:60Gy。化疗结束后,予以诺雷德联合来曲唑维持治疗。
二次进展及治疗:
2017年10月,患者左侧胸壁出现包块。2017-10-27行CT提示:左乳术后改变;双肺结节,建议复查;左侧肋骨溶骨性破坏,转移瘤可能,结合临床;多发骨质密度减低,结合临床。
予以放疗共30次,剂量不详,放疗部位为左侧肋骨。内分泌维持治疗改为诺雷德联合依西美坦。
多处转移后治疗史:
2018-09-20复查CT提示:左乳术后改变;双肺结节,建议复查;右侧胸膜多发占位,转移瘤可能;肝囊肿;骨多发转移瘤。
化疗:NX方案2周期(酒石酸长春瑞滨 40mg+卡培他滨 1.5g bid)→疾病进展→GP方案2周期(吉西他滨1.6g+卡铂600mg)→疾病进展→TP方案6周期。
放疗:2019年03月于我院门诊行放疗,共20次,剂量不详,放疗部位为:双侧后肋、T11、骶骨转移灶。内分泌治疗:2019年03月开始诺雷德联合氟维司群维持治疗。
2019-09-20复查CT提示:左乳术后改变;双肺多发小结节,建议复查;双侧胸膜多发占位,倾向转移瘤;多发骨转移瘤;肝内多发结节,转移瘤待除外,建议增强检查;右颈部淋巴结肿大。疗效评估为PD。
化疗:2019年10月于我院行AC方案2周期(盐酸表柔比星140mg+环磷酰胺0.9g)→PD→口服依托泊苷胶囊化疗。
2019.11-2020.2,患者口服依托泊苷胶囊期间出现IV骨髓抑制等副反应,停用依托泊苷,换用CDK4/6抑制剂哌柏西利治疗,3个月后PD。
后线治疗:
2020年2月因疾病进展,改口服西达本胺(30mg biw)联合他莫昔芬(10mg qd)方案治疗。
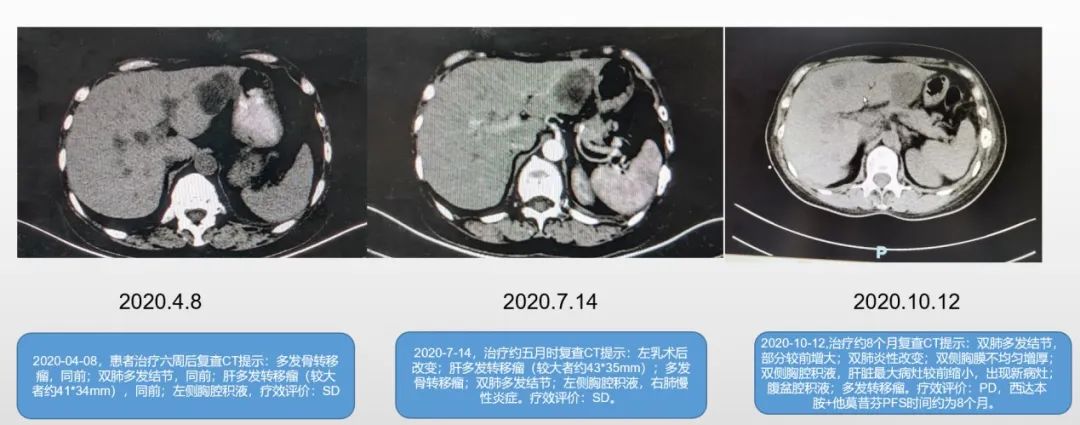
2020-04-08,患者治疗6周后复查CT提示:多发骨转移瘤,同前;双肺多发结节,同前;肝多发转移瘤(较大者约41*34mm),同前;左侧胸腔积液,疗效评价:SD。
2020-7-14,治疗约5月时复查CT提示:左乳术后改变;肝多发转移瘤(较大者约43*35mm);多发骨转移瘤;双肺多发结节;左侧胸腔积液,右肺慢性炎症。疗效评价:SD。
2020-10-12,治疗约8个月复查CT提示:双肺多发结节,部分较前增大;双肺炎性改变;双侧胸膜不均匀增厚;双侧胸腔积液,肝脏最大病灶较前缩小,出现新病灶;腹盆腔积液;多发转移瘤。疗效评价:PD,西达本胺+他莫昔芬PFS时间约为8个月。
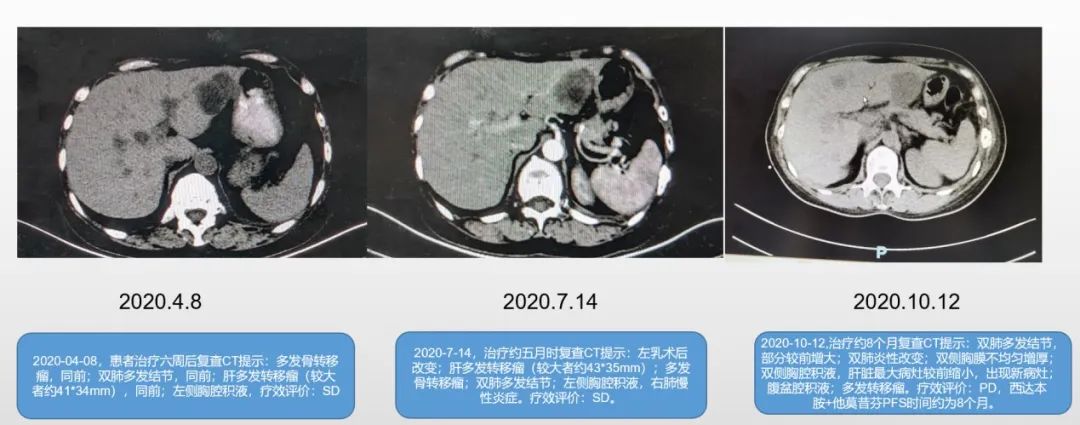
图1:2020.4.8-2020.10.12,三次CT复查影像
患者服用西达本胺主要不良反应为:头晕、乏力,可耐受;未发生严重血液学不良反应。
总结:
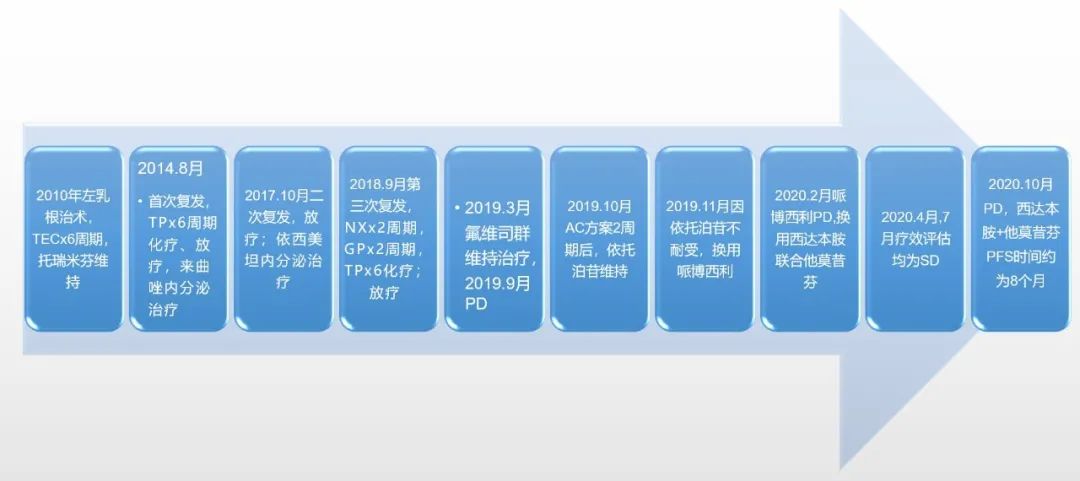
图2:患者的治疗历程总结
黑龙江省肿瘤防治研究所所长
哈尔滨医科大学附属肿瘤医院副院长
肿瘤学国家重点专科带头人
国家百千万人才工程入选者
国家突出贡献中青年专家
中国抗癌协会淋巴瘤专业委员会候任主任委员
中国抗癌协会化疗专业委员会副主任委员
中国抗癌协会乳腺癌专业委员会常委
中国临床肿瘤学会(CSCO)乳腺癌专家委员会副主任委员
专家点评
这是一例首诊早期,后出现复发转移的HR+乳腺癌。患者初次发病为2010年,发病时50岁,女性,接受乳腺癌根治术,术后予以辅助化疗,内分泌治疗维持。于2014年首次复发,表现为骨转移、肺转移、胸壁淋巴结转移,DFS 4年左右。复发后分子病理检测为HR+/HER2-晚期乳腺癌,接受一线化疗、放疗序贯来曲唑内分泌维持治疗,取得PFS1 38个月;二线接受放疗及依西美坦治疗,取得PFS2 11个月;三线治疗选择化疗、放疗后,疾病继续进展,使用放疗联合氟维司群维持治疗6个月后,出现肝脏转移,遂更改为化疗,但由于口服依托泊苷出现严重的骨髓抑制等不良反应,换用哌柏西利治疗,3个月后出现疾病进展;后线治疗使用西达本胺联合他莫昔芬,肝脏转移灶缩小,已取得PFS 8个月,总计延长PFS超过 60个月。总体而言,这是1例HR+内分泌敏感的乳腺癌患者,在多线治疗使用CDK4/6抑制剂3个月进展后,使用西达本胺联合内分泌治疗已取得了8个月PFS,且整体耐受可。在这例患者的治疗过程中,有如下几点值得总结和思考:
(一) HR+绝经后复发性晚期患者,一线治疗选择
2020 CSCO乳腺癌临床诊疗指南中指出,对于HR+晚期乳腺癌,肿瘤缓慢进展,且无内脏危象的患者,可以首选一线内分泌治疗。关于晚期内分泌治疗方案的选择,需考虑患者的辅助治疗方案,无病间期,复发/转移的疾病负荷选择治疗方案。上述患者首次诊断时为早期乳腺癌,接受手术和辅助化疗,内分泌维持治疗,术后4年出现首次复发,复发表现为肋骨转移、肺转移和胸壁淋巴结转移,没有严重危及生命的内脏转移,因此可以考虑一线内分泌治疗。患者最终选择一线化疗和局部放疗,序贯内分泌治疗维持,取得了38个月的PFS,临床疗效值得肯定。
(二) 一线化疗序贯内分泌治疗后进展,二线治疗如何选择?
考虑到患者仅胸壁淋巴结有所增大,余病灶未见明显进展,一线内分泌治疗相对敏感,二线治疗可以予以局部放疗并继续使用内分泌治疗。因此,根据疾病状况综合考虑,患者接受了依西美坦内分泌治疗,取得了11个月的PFS2。
(三) 多线内分泌治疗进展后,治疗方案如何选择?
从HR+乳腺癌内分泌治疗的发展历程来看,内分泌联合靶向药物已经成为当下的研究趋势。可以说,HR+晚期乳腺癌已经进入了内分泌治疗+时代,如内分泌治疗联合mTOR抑制剂、CDK4/6抑制剂和HDAC抑制剂。患者因二线治疗后,胸膜出现多发转移灶,予以化疗、放疗和氟维司群维持治疗后,合并出现肝转移等多个部位转移,为快速控制病灶继续选择化疗,但因为出现严重的骨髓抑制,更改为CDK4/6抑制剂哌柏西利治疗,但仅仅3个月后就出现了疾病进展。考虑到HDAC抑制剂(西达本胺)作为一种表观遗传调控剂,临床前研究提示表观遗传修饰的改变可能会导致耐药性的发展和包括乳腺癌在内的不同类型癌症的复发。既往研究证实,口服选择性HDAC抑制剂西达本胺除了抑制肿瘤细胞周期、诱导凋亡、增加抗肿瘤细胞免疫活性、诱导肿瘤微环境改变等一般性抗肿瘤机制外,还对乳腺癌细胞的激素受体通路、芳香化酶活性、NF-κB通路具有显著抑制作用,与抗激素治疗药物具有明确的机制互补作用。因此,西达本胺在体内起作用的过程,并不特别依赖具体内分泌药物的种类。值得一提的是,由江泽飞教授牵头,中国多个中心参与的ACE研究,在HR+/HER2-晚期乳腺癌患者中评估了西达本胺联合依西美坦的临床疗效和安全性。研究结果显示,西达本胺联合依西美坦治疗组的PFS明显优于安慰剂联合依西美坦组。总体人群中,研究者评估的西达本胺组中位PFS是7.4个月,而安慰剂组为3.8个月(HR=0.75;95%CI:0.58-0.98;P=0.033)。研究者评估的次要研究终点分析显示,西达本胺联合依西美坦组的ORR为18%,优于对照组的9%(P=0.026);同时,西达本胺联合依西美坦组的CBR为47%,优于对照组的36%(P=0.034)。基于这一研究结果,上述患者在CDK4/6抑制剂治疗进展后,且已多次选用AI类药物,可能已经发生耐药。因此,患者选择了西达本胺+他莫昔芬联合治疗,取得持久的疗效,肝脏转移病灶持续缩小,PFS达到了8个月,且临床耐受性良好,不良反应轻微。目前,患者病情进展,可以考虑在现有靶向治疗的基础上,进行进一步的优化,如可以开展多学科讨论,探讨是否需要在此时追加局部治疗,如手术或放疗,对局部复发病灶进行处理。
1. 《CSCO乳腺癌临床诊疗指南2020版》
2. Jiang ZF et al. Tucidinostat plus exemestane for postmenopausal patients with advanced, hormone receptor-positive breast cancer (ACE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2019; 20: 806–15.
3. Wander SA et al. Genetics to epigenetics: targeting histone deacetylases in hormone receptor-positive metastatic breast cancer. Lancet Oncol. 2019 Jun;20(6):746-748.
排版编辑:Frank