

外周T细胞淋巴瘤(PTCL)是一种异质性很强的侵袭性非霍奇金淋巴瘤(NHL), 临床预后较差,复发/难治性(R/R)PTCL的反应率和预后更是不容乐观。在世界范围内,有几种新药被批准用于治疗R/R PTCL,直到2020年,BV单抗和普拉曲沙才正式在中国获批,因此,2015年获批用于R/R PTCL的西达本胺逐渐成为应用最广泛的PTCL靶向治疗药物。

中山大学附属肿瘤医院蔡清清教授课题组进行了一项回顾性分析报道了本中心治疗R/R PTCL患者的预后,并比较了含西达本胺方案对比化疗的疗效,以了解含西达本胺方案是否带来PFS的获益及如何干预PTCL的治疗结局。
该研究回顾性分析了2009年7月至2020年8月在中山大学肿瘤防治中心接受治疗的96例R/R PTCL患者的临床数据。纳入既往接受过一线治疗的R/R PTCL患者以及给予化疗(ChT)或西达本胺+ ChT或西达本胺±其他靶向药物(靶向治疗)作为二线治疗,考虑疾病特征和治疗标准的显著不同,除结外鼻型NK/T细胞淋巴瘤、蕈样霉菌病、S´ezary综合征和T细胞早幼粒细胞白血病外,所有PTCL亚型均被纳入。纳入分析患者根据二线治疗方法分为三组:(a)常规化疗(ChT)组42例;(b)西达本胺+ChT组37例;(c)西达本胺±其他靶向治疗(靶向治疗组)17例。总体患者的中位年龄57岁、平均二线治疗IPI评分为2分。最常见的二线化疗方案包括铂类药物(27.1%)、甲氨蝶呤(24.0%)或吉西他滨(22.9%)方案;与西达本胺联合的靶向药物有PD-1抗体、来那度胺和沙利度胺;研究的主要终点是PFS,次要终点是OS、ORR和CR率。该研究于2021年9月在线发表于《Leukemia Research》杂志上[1]。

1.反应率和生存结果
化疗组、西达本胺+化疗组、西达本胺±靶向治疗组的ORR分别为54.8%、64.9%、64.7%(p=0.607),CR分别为16.7%、18.9%、35.3%(p=0.303)。在使用含西达本胺方案治疗的患者中,AITL亚组的ORR高于PTCL-NOS亚组(70.6% vs 61.1%),这可能与AITL中表观遗传调控的重要作用有关。
中位随访13.5个月,三组的中位PFS分别是3.5个月、4.5个月、1.8个月,1年PFS分别是14%、31%、12%,1年OS分别是60%、63%、51%。西达本胺+化疗组患者的PFS较其他两组有显著优势(p = 0.046)。
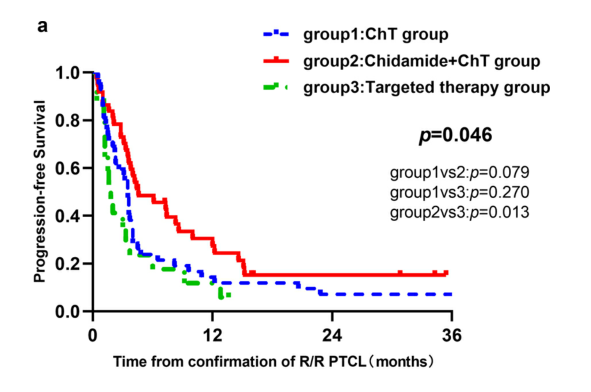
2.二线西达本胺联合化疗方案为中高危PTCL患者带来PFS获益
在二线IPI 3-5分患者中,西达本胺+化疗组患者的PFS显著高于化疗组(p=0.018),由于靶向治疗组例数较少,与靶向治疗组无明显差异(p=0.200)。
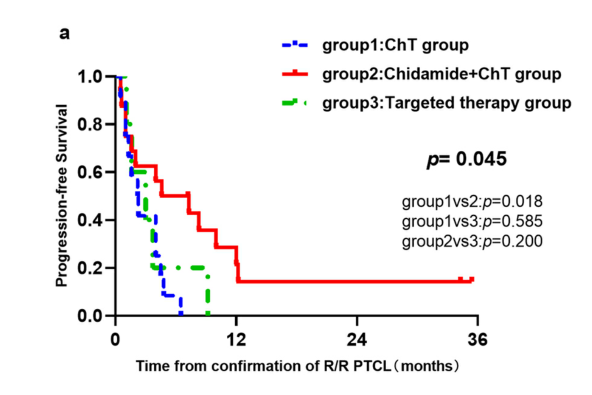
3.西达本胺联合化疗为CD30阴性患者带来PFS获益
在CD30阴性的患者中,西达本胺+化疗组患者的PFS显著优于化疗组(p<0.001)。
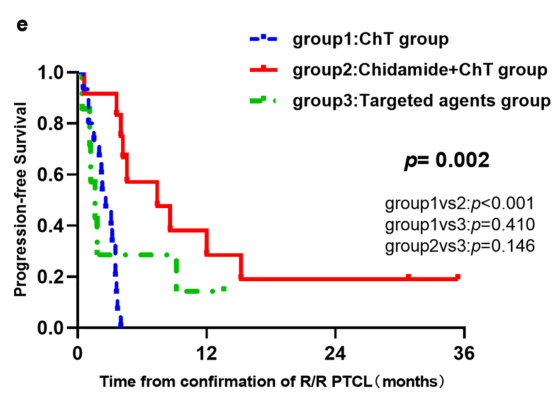
4.不良反应发生率无明显差异
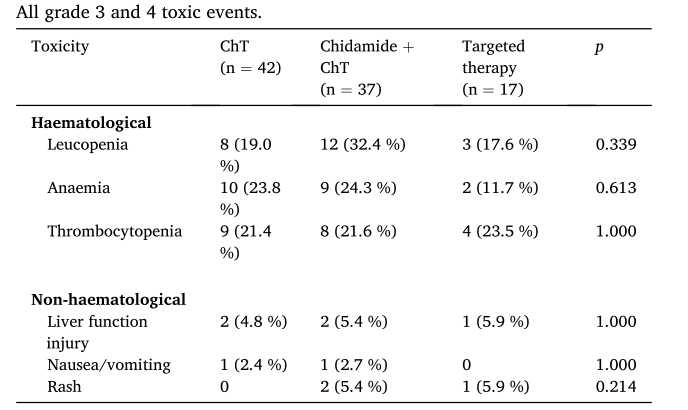
三组患者发生常见的3/4级以上的血液学反应(包括贫血、白细胞减少、血小板减少)、3/4级以上的非血液学反应(包括肝功能损害、恶心/呕吐、皮疹),均无显著性差异。







马军 教授
表观遗传治疗是一种独特类型的靶向治疗,它不同于化疗和传统靶向治疗,而是靶向肿瘤发生、发展的全部特征性过程。
HDACi西达本胺选择性抑制Ⅰ类HDAC中的1、2、3亚型和Ⅱb类的10亚型,通过增加染色质组蛋白的乙酰化水平,引发染色质重塑,导致针对多条信号转导通路基因表达的改变,同时对机体细胞免疫具有整体调节活性,可诱导和增强NK细胞和抗原特异性细胞毒性T细胞介导的肿瘤杀伤作用。西达本胺还可通过表观遗传学调控机制诱导肿瘤干细胞分化、逆转肿瘤细胞的上皮间质转化(EMT)等,在恢复耐药肿瘤细胞对药物的敏感性和抑制肿瘤转移、复发等方面具有潜在作用[2]。
既往研究显示,西达本胺在R/R PTCL中表现出显著的单剂活性和良好的耐受性[3]。越来越多的研究显示,西达本胺在血液肿瘤和实体瘤均显示出与化疗、不同靶向治疗和免疫治疗药物的协同效应,发挥克服耐药性的作用[3,4]。蔡清清教授团队的回顾性研究,提示西达本胺联合化疗可在化疗的基础上进一步带来获益,对于PTCL治疗有现实意义,但现阶段仍需要进一步扩大样本量的随机对照研究明确生存获益。同时,除联合化疗外,以HDACi为基础不同机制的联合治疗将更多的应用于PTCL的治疗探索,为不同阶段PTCL患者提供更优的治疗选择。
蔡清清 教授
我中心研究结果显示,相比单纯化疗及含西达本胺的靶向治疗,西达本胺联合化疗作为二线治疗方案带来更多PFS获益,尤其是在IPI高分患者和CD30阴性患者中显著获益,为解决PTCL临床难题提供有力选择。同时,我中心在初治PTCL人群中使用含西达本胺方案对比传统CHOP方案的相关数据也提示,西达本胺的引入带来PFS的显著获益。如何布局HDACi在PTCL治疗中的应用,结合现有治疗手段,进一步提高有效率及延长疾病控制时间,为患者带来更高质量的生存,是我们进一步思考的方向。同时,本研究也存在一定局限。首先并未研究ASCT在二线治疗中的作用;其次,PTCL发病率较低,这项回顾性研究是单中心数据,因此样本量很小;最后,在非随机和观察性研究中,存在对混杂变量的固有易感性,如医生和患者的偏好。







[1] https://doi.org/10.1016/j.leukres.2021.106705
[2] LuX, NingZ, LiZ,et al. Development of chidamide for peripheral T-cell lymphoma,the first orphan drug approved in China[J]. Intractable Rare Dis Res,2016,5(3):185-191.
[3] Chan TS, Tse E, Kwong YL. Chidamide in the treatment of peripheral T-cell lymphoma. Onco Targets Ther. 2017 Jan 12;10:347-352. doi: 10.2147/OTT.S93528. PMID: 28138258; PMCID: PMC5238768.
[4] Cao L, Zhao S, Yang Q, Shi Z, Liu J, Pan T, Zhou D, Zhang J. Chidamide Combined With Doxorubicin Induced p53-Driven Cell Cycle Arrest and Cell Apoptosis Reverse Multidrug Resistance of Breast Cancer. Front Oncol. 2021 Mar 2;11:614458. doi: 10.3389/fonc.2021.614458. PMID: 33738256; PMCID: PMC7962870.
[5] Y. Zhou, et al., Non-toxic dose chidamide synergistically enhances platinum-
induced DNA damage responses and apoptosis in Non-Small-Cell lung cancer cells,
Biomed. Pharmacother. 68 (4) (2014) 483–491

苏州大学附属第一医院血液团队最新发表复发难治AML研究结果:双表观方案为复发/难治AML治疗另辟蹊径


