肝细胞癌(以下简称肝癌)是常见的恶性肿瘤之一,我国每年新发病例数占全世界病例数的55%[1-2]。肝癌的发病率和病死率均高居我国<60岁男性恶性肿瘤的首位[3-4]。肝癌起病隐匿,进展快,常合并严重肝硬化,易发生肝内、外转移,因此,大多数肝癌患者确诊时已失去手术治疗机会。肝癌合并肝硬化是肝移植的主要适应证之一,肝移植是目前治疗终末期肝病最有效的根治性方法。根据中国肝移植注册中心(CLTR)数据显示:近5年我国肝癌肝移植例数占移植总例数的37.1%,远超美国的18.5%~35.0%,但肝移植术后患者肝癌复发仍是目前需要面临的严峻挑战[5]。有研究结果显示:尽管根据肝移植标准精准选择受者,但肝移植术后肝癌5年复发率仍高达30%[6-7]。影响肝移植术后肝癌复发的因素众多,除原发肿瘤外,移植术后免疫抑制药物钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)的使用被认为是肝癌复发的独立危险因素[8-9]。因此,肝癌肝移植中免疫抑制剂的使用应在有效抑制排斥反应的同时尽可能减少剂量,以避免肿瘤复发。雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂给肝癌肝移植受者带来新选择。mTOR抑制剂不仅能预防排斥反应,同时能有效抑制肿瘤细胞生长[10]。近年来,国内外使用包含mTOR抑制剂免疫抑制方案移植受者的比例逐渐增多,目前的免疫抑制方案主要包括西罗莫司和依维莫司等。本文针对中国肝移植受者中使用较多的西罗莫司方案进行经验总结。
2006年,国内学者报道西罗莫司用于肝癌肝移植的初步经验[11]。美国国家器官获取和移植网络/移植受者科学登记处(OPTN/SRTR)2017年数据结果显示:肝移植主要免疫抑制剂方案为他克莫司+霉酚酸酯+糖皮质激素(59.7%),移植后初始使用西罗莫司方案的比例仅为1.1%,移植1年后增加至8.3%[12]。CLTR 2019年数据结果显示:中国肝移植受者术后使用西罗莫司方案的比例为12.6%,其中肝癌肝移植受者使用西罗莫司方案的比例为26.4%,显著高于良性肝病肝移植受者的4.6%[13]。由于西罗莫司具有抗肿瘤作用,且较CNI类药物对肾功能影响更小,因此,目前西罗莫司主要应用于肝移植术后出现肾功能异常、不可耐受CNI类药物不良反应以及存在肿瘤复发风险的受者,其能够改善部分CNI导致的肾功能异常并缓解CNI类药物的不良反应[14-15]。2015年欧洲肝脏研究学会(EASL)发布的《肝移植临床实践指南》指出:肝移植受者使用西罗莫司方案,安全、可行,其能在提供足够免疫抑制的同时,不增加排斥反应、移植物功能丧失或感染的发生率[16]。在此基础上,中国医师协会器官移植医师分会肝移植学组、中华医学会器官移植学分会肝移植学组组织国内经验丰富的相关领域专家,经过反复论证,共同制订《西罗莫司在肝癌肝移植中应用的中国专家共识(2020版)》,旨在为从事肝癌肝移植的临床医师提供理论依据,促进其临床工作规范、有序地开展。
与CNI类药物比较,西罗莫司治疗肝癌肝移植受者有以下临床作用。
西罗莫司通过与免疫嗜素FKBP12结合抑制哺乳动物mTOR活性,从而抑制IL-2驱动的T细胞增殖,具有较强的免疫抑制作用[17]。西罗莫司不仅能抑制效应T细胞增殖,还可通过促进调节性T细胞产生诱导受者免疫耐受,减轻排斥反应。有研究结果显示:CNI方案转换为西罗莫司方案能增加肝移植受者调节性T细胞、调节性树突状细胞和免疫调节相关蛋白的产生,促进免疫抑制剂使用的最小化或停用,与其他免疫抑制剂比较,单用西罗莫司方案的受者耐受性较好且短期随访并发症较少[18-19]。
西罗莫司由肠壁和肝脏中的CYP3A4同工酶代谢,大部分(91%)经粪便排泄,仅少量(2.2%)经尿液排泄。肝移植术后因使用CNI类药物致肾功能损害的受者,可转换为西罗莫司方案,其能在不同程度上改善患者肾功能[14,20]。但西罗莫司不适用于有重度高血压病和微量蛋白尿的患者,其可能会加重上述疾病[21]。
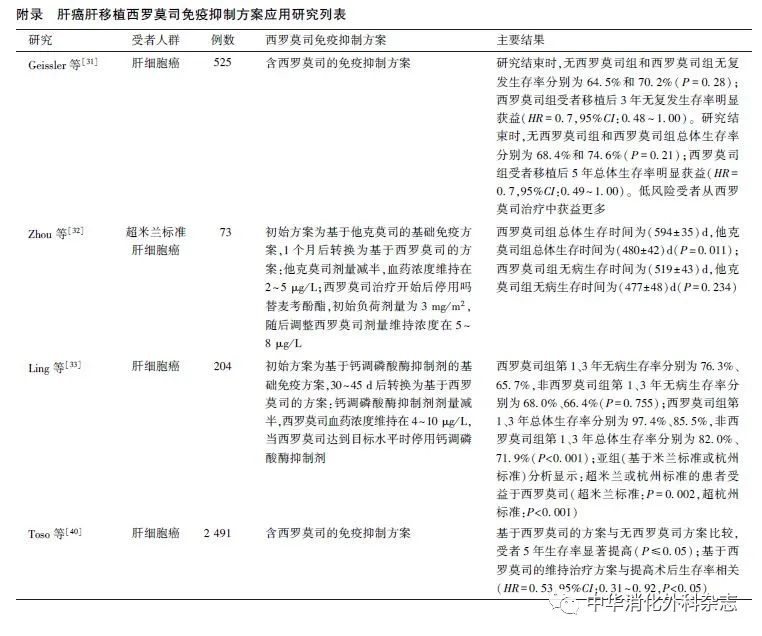
PI3K/Akt/mTOR通路是调控细胞增殖、凋亡的关键信号通路,其异常激活与肿瘤发生、发展密切相关。肝癌中,mTOR通路的异常激活率为15%~41%[22-24]。抑制mTOR活性不仅可直接抑制肿瘤细胞增殖,也能通过抑制血管内皮细胞生长、降低其对VEGF反应活性,从而抑制血管生成,间接发挥抗肿瘤作用[25]。此外,西罗莫司还可通过干扰血管内皮细胞内VEGF介导的相关通路,抑制其增殖与迁移,并通过诱导大量肿瘤血管特异性微血栓形成抑制肿瘤生长[26-27]。因此,针对PI3K/Akt/mTOR通路异常活化肝癌,西罗莫司的疗效尤为显著[22]。已有多项临床研究结果显示:西罗莫司能有效降低肝移植术后肿瘤复发率,延长患者无复发生存时间[21,28-30]。Geissler等[31]的研究结果显示:与无西罗莫司的方案比较,以西罗莫司为基础免疫抑制方案的患者第1、3年无复发生存率获益显著(P≤0.049 9),第1、4、5年总体生存率获益显著(P≤0.047 9),西罗莫司可改善肝癌肝移植受者,尤其是低风险受者的预后;进一步的亚组分析结果显示:与年龄>60岁或超米兰标准的受者比较,年龄≤60岁或符合米兰标准的受者获益更为显著。这说明西罗莫司的抗癌特性为在早期阶段减缓相对“幼稚”肿瘤的发展。此外,国内部分研究结果显示:对于超米兰标准的肝癌肝移植受者,西罗莫司仍可能使其受益[32-33]。
西罗莫司降低心血管事件发生率。西罗莫司能抑制血管平滑肌细胞增殖,抑制血管病灶处巨噬细胞及其他免疫细胞活性,具有一定程度的心脏保护作用。有研究结果显示:西罗莫司可能通过抑制整合素链激酶表达,进而抑制晚期糖基化终末产物诱导的血管平滑肌细胞向成骨样细胞表型分化及血管平滑肌细胞增殖,从而降低心血管疾病发生率[34-35]。此外,活化mTOR信号通路还与代谢性疾病如糖尿病、肥胖症等相关,而长期应用西罗莫司可通过阻断mTORC1通路减轻肥胖症状,改善血糖[36-37]。
基于西罗莫司抗细胞增殖和抗肿瘤血管生成等作用机制,其能够降低肝癌肝移植术后肿瘤复发率,且不增加排斥风险,尤其是符合米兰标准的低风险受者,在3~5年内能明显获益[16]。《中国肝癌肝移植临床实践指南(2018版)》明确指出:肝癌肝移植受者应用西罗莫司为代表的mTOR抑制剂可减少术后肿瘤复发和转移[38]。
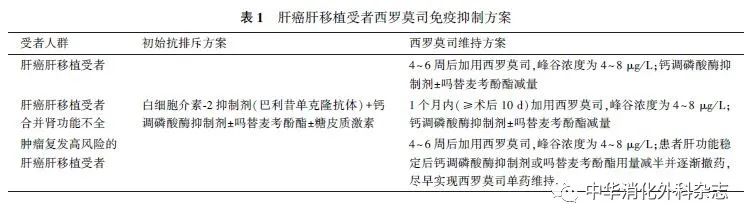
肝癌肝移植术后,激素与CNI类药物的使用是肿瘤复发的危险因素[39]。《中国肝癌肝移植临床实践指南(2018版)》建议:肝癌肝移植受者可采用低剂量CNI+糖皮质激素早期撤除或无糖皮质激素免疫抑制方案[38]。因此,对于肝癌肝移植受者,应避免CNI与激素的高暴露,建议术后使用西罗莫司作为基础免疫抑制剂方案,若单药维持免疫强度不足,可联合其他免疫抑制剂进行抗排斥治疗,如采用低剂量CNI+西罗莫司的联合方案。见表1。
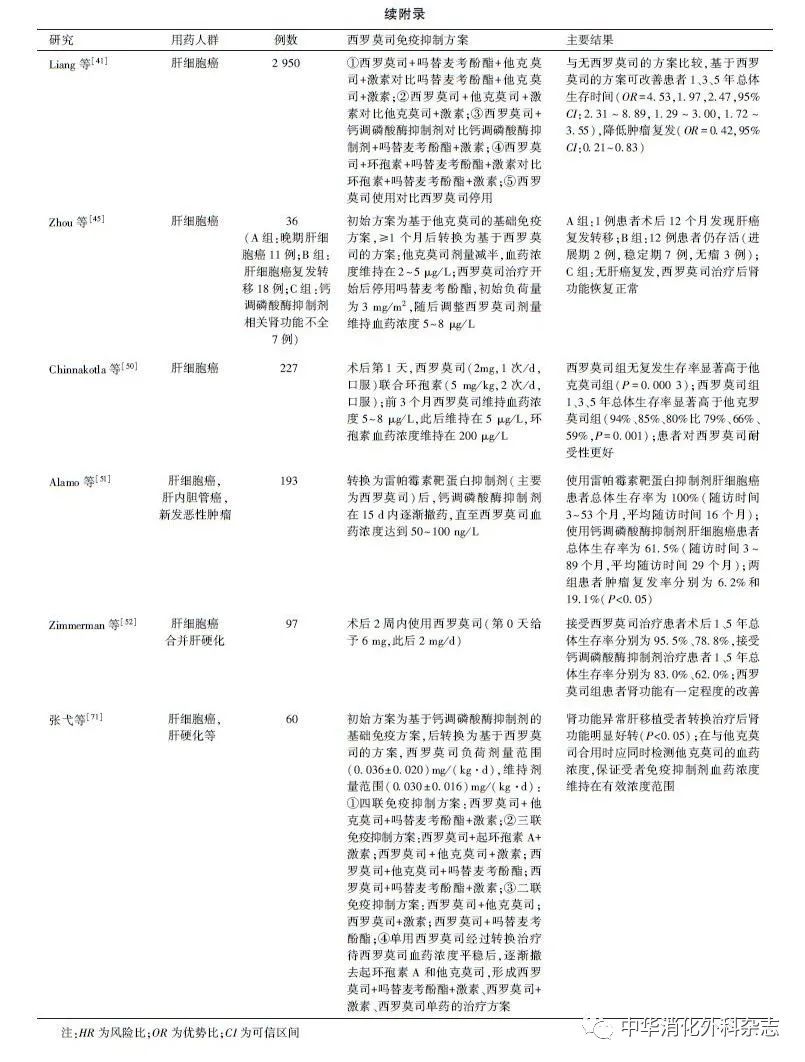
2.1.1 低剂量CNI+西罗莫司联合方案:多项研究结果显示使用以西罗莫司为基础免疫抑制方案的肝癌肝移植受者术后总体生存率及长期无复发生存率均高于使用以CNI为基础方案的受者[28,40-42]。尽管Geissler等[31]的研究结果显示:使用西罗莫司方案的受者在3~5年获益最为显著,其远期(>5年)预后与使用CNI方案的受者比较,差异无统计学意义。但西罗莫司方案长达5年的获益窗口仍使其成为肝癌肝移植受者免疫抑制方案的重要选择之一。此外,有研究结果显示:西罗莫司早期使用可能会导致剂量依赖性伤口愈合延迟等不良反应风险增加,单药治疗可能会导致排斥反应发生率增加[43-44]。根据上述西罗莫司的特点,多数移植中心采用在移植术后4~6周转换为西罗莫司联合低剂量CNI免疫抑制方案,该方案较早期转换更为稳定,不良反应更少且排斥率更低。综上,多数学者建议:肝癌肝移植受者术后的抗排斥方案为:初始使用IL-2抑制剂(巴利昔单克隆抗体)+CNI类药物±吗替麦考酚酯±糖皮质激素的抗排斥方案,4~6周后加用西罗莫司,负荷剂量为1~3 mg/m2,维持剂量为1~3 mg/d,同时CNI类药物±吗替麦考酚酯减量,维持西罗莫司峰谷浓度为4~8 μg/L [45-47](表1)。但也有部分中心有移植术后早期(2~4周)转换为西罗莫司方案并实现受者获益,且无明显不良反应的经验。
多项西罗莫司转换治疗后对肾小球滤过率改善研究的结果显示:在肾功能损害患者中,CNI转换西罗莫司治疗后可显著改善肝移植术后受者肾功能,且安全性较好[15,48-49]。因此,合并肾功能异常的肝癌肝移植受者,可尽早联合使用西罗莫司。目前的临床经验显示:合并肾功能不全的肝癌肝移植受者术后抗排斥方案为:初始使用IL-2抑制剂(巴利昔单克隆抗体)+CNI类药物±吗替麦考酚酯±糖皮质激素的抗排斥方案,1个月内(≥术后10 d)加用西罗莫司,负荷剂量为1~3 mg/m2,维持剂量为1~3 mg/d,同时CNI类药物±吗替麦考酚酯减量,维持西罗莫司峰谷浓度为4~8 μg/L[40-41,50-52](表1)。
2.1.2 西罗莫司单药维持方案:Zhou等[32]针对超出米兰标准的肝癌肝移植受者,术后1个月起加用西罗莫司,同时他克莫司剂量减半,待西罗莫司达目标浓度后,他克莫司逐渐撤药,其研究结果显示:西罗莫司单药维持与他克莫司单药维持比较,患者总体生存时间显著延长[(594±35)d比(480±42)d,P=0.011],移植后肿瘤复发率显著降低。Ling等[33]纳入204例肝癌肝移植受者开展研究,其中76例在术后30~45 d转换为西罗莫司单药维持方案,其结果显示:对于超米兰标准或超杭州标准的受者,西罗莫司均能使总体生存率显著获益(P<0.001),而标准内受者未能获益。Geissler等[31]的研究结果也显示:肝癌肝移植受者西罗莫司单药组的无复发生存率和总体生存率均高于联合用药组(无复发生存率82.9%比68.2%;总体生存率85.4%比72.3%)。
基于上述研究及部分中心的实际临床经验,肝癌肝移植受者在常规使用IL-2抑制剂(巴利昔单克隆抗体)+CNI类药物±吗替麦考酚酯±糖皮质激素的初始免疫抗排斥方案4~6周后,可加用西罗莫司,其负荷剂量为1~3 mg/m2,维持剂量为1~3 mg/d,峰谷浓度为6~10 μg/L,同时CNI类药物或吗替麦考酚酯用量减半并逐渐撤药,1~6个月后实现西罗莫司单药维持(表1)。对于超米兰标准或已经出现肝癌复发或转移的受者,在肝功能稳定情况下,免疫抑制方案建议完全转换为西罗莫司单药维持[53]。但是有研究结果显示:西罗莫司单药维持方案与传统CNI方案比较,急性排斥反应发生率明显增加,因此,能否选择西罗莫司单药维持方案仍需更多的临床研究[43]。
肝癌的发生、发展与细胞中信号通路的活性改变密切相关,抑制相关信号通路已成为肿瘤靶向治疗的热点[54]。有研究结果显示:结合抗肿瘤药物与基因靶点(PTEN、TSC1/2、KRAS、PIK3CA等)治疗肝癌肝移植受者,并以此为依据选择免疫抑制剂可使肿瘤患者得到更好的临床获益[55-56]。Gulhati等[57]的研究结果显示:同时存在KRAS和PIK3CA突变的结直肠癌对雷帕霉素或索拉非尼单药治疗部分敏感,但对雷帕霉素和索拉非尼联合治疗高度敏感,联合索拉非尼可使雷帕霉素诱导细胞凋亡,抑制结直肠癌进展的疗效增强。
西罗莫司虽具有抗肿瘤作用,但需要与其他靶向药物联合使用才有较好的疗效。西罗莫司与抗肿瘤药物联用的基本前提为:两种药物毒性不重叠、抗肿瘤作用机制不相同且具有协同作用。Wang等[58]利用小鼠原位肝癌模型首次验证雷帕霉素与索拉非尼联合治疗的疗效,其研究结果显示:联合治疗能显著抑制肿瘤生长与转移。Gomez-Martin等[53]对西罗莫司联合索拉非尼治疗肝移植术后肝癌复发患者进行研究,其结果显示:西罗莫司与分子靶向药物索拉非尼有协同抗肿瘤作用,对于高风险患者,可以考虑在转换西罗莫司为基础的抗排斥方案同时,联用索拉非尼等分子靶向药物预防肝癌复发。此外,相关的动物试验结果显示:西罗莫司与抗肿瘤药物西妥昔单克隆抗体、司美替尼、贝伐珠单克隆抗体和硼替佐米等联合治疗肝癌可能是一种有前景的肝癌治疗方案[53,59-62]。
西罗莫司作为mTOR抑制剂,在肝癌肝移植中存在相应的不良反应[39-40,63]。
高脂血症在肝移植受者中发生率为7.69%~50.00%[64]。通过改变生活习惯,如给予低脂饮食以及加强运动通常可改善。必要时可使用阿托伐他汀和辛伐他汀类药物进行降脂治疗。受者严重高脂血症时建议换用其他免疫抑制药物。
血细胞减少在肝移植受者中发生率为13.38%~45%[50]。患者可出现WBC、PLT减少,Hb降低等症状,且存在西罗莫司药物剂量依赖性和浓度依赖性。西罗莫司的血液学影响是可逆的,严重的血细胞减少可考虑西罗莫司减量或停药。
mTOR抑制剂有可能导致或加重蛋白尿,在有糖尿病史的肝移植受者中尤为明显。应谨慎筛选受者,出现轻微蛋白尿时,可给予血管紧张素转化酶抑制剂或血管紧张素受体拮抗剂缓解蛋白尿;若出现蛋白尿≥1 000 mg/d或移植后糖尿病,说明受者肾功能进一步恶化,此时应停用西罗莫司,转换为低剂量CNI方案[65]。
在肝移植受者中发生率为2%~4%[66]。常表现为无明确感染病因下,运动后呼吸困难、干咳,也可出现发热、乏力甚至咳血,影像学检查明显改变。发生西罗莫司相关肺炎的危险因素包括:(1)西罗莫司峰谷浓度>12 μg/L。(2)西罗莫司方案转换时间较晚。(3)老年受者。(4)西罗莫司方案转换初期采用负荷剂量。西罗莫司减量有利于症状改善,但若要使炎症完全恢复需停用西罗莫司,必要时可辅以静脉类固醇治疗以促进炎症修复[67]。
西罗莫司可能会引起切口愈合不良,如吻合部位破裂、切口疝和筋膜开裂,作用机制为mTOR信号通路受抑制影响纤维化[68]。建议术后早期使用CNI为基础的传统免疫抑制方案,4~6周后转换为西罗莫司为基础的免疫抑制方案;糖尿病等高危患者可辅助使用促进伤口愈合的措施。
西罗莫司可导致口腔溃疡。局部使用药物止痛、促进愈合,可不中断西罗莫司治疗;如使用西罗莫司口服液,可用橙汁或维生素C稀释西罗莫司口服液,服药后立即用清水漱口,确保口腔无药物残留。此外,正确的饮食及口腔护理指导可促进口腔溃疡愈合,从而减轻患者痛苦,促进患者的治疗和康复[69]。
西罗莫司能引起消化道溃疡,进而导致消化道出血、恶心呕吐、厌食等症状。有研究结果显示:西罗莫司能通过干扰生长因子合成或增殖相关信号通路而抑制平滑肌细胞增殖和内膜增厚[70]。对于已存在消化道溃疡的受者,应谨慎转换为西罗莫司方案;对于出现消化道溃疡的受者,应停用西罗莫司,辅以抑酸和胃黏膜保护治疗,必要时行内镜治疗;对于有消化道病史者,可预防性加用抑酸药物,并密切监测西罗莫司血药浓度。
西罗莫司的血药浓度受患者生理状态及药物相互作用等因素的影响,见表2[40]。
和其他免疫抑制剂一样,西罗莫司也具有治疗窗窄,不良反应多,个体内、个体间差异较大的特点,所以应对使用此类药物的患者进行药物监测以维持稳定的血药浓度。西罗莫司的半衰期较长,如首剂给予负荷剂量继以维持剂量,需在≥3~4 d监测血药峰谷浓度;如不给予负荷剂量,仅给予维持剂量,应在第5~7 d进行监测。一旦调整维持剂量,应以新的维持剂量连用7~14 d后在血药浓度监测下进一步调整剂量,根据不稳定的血药浓度频繁调整剂量可能导致用药过量或用药不足。建议在调整剂量后第1个月内每周复查1次,第2个月内每2周复查1次;获得稳定的血药浓度后,每个月复查1次,移植时间较长、血药浓度稳定的受者可每3个月监测1次。
西罗莫司既是一种有效的抗排斥药物,又可经PI3K/Akt/mTOR通路抑制肿瘤细胞生长,还同时具有低肾脏毒性、糖代谢保护作用等优点。此外,新型mTOR抑制剂,如依维莫司,在肝癌肝移植中也取得了多项有价值的研究成果。本共识针对肝癌肝移植受者肿瘤复发危险程度及复发转移情况提出西罗莫司联合用药或单药维持的治疗方案,并对各类常见不良反应的判断与处理提供合理建议。肝癌肝移植术后西罗莫司的应用仍有赖于大样本、多中心随机对照研究等高级别循证医学证据支持。