非小细胞肺癌伴随诊断行业现状
#01
伴随诊断行业发展现状
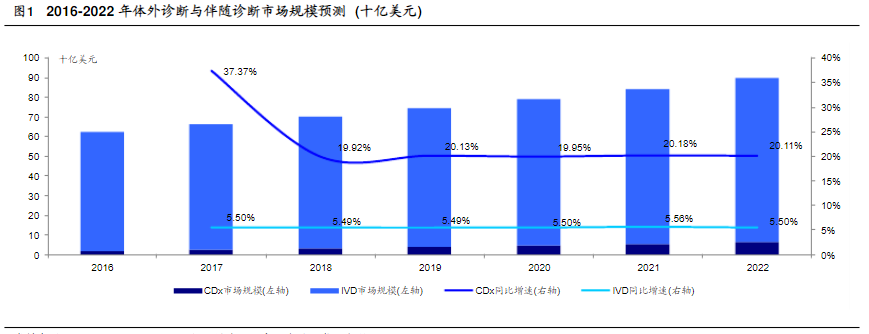
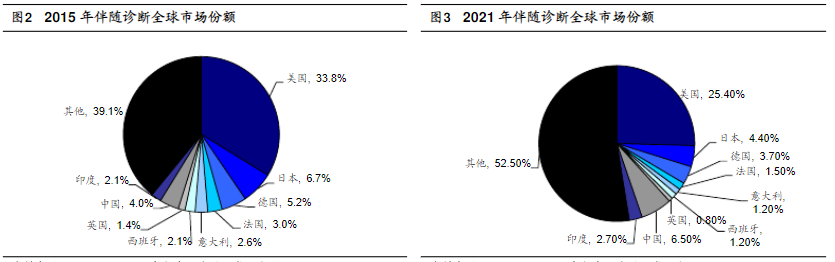
伴随诊断市场是IVD中发展最快的子行业。伴随诊断与靶向药结合使用能有效提高靶向药的治疗效果。可以确认谁受益,谁有风险,并且通过监控药品的疗效来调整治疗方案。根据MarketsandMarkets的预测,未来伴随诊断作为创新药产业链的卖水人将是整个体外诊断行业中发展最快的子行业。2022年,全球伴随诊断市场规模将达到65.1亿美元,2017年至2022年年复合增长率达到20.1%,远超体外诊断行业5.5%的复合增长率水平。此外伴随诊断在整个体外诊断行业的占比也将从2016年的3.2%上升至7.8%(图1)。根据 Visiongain 的测算,2015 年伴随诊断市场份额占比前三的国家分别为:美国 (33.8%)、日本(6.7%)、德国(5.2%),中国市场仅占全球市场份额的4%(图2),未来中国伴随诊断行业有很大发展空间。Visiongain预计,到 2021年,除欧美以外的其他地区占比有望上升,届时中国的市场份额预期可达到 6.5%(图3)。
#02
测序技术进步推动伴随诊断行业发展
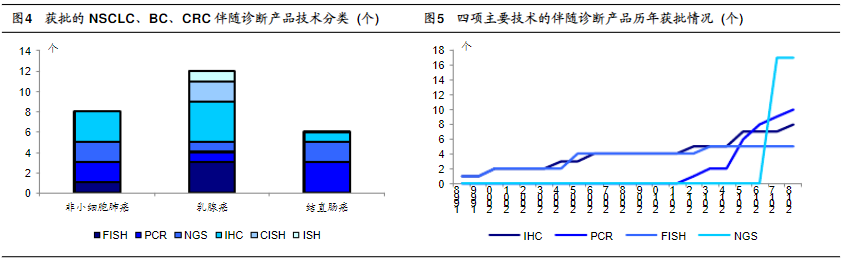
在伴随诊断行业发展过程中,主流的伴随诊断技术随时间推移产生了更新,NGS测序技术的进步推动了伴随诊断行业发展。我们分析了伴随诊断应用最广泛的三大癌种,即非小细胞肺癌、乳腺癌、结直肠癌的伴随诊断产品。结果显示,2010年以前,获批的三大癌种的伴随诊断产品主要采用IHC与FISH技术,2010年以后,基于PCR的伴随诊断与靶向药的组合开始获批,基于IHC与FISH的伴随诊断产品增长开始放慢。2017年起,大量基于NGS的伴随诊断与靶向药组合获批,开启了新一轮的增长(图4,5)。
#03
伴随诊断:筛选合适用药人群,为精准医疗保驾护航
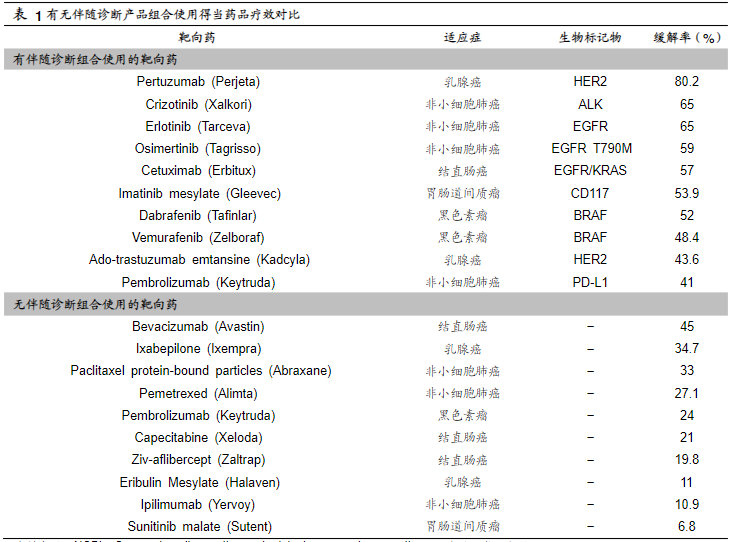
靶向治疗与伴随诊断是实现精准医疗的两大重要工具。伴随诊断是与特定药物的临床应用相关联的一类体外诊断技术,主要通过检测对某种特定药物临床反应具有相关性的基因、蛋白等生物标志物的水平或特征,在不同类型的疾病人群中筛选出最佳用药人群,有针对性地进行个体化医疗。伴随诊断与靶向药结合使用能有效提高靶向药的治疗效果(表1)。
#04
非小细胞肺癌常见伴随诊断产品
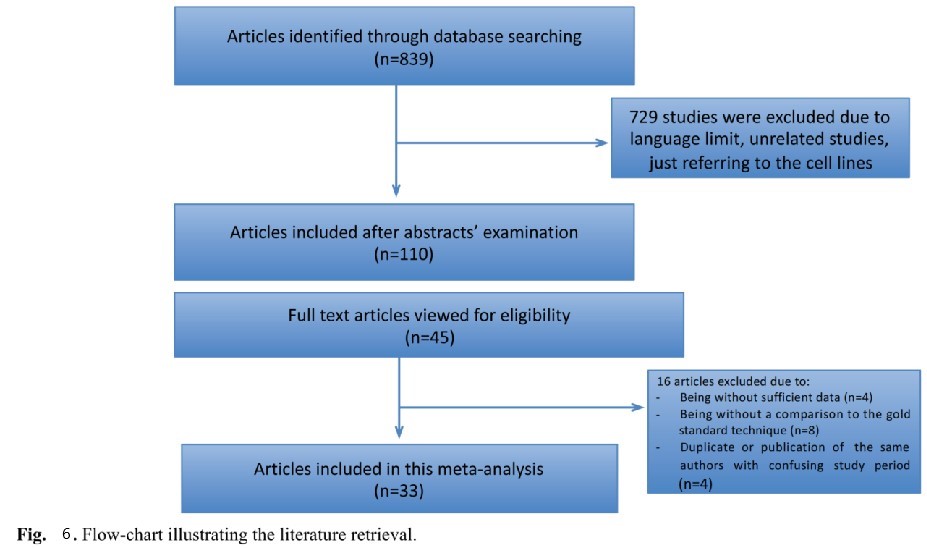
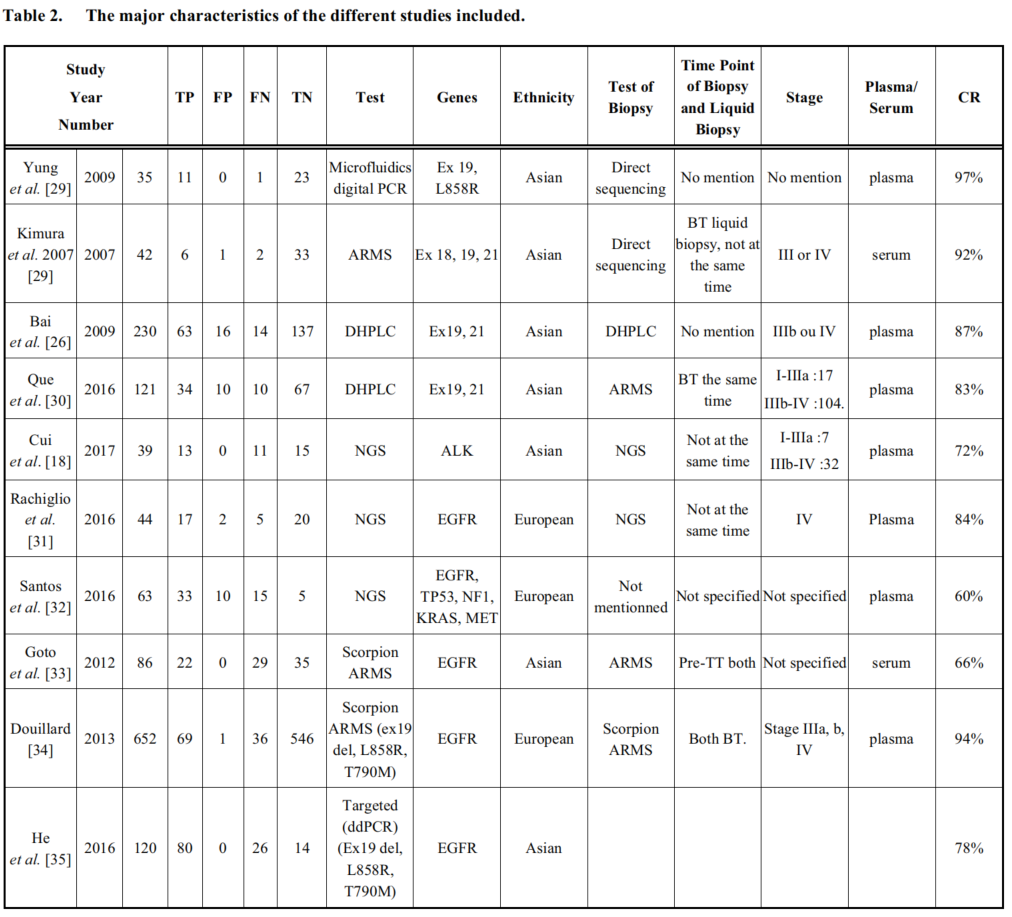
2018年一项液体活检荟萃研究:纳入839例样本,80%的患者进行了活检,30%的病例活检不足以进行分子诊断。据报道,液体活检(LB)可能是组织样本的替代品,自2014年以来已被引入到患者的管理方案中。研究目的是强调液体活检与组织活检在评估非小细胞癌分子谱方面的诊断价值(图6,表2)。
这项荟萃分析表明,cfDNA检测分子突变在与组织相关的诊断中具有足够的准确性。LB的高特异性和中等敏感性突出了其作为筛查试验的价值。
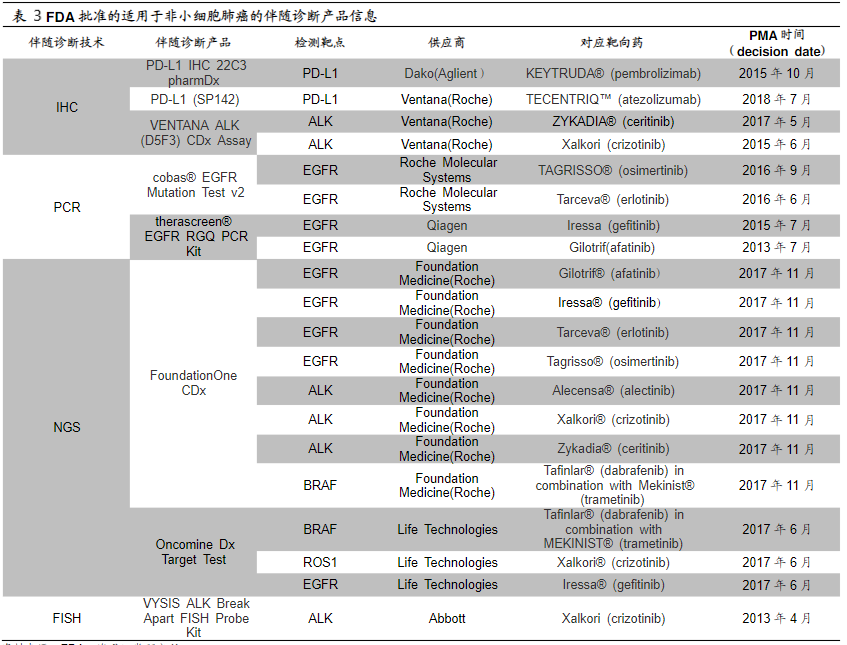
液体活检,是一种无创,NCCN批准,高潜的伴随诊断技术。目前,FDA共批准了35种伴随诊断产品。目前,伴随诊断最主要的应用领域仍是在肿瘤治疗方面。35种获批的伴随诊断产品中,以针对乳腺癌、非小细胞肺癌、结直肠癌的产品数量最多,分别达到了12项、8项与6项。8项肺癌产品共涵盖了四个技术领域,包括3项IHC产品、2项PCR产品、2项NGS产品与1项FISH产品,检测靶点包括PD-L1、ALK、EGFR、BRAF和ROS1(表3)。
#05
靶向药的获批上市,提供更广阔的市场空间
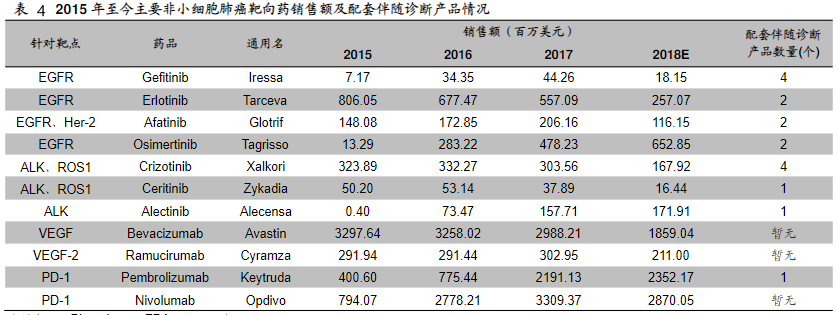
由于伴随诊断产品需与靶向药配套使用,伴随诊断产品与其对应的靶向药之间有较强的联动关系,理清目前主要癌种靶向药的市场情况,对分析未来伴随诊断产品的发展方向有一定的指导作用。就伴随诊断产品与非小细胞肺癌靶向药的联动关系上看,多数靶向药都有多项配套伴随诊断产品。统计的11项药品中,只有作用于VEGF、VEGF-2的贝伐珠单抗、雷莫芦单抗以及作用于PD-1的纳武单抗暂时没有对应的伴随诊断(表4)。
由此,我们认为在国际市场,尤其是美国市场上,伴随诊断与靶向药的组合已发展成一个较为完善的体系。这一体系的形成也得益于FDA 2011年开始起草,2014年正式发布的伴随诊断设备指南。该指南对医疗产品与相应的伴随诊断提出了要求,总结如下:首先,指南规定对于有必要辅以伴随诊断的医疗产品,伴随诊断设备通常需要与医疗产品同步研发,以保证当医疗产品被批准时,伴随诊断可以同时上线。在新型医疗产品获批前,FDA会决定对应的伴随诊断设备是否满足安全高效或符合其效用的标准。如若伴随诊断设备未达标,FDA将对该新型医疗产品不予批准。
在某些特定情境下,FDA会批准通过伴随诊断暂未过审的医疗产品。这一情形是建立在是FDA认为相应的伴随诊断设备会紧随医疗产品的批准而通过审核。具体而言,先于伴随诊断获批的医疗产品主要适用于以下两种情况:
1) 用以治疗极度严重乃至危及生命的病症的医疗产品,这些医疗产品的应用领域目前没有更好的替代品,且其疗效给病人带去的利益远高于可能引起得风险。
2) 在指南发布前已经通过审批的医疗产品
相比之下,国内在伴随诊断领域面临两大机遇和挑战。一方面,目前国内获批上市的肿瘤靶向药远少于美国,仍有关键的靶点未被覆盖。我们认为,未来随着相关审批的推进,会有更多靶向药获批上市,给相应的伴随诊断产品提供广阔的市场空间。另一方面,国内对于伴随诊断还没有明确的界定以及类似FDA伴随诊断指南的行业规范,在国内行业逐渐成熟后,已上市的靶向药对伴随诊断的需求也会随之增长。