上海2023年3月22日 /美通社/
科济药业(股票代码:2171.HK),一家主要专注于治疗血液恶性肿瘤和实体瘤的创新CAR-T细胞疗法公司,发布了2022年度业绩。
业绩亮点速览
- 泽沃基奥仑赛注射液(CT053)的新药上市申请于2022年10月获国家药品监督管理局受理,并纳入优先审评
- CT041在中国进入确证性II期临床试验
- AB011完成I期单药及与化疗联合治疗的患者入组工作
- 多项数据披露于学术期刊和会议,包括《Nature Medicine》、《Haematologica》、《Frontiers in Immunology》、ASCO 2022、7th CAR-TCR summit、ASH 2022、ASCO GI 2023等
- 与华东医药就泽沃基奥仑赛注射液在中国大陆地区商业化签订合作协议
- 与罗氏就AB011达成一项临床合作协议
- 位于美国的RTP生产工厂已开始自体CAR-T细胞产品的GMP生产,并成功放行首批GMP批次
科济药业创始人、董事会主席、首席执行官、首席科学官李宗海博士表示:
“2022年,我们在推进管线产品临床研究及注册、新技术开发、扩大全球生产能力及业务发展等方面达成了重要里程碑。展望未来,我们正走在更为振奋人心的征途上。我们相信,凭借差异化候选产品管线、敬业的团队精神及高经营效率,科济药业有能力巩固其在全球CAR-T细胞疗法领域的领先地位。”
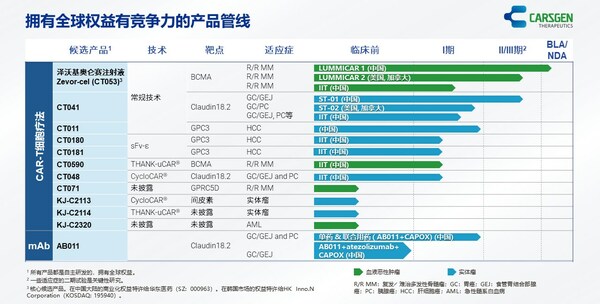
科济药业产品管线
泽沃基奥仑赛注射液(即zevor-cel,或CT053)是一种升级的、用于治疗复发/难治多发性骨髓瘤的全人抗BCMA自体CAR-T细胞候选产品。中国国家药品监督管理局已受理泽沃基奥仑赛注射液的新药上市申请,并于2022年10月将该申请纳入优先审评。科济已在第七届CAR-TCR年度峰会上口头介绍了美国2期研究(NCT03915184)的最新进展,并于2022年12月在第64届美国血液学会(ASH)年会上展示了有关中国关键性II期研究(NCT03975907)的最新进展的海报。中国研究者发起的试验的最新进展已于2022年8月发表在《Haematologica》期刊上。科济计划于2024年向美国FDA提交生物药物上市许可申请(BLA)。
对于CT041(靶向CLDN18.2蛋白的同类首创自体CAR-T细胞候选产品),一项针对晚期胃癌/食管胃结合部腺癌的中国确证性II期临床试验正在进行中。预计美国2期临床试验将于2023年上半年启动。美国1b期研究(NCT04404595)及中国Ib/II期研究的最新进展已于2022年6月在2022年美国临床肿瘤学会(ASCO)年会上以海报方式展示。中国研究者发起的试验的最新进展已于2022年5月发表在《Nature Medicine》期刊上。科济计划于2024年上半年向中国国家药监局提交NDA,并计划于2025年向美国FDA提交BLA。
AB011是一种靶向CLDN18.2的人源化单克隆抗体候选产品。科济已完成I期单药及与化疗联合治疗的患者入组工作。有关I期研究(AB011-ST-01,NCT04400383)的最新进展已于2023年1月在2023年ASCO年会胃肠肿瘤研讨会(GI)上以海报方式展示。
除了上述的现有临床项目,科济将积极探索创新CAR-T细胞产品用于早期治疗方法。公司亦已努力开发创新技术和候选产品,以更好地应对现有细胞疗法产品面临的挑战。
2022年是科济药业在中国境外扩大产能的重要一年。公司位于美国达勒姆三角研究园的先进GMP生产工厂(RTP生产工厂),已开始了自体CAR-T细胞产品的GMP生产,并于2022年9月成功放行了首批用于临床试验的GMP批次。RTP生产工厂将继续支持科济药业在海外进行中的临床研究和早期商业化。
在业务发展方面,科济与华东医药股份有限公司(股票代码:SZ.000963)就在中国大陆地区商业化泽沃基奥仑赛注射液签订合作协议。科济药业将继续负责泽沃基奥仑赛注射液在中国大陆地区的开发、注册和生产。2023年1月,科济宣布与罗氏达成一项临床合作协议,就科济药业的试验药物AB011与罗氏PD-L1免疫检查点抑制剂阿替利珠单抗(atezolizumab)及标准治疗化疗,开展联合用药治疗胃癌/食管胃结合部腺癌患者的临床试验。科济期望与行业合作伙伴及学术机构建立更多合作,以开发及推进创新细胞疗法及技术,惠及全球癌症患者。