Q: 这次参展的作品最初是如何产生的?创作之初,你试图回应一个怎样的提问或感受?
How did this work first come into being? What question or feeling were you responding to at the beginning of the creation?
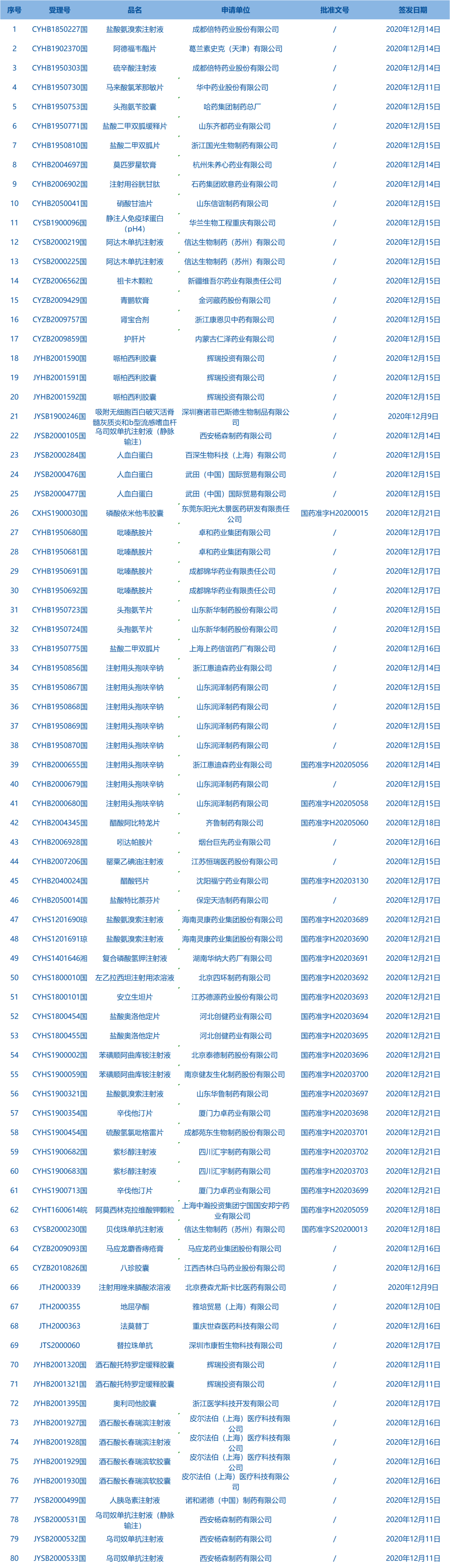
阿尔特加(Arteaga):这件作品的灵感来自于一场发生在2017年的智利森林大火。这场大火的规模是智利历史上规模最大的森林大火。当时我在英国读书,令我惊讶的是没有国际媒体报道这次火灾。我强烈地感到有必要对这样的事件作出回应。我开始研究智利单一栽培的历史,我意识到它们与不断增加的森林火灾之间有着密切的联系,森林火灾的原因有很多,但在智利,一个重要的原因是,几十年来,过度的单一栽培种植园已经取代了原始森林。
在我的研究调查过程中,智利植物学家Adriana Hoffman的很多作品为我的创作带来了灵感。我开始画种子、叶子和树枝的轮廓,我画的树的轮廓来自于智利森林工业中使用的两种主要树种:“辐射松”和“蓝桉”。我把它们画下来然后然后把它们的轮廓烧在纸上,所以你看到的不是真正的植物,而是燃烧痕迹留下的缺失。这件作品的制作本身就揭示了它与森林大火的联系,因为我是将这些作品垂直悬挂起来烧制的,所以你可以看到煤烟和烟雾的痕迹。我以不同的形式探索了这种创作方法,这次展出的这种更类似于向观众展出一座植缺席的植物标本馆。我希望通过创造这种缺席感让更多人知道2017年的那场智利森林大火以及铭记那些在大火中消失的树木与植物。
I was studying in London in 2017 when my home country Chile suffered the biggest forest fires in its recorded history. I was surprised to see almost no international news covering it. I felt a strong need to respond to such an event. I started to study the history of Monocultures in Chile and I realized the strong connection between them and the increasing forest fires, there are many reasons for forest fires but a big reason in Chile is the excess of Monoculture plantations that through decades have been replacing native forests.
The 1998 book “La tragedia del bosque chileno”(the tragedy of the Chilean forest) by the Chilean Botanist Adriana Hoffman was a big revelation for me since it warned of the possible effects that some forestry practices in the 90s would have in the future, which is exactly what is happening today. She invited philosophers, biologists with vital research such as Ricardo Carrere’s “Pulping the South: Industrial Tree Plantations in the World Paper Economy”chapter “Chile: A Model Imposed by a Dictatorship”; Vandana Shiva’s “Monocultures of the mind”, Humberto Maturana, among many others. I felt that I needed to make visible what was happening in my home country to a broader audience, in a way to tell that untold story. I started to draw silhouettes of seeds, leaves and branches of the 2 main species of tree used in the forest industry in Chile: ‘Pinus Radiata’ and ‘Eucalyptus Globulus’ and then burning them into the paper so what you see is not the actual plant but its absence left by the burn marks. The making of the work itself reveals a connection to the forest fires and since I make them vertically you can see a trace of the soot and smoke. Since paper comes from trees, it was also a poetic or perhaps a stubborn attempt to bring a material back to its origin.
I have explored this method in different formats, one that is more similar to a herbarium, I realized that was a herbarium of absence and the scale placed the viewer in a sort of landscape. This became part of an installation I made in Santiago at Museo de Artes Visuales titled “Diorama en expansion”that became a sort of Diorama of the central region of Chile. By the time I was living in Valparaíso and would go to monoculture plantations or burnt forests to gather elements to use in the sculptures. I was trying to somehow update this historical museum device, that we have insisted on since before the invention of photography, into the current ecological crisis with some of Chile’s contingencies. When showing this work abroad many people have reached out to say that the same happens in their countries, often with the same species. So it has resonated in a broader context. I have tried to develop this idea further and so I started to burn silhouettes of larger trees. In a way it has to do with the empty space that a tree, a forest leaves after it is gone. As a way of remembering. It is a sort of memorial for their absence.
02. 与展览主题的关联 / Relation to the Exhibition
Q: 《我们,世界 / We, the World》强调的是跨物种、跨技术、跨生态系统的共在(coexistence)。你认为你的作品与“共在性”之间有怎样的对话?
We, the World emphasizes coexistence across species, technologies, and ecosystems. In your view, how does your work engage with this idea of “coexistence”?
阿尔特加(Arteaga):我希望通过我的绘画,让观者明白人类不应该是自然中的最”优越“的物种,人类不应该凌驾于自然万物之上。我们经常忘记维持我们的生命之网,我们与与我们共享这个星球的所有生物深深纠缠在一起。我们只能呼吸,因为像藻类或树木这样的光合生物产生的氧气。没有任何生物是孤立的,我们生活在一个共生的星球上。但有一种物种自恋蒙蔽了人类,阻止我们看到超越自己的东西。对我来说,艺术就像一个变幻莫测的万花筒。有时我试着去做的是把标本的逻辑颠倒过来。我希望通过我的作品来告诉人们我们对自然已经造成了一定的伤害,但是自然界是一个在不断变化的“剧场”。目前我们还有机会去探索一种与自然共生,共在的生存方式。
As humans we often forget about the great web of life that sustains us, we are deeply entangled with all of the beings we share the planet with. We can only breathe because of the oxygen produced by photosynthetic organisms like algae or trees. No organism is isolated, we live in a symbiotic planet. We need multispecies awareness and solidarity. But there is a kind of species narcissism that blinds us, preventing us from seeing beyond ourselves. And for me, art has often been like a game of mirrors. Sometimes what I try to do is to reverse this logic of the specimen.
There is a certain impossibility in trying to stop being so anthropocentric. but there's something that has to do with the attempt to do so, which is already a gesture of humility, of learning, of stepping down from the pedestal of the ‘scala naturae’ that placed human beings as a “superior” species. We need to look for ways to get out of that logic that has prevailed for so long. I believe that new paths and possible new worlds can be visualised through art. That's what it's about, I feel, even showing the obviousness of the disaster or the gaps that these mistaken ideas between humans and other species have created, as well as showing the problem, drawing it, defining it, which also helps in some way to get out of the shock mode.
I believe that a false dichotomy has been established between the ideas of nature and culture, which has caused us many problems and, in a way, has led us to the situation we are in today. It has to do with separating human beings from nature, as if nature is something that exists out there and we are in another space. It has done a lot of damage and has also allowed us to position human beings above other species, giving way to the excessive extractivism and a series of very profound consequences that we are experiencing today.
If we think of the idea of nature as a diorama, as a theatre of the natural world, it would have to be under construction. This means that it can also be rebuilt differently. Art for me is a way to remember the porosity between ourselves and every life form, without exception. Remember our symbiotic and entangled relationship with so many more-than-human beings that allow us to exist. Everything we do to others we do to ourselves, like Mark Dion said ‘as efficiently as the planet is being destroyed it could also be protected’
03. 材料、技术与方法 / Materials & Processes
Q: 你使用了哪些关键材料、技术或方法?这些媒介选择如何帮助你表达作品的核心思想?
What key materials, techniques, or methods do you employ? How do these choices support the core ideas of your work?
阿尔特加(Arteaga):我使用的主要材料是纸,方法是手工燃烧纸来绘制树木的轮廓。因为纸来自树木,通过把它们烧成树的形状,我正在制造一个意义的关系结,一个反馈循环。同时,我相信Timothy Morton所说的“所有的艺术都是生态的”,因为所有的事物都与其他事物有着永恒的关系,所有的材料都来自某个地方,又去了某个地方,这当然不仅适用于艺术,也适用于生活的所有领域。但艺术是一种观察站,它放大了我们的视野,让我们重新思考。我认为很多诗歌都是矛盾的。在这个意义上,有许多努力来保护和允许自然疗愈和再平衡,但同时破坏的程度是如此巨大。在某种程度上,这是本世纪的重量,我试图以某种方式反映这一点。复杂的绘图过程和燃烧过程创造了一个美丽的形象。我们的感官首先是通过美联系起来的。当然,即使在过度使用单一栽培种植园和对当地生态系统的影响中存在某种悲剧,树木本身也相当美丽。
The main material I used is paper and the methodconsisted in manually burning the paper to draw the silhouettes of trees. Since paper comes from trees and by burning them into the shape of the trees, I am making a relational knot of meaning, a feedback loop. At the same time I believe as Timothy Morton claims that“All art is ecological”, as everything is in perpetual relation with everything else, every material comes from somewhere and goes somewhere, this applies of course not only to art but in all areas of life. But art is a sort of observatory, it amplifies our vision and allows for a rethinking to emerge.
There is a contradiction where I think a lot of the poetry happens. In the sense that there are many efforts to protect and to allow nature to heal and rebalance, but the level of destruction is so massive at the same time. In a way this is the weight of the century, I am trying to reflect that somehow. The intricate drawing process and the burning process create a beautiful image. It is first through beauty that our senses are engaged. And of course even if there is a certain tragedy in the excessive use of monoculture plantations and the impact in native ecosystems the trees themselves are quite beautiful.
04. 感知与观众体验 / Sensory & Audience Experience
Q: 你希望观众在面对这件作品时,获得怎样的体验?是感知性的、情绪性的,还是认知上的?
What kind of experience do you hope the audience will have when encountering this work—sensory, emotional, or cognitive?
阿尔特加(Arteaga):我希望我的作品可以帮助我们重新思考和调整我们看待世界的方式,最终以一个全新的角度看待世界。通过对错综复杂的烧焦痕迹的感官欣赏,你会在情感上参与到你所看到的树木的绘画中。通过这种情绪,你能够建立新的联系和意义,所以它们都是纠缠在一起的。
I hope for a sense of contemplation, of wonder, art can help us to rethink and to recalibrate, to finally look at the world differently. Through the sensory appreciation of the intricate burnt marks that make the drawing of the trees you engage emotionally with what you are presented with. And through this emotion you are able to make new connections and meanings, so they are all entangled.
05. 生态、未来与世界观 / Ecology & Worldview
Q: 在当下复杂的全球生态、科技与政治语境中,你如何理解艺术的角色?你的作品又如何参与这种持续的讨论?
In today’s complex ecological, technological, and geopolitical context, how do you understand the role of art? How does your work participate in this ongoing conversation?
阿尔特加(Arteaga):森林在我的工作中非常重要,在我成为艺术家的之后做的每一个项目都将我一次又一次地带回森林。这些年来,我在艺术创作上逐渐开始关注森林中的微观世界如地衣,苔藓,真菌,细菌。我对微观的,最不容易被发现的东西越来越感兴趣。我感兴趣的是通过艺术创作试图让我们经常忽视的东西变得可见。我感兴趣的是尝试用艺术作为一个空间,作为观摩自然循环与深层地质时间变化的天文台,让人们感受到自己在宇宙中的渺小。能够与这些对生态系统至关重要的过程联系起来,但往往是看不见的,因为它们就发生在我们的脚下,但我们的生活完全依赖于它们。我认为它给了我一种平静的感觉,让我确信我正在寻找的答案已经在那里了。对我来说,艺术展览是一种实验,能扩大我对艺术的理解。艺术永远是一种源泉,你做得越多,你越深入其中,你就会发现得越多。
Something happened to me a while ago. When Istarted doing the first works that I consider to be the start of my journey as an artist, I had a mountain of pages from encyclopedias and books from different subjects, that I used to make collages with. Every time I looked for images to cut out and make new connections, new compositions, I would go through the whole pile of papers and think that I had exhausted them. Then time would pass and I would go through them again, and every time I found new things. And every time I looked through them again, I felt, ‘wow, how did I not see this before?’ I feel like something similar happens to me in the forest, I get so many ideas.
The forest has been very important in my work, every project, every step on that path takes me back to the forest again and again. But also every time I try to define, for example, what I understand by nature, I reveal layers that were less visible to me before. And I've realised that, progressively, over the years and through exhibitions, the projects have increasingly focused on the smallest things. More towards the micro world, lichens, mosses, fungi, bacteria. And I am increasingly interested in the microscopic, the most invisible. I am interested in trying to make the invisible visible, or what we often overlook. And I am interested in trying to use art as a space, as an observatory of natural cycles, of deep geological time, to feel small in the universe. To be able to connect with these processes that are so vital to ecosystems but are often invisible because they happen literally under our feet, yet our lives depend completely on them. I think it gives me a sense of peace, a certainty that the answers I am looking for are already there, it's just a matter of looking again, and there are infinite possibilities.
An exhibition is a sort of laboratory to experiment and to hopefully expand my own understanding of art. Art is always a source, the more you do, the more you delve into it, the more you notice. There is a way of noticing, of observing when you walk in the forest and with fungi particularly you always have to be very open to the unexpected. It has been a way for me to observe, to notice, and to expand my idea of nature to incorporate this diversity of beings with whom we coexist.
06. 下一步或长期方向/ Future Practice
Q: 最近你正在着手哪些新的研究或创作方向?它们是否与本次展览的主题形成延伸或回应?
What new directions or research are you currently exploring? Do they extend or respond to the themes of this exhibition?
阿尔特加(Arteaga):我认为我目前在ACC画廊展出的作品就是对本次展览的回应。我展出的新作品是我去年在德国魏玛居住了4个月之后创作的。在这件新作品中,我在弗朗兹·李斯特(Franz Liszt)的乐谱,钢琴“Liebesträum Nº3 in Ab Major”中融入了蓝藻。这首乐谱将由一架自动演奏的钢琴来演奏。
这个想法是如此雄心勃勃和复杂,展出的作品只是实现初衷的第一步,这在很大程度上是“用”蓝藻制作音乐。我必须学习如何培养蓝藻,所以我做了一个活的雕塑/实验室,鼓励蓝藻生长。我认为音乐和艺术并不是人类独有的。当像多头绒泡菌这样没有大脑的单细胞生物能够设计出最高效的网络,甚至比世界上最好的工程师都要好时,智能是什么?塞西莉亚Vicuña在一次采访中声称细菌“互相唱歌”,引用了一篇科学论文,该论文证明了细菌是如何通过微小的振动进行交流的,如果你愿意的话,也可以是一首歌。
我的新作品进一步的模糊了雕塑,音乐,艺术与科学的边界。作品中的钢琴由河流辅助它发出声响。在我看来,这架钢情是连接过去和未来之的接口。而艺术也是人与自然的桥梁,但是机器站在哪里?所以在某种程度上,它使用人工智能来关注自然智能。一台试图定义音乐的机器,邀请河流来作曲,并试图挑战我们的一些人类中心主义观点。。
They do actually. I am currently showing at ACC Galerie the results of a 4 month residency last year in Weimar. The project initially consisted in inoculating a music score by Franz Liszt, “Liebesträum Nº3 in Ab Major” for piano, were each note would be a colony of cyanobacteria and as they grow they would change the music, reflecting on composition and decomposition.
This score would be interpreted by a self playing piano. The idea was so ambitious and complex that the works on display are only the first steps to reach the original intention, which in a great degree is to make music “with” cyanobacteria. I had to learn how to cultivate cyanobacteria so I made a living sculpture/laboratory that encourages cyanobacterial growth. I think music and art are not exclusively human. What is intelligence when a unicellular organism such as Physarum Polycephalum that does not have a brain is able to design the most efficient networks even better than the worlds best engineers? Cecilia Vicuña in an interview claims that bacteria “sing to each other”, referencing a scientific paper that proves how bacteria communicate through a small vibration, a song if you will.
My friend and Field Mycologist Giuliana Furci told me that they are submitting a petition to Ecuador’s copyright office to recognize the Los Cedros Cloud forest as co-creator of a song titled "Song of the Cedars,” composed in collaboration with musician Cosmo Sheldrake, writer Robert Macfarlane, field mycologist Giuliana Furci, legal scholar César Rodríguez-Garavito and the forest, which was the first to gain constitutional rights.
This will be the first legal attempt to recognize an ecosystem’s moral authorship in the co- creation of a work of art. This helped me realize that the piano sculpture I just made is an attempt to make music “with” the river. The music of chance that is made by the drifting patterns of leaves as they are flowing in the surface of the river. What we see is a video showing the reflection in the moving water where a tree is seen, the sky and the drifting leaves floating in the surface, the position and rhythm of the leaves trigger notes corresponding to their location in the screen.
I wanted to convey that strange feeling that we have when we walk outside a house and we hear a piano. Ah, there is someone there, a person. I wanted to make the audience feel that presence beforehand but once they reach the piano they realize there is no human there, but it is the river instead. As an attempt to establish a connection with this being. Diluting certain boundaries between disciplines, sculpture and music, art and science. A river is a dynamic ecosystem and I wanted to make it a co-author. The drifting patterns of leaves may seem random at first but they are connected to everything else in a very complex network of events. It is all entangled and interconnected, the water over the earth reflecting the sky and a tree as well as the leaves. So I tried to make not “live” music but “living” music. And we are becoming increasingly entangled between machines trying to imitate humans and other living organisms. The piano becomes also a portal, a certain threshold between the past and the future.
Art is the bridge between humans and nature, and where do machines stand? So in a way it uses artificial intelligence to focus on natural intelligence. A machine which is trying to define what music might be, inviting the river to compose music, and by doing try to challenge some of our anthropocentric views.