Notice: Undefined index: HTTP_ACCEPT_LANGUAGE in /var/www/html/wp-content/plugins/UEditor-xiumi-for-wordpress-1/main.php on line 15
Notice: 自2.1.0版本起,已不建议 给WP_User->id传入一个参数!请改用WP_User->ID。 in /var/www/html/wp-includes/functions.php on line 4871
6.5亿,国产眼科新贵卖出一款重磅管线 – 文章管理后台
跳至内容
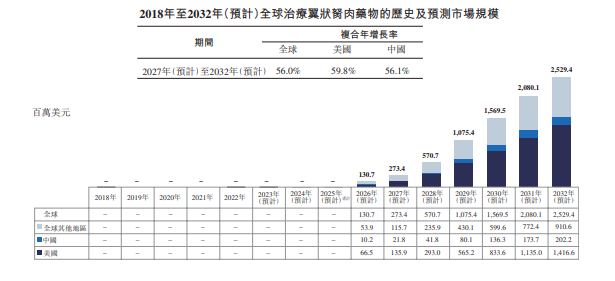
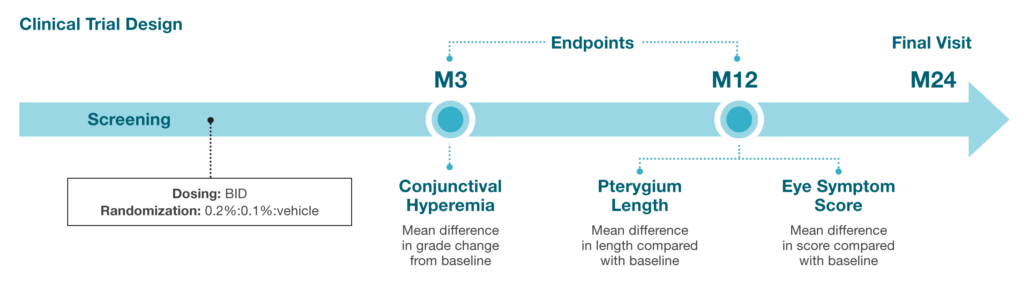
2024年8月6日,临床阶段的眼科药物公司Cloudbreak Pharma Inc.(下称“拨康视云”),与专精眼科企业参天制药株式会社(以下简称“参天制药”)宣布签署一项授权协议,拨康视云将其正在研发的用于翼状胬肉治疗的多激酶抑制剂CBT-001,授权于参天制药,该授权涉及日本、韩国、越南、泰国、马来西亚、菲律宾、新加坡和印度尼西亚在内的东南亚地区。根据协议条款,拨康视云授权参天制药在该地区开发、生产和商业化CBT-001药品。 根据协议,拨康视云将获得总额高达9100万美元(超6.5亿人民币)的首付款及里程碑付款。此外,拨康视云还将获得产品未来净销售额的两位数百分比,作为该产品的特许权使用费。 拨康视云的历史可追溯至2015年9月。创始人兼首席执行官倪劲松博士在药物发现和药物开发方面拥有超过二十年的制药行业和学术研究经验。在创立拨康视云之前,倪劲松博士曾在Allergan担任科学总监 15 年,并在辉瑞担任高级科学家3年。在Allergan和辉瑞 任职期间,倪劲松博士就一直专注眼科和皮肤科疾病,并领导项目团队成员成功推出了多款相关产品。 自2015年成立以来,拨康视云持续深耕眼科创新药领域。公司以美国加州为起点,逐步构建起全球化的研发与产业布局后,继而在广州与苏州设立分支机构,持续拓展研发和生产能力。拨康视云专注于产品的自主研发与差异化创新,目前已有多项成果达到了国际首创的新适应症与机理,致力于成为First-in-Class眼科创新药领域的先驱。 本次合作协议的主角CBT-001是拨康视云研发的一款滴眼液,主要用于治疗翼状胬肉。 翼状胬肉是一种眼表良性增生性疾病,主要特征是生长在角膜边缘上呈翼状纤维血管的结膜组织。由于其损伤角膜,可导致视力障碍。虽然翼状胬肉生长在巩膜,但其顶端会侵入角膜引起明显的眼部症状,包括充血、刺激、疼痛和异物感,从而影响患者的生活,且具有复发倾向和非转移性。人们普遍认为,曝露于紫外线(例如阳光)下为导致翼状胬肉发展的一个重要风险因素,而经常曝露于阳光下的人群为翼状胬肉的高危人群。由于局部眼表内稳态的改变,翼状胬肉的主要组成部分包括角膜缘干细胞增殖簇、纤维血管组织活跃、上皮化生、胶原及弹性纤维积累的细胞外基质改变以及炎症浸润。 目前,全球市场上尚无批准的治疗翼状胬肉药物,医生通常会使用未有临床试验认可的人工泪液和短期局部眼用类固醇当作处方。然而,这些药物在长期使用中可能无效或不安全。当翼状胬肉侵入视轴或者持续充血时,通常需要进行手术切除。虽然有多种手术方法,如转位术和结膜瓣移植,但所有治疗方法都有复发的倾向。 据拨康视云招股书,全球治疗翼状胬肉药物的市场规模预计将于2027年达到2.73亿美元,于2032年达到25.29亿美元,复合年增长率为56.0%。美国治疗翼状胬肉药物的市场规模预计于2027年达到13.59百万美元及于2032年达到14.17亿万美元,复合年增长率为59.8%。中国治疗翼状胬肉药物的市场规模预计于2027年达到2.18亿美元,于2032年达到20.22亿美元,复合年增长率为56.1%。 全球治疗翼状胬肉药物的市场规模,图片源自拨康视云招股书 CBT-001是拨康视云研发的一种乳化型尼达尼布滴眼液,主要用于治疗翼状胬肉。尼达尼布是一种多激酶抑制剂,主要用于VEGF(血管内皮生长因子)受体、PDGF(血小板衍生生长因子)受体和FGF(成纤维细胞生长因子)受体,从而抑制血管新生和纤维化。 CBT-001的研发可谓一帆风顺。在拨康视云成立后的第二年,CBT-001就于美国提交研究新药申请,而FDA并未于研究新药申请30天审查期内对进行第2期临床试验提出任何异议。2018年4月,CBT-001于美国完成第2期临床试验。 2期临床试验NCT03049852分为两个阶段。第一阶段包括对24名患者进行CBT-001剂量递增,以确定最大耐受剂量。结果证明了眼部安全性和耐受性,全身药物暴露可忽略不计。在第2阶段,51名患者接受了为期4周的TID周期CBT-001(n=25)或载体(n=23)给药治疗,并随访至第24周。到第4周,用药组的平均血管分布评分比对照组显著下降,并一直持续到第16周。此外,在第4周观察到病灶长度的平均变化比对照组明显减少,并一直持续到第 8周。 此外,CBT-001具有良好的耐受性,CBT-001组中常见报告的大多数不良事件是眼部不良事件,程度较轻,并在治疗后得到缓解。没有患者因不良事件而停止CBT-001治疗。 2020年4月,拨康视云还就CBT-001与远大医药订立独家商业化许可安排。目前,CBT-001正在美国、中国、澳洲、新西兰和印度开展大规模的全球多中心3期临床试验。尤为值得一提的是,CBT-001目前是全球范围内进展最快的翼状胬肉治疗药物。全球范围内仅有3款适用于预防翼状胬肉生长及减少结膜充血的临床阶段候选药物,其中两款处于二期临床试验阶段,CBT-001是唯一处于三期临床试验阶段的药物。 拨康视云也布局全球青少年近视药物市场。根据弗若斯特沙利文报告,全球治疗青少年近视药物的市场规模,在2022年至2027年及2027年至2032年的复合年增长率预计分别为103.5%及17.6%。 拨康视云的另一款核心产品CBT-009是新型阿托品眼用制剂,用于治疗青少年近视。阿托品是一种被广泛应用于眼科的药物,可以通过抑制近视眼球的生长来延缓近视的进程,亦被市场追捧为“近视神药”。 目前,阿托品是唯一获证明能持续有效延缓近视发展的治疗方法,并为唯一获中国《儿童青少年近视防控适宜技术指南》推荐使用的抗胆碱能药物。较高浓度的阿托品(如1%或0.5%)已被证明有效,但畏光的副作用发生率较高,这与放弃治疗率较高有关。即使是使用低浓度的阿托品,患者亦可能出现各种对阿托品的不良反应,包括畏光、眼压变化、反弹效应、局部过敏和全身不良反应,这亦可导致患者依从性差。畏光是使用阿托品最常见的不良反应。 据了解,目前美国和中国并无批准任何阿托品药物用来治疗青少年近视,而中国批准用来治疗青少年近视的药物为非阿托品。 拨康视云在招股书中表示,一旦获批准,CBT-009预期是治疗青少年近视的全球同类最佳药物。目前,CBT-009在美国进行第三期临床试验已被批准。根据CBT-009的临床试验及制剂稳定性结果,CBT-009预期能显著提高患者耐受性、安全性及产品稳定性,且不含防腐剂。 参天制药创立于1890年,迄今已有130年的历史。参天制药专注于眼科的专业公司,主要从事药品、非处方产品和医疗器械的研发、营销及销售,是日本处方眼科药物的市场领导者。“参天”一词源自《中庸》,企业理念为参悟天地万物之规律,为人类健康做贡献。 综观全球,患有重大眼科疾病的人数持续增加。由于电子产品的普及,全球青少年近视及干眼症人群在2022年分别超过5.5亿和9亿。此外,人口老化的整体增长以及糖尿病及高血压患病人数不断增加亦带动翼状胬肉、睑裂斑及青光眼等年龄相关眼科疾病的患病人数。随着眼科疾病患病人数的飙升及相关伤残调整生命年(即因健康状况不佳、残疾或早逝而损失的年数)的增加,预计未来数年对适当治疗的需求将增加,从而促进眼科市场的增长。 此外,创新的眼科疾病疗法不断革新,伴随着政策支持,近年来,全球眼科药物市场也呈现快速增长趋势。与此同时,尚未满足的医疗需求也在催促新产品的问世。 这或许能解释,已经成为眼科药物巨头的参天制药仍在不断寻求变革,从而力图抢占市场先机。参天制药一直在积极转型其核心业务并培育新业务。这就是“参天”应运而生的原因。该系统包括四大支柱:眼科用药(处方和非处方)、医疗器械、医疗服务和新模式。 在此背景下,拨康视云管线中的核心药物CBT-001作为翼状胬肉治疗领域的潜在首创药物,就显得难能可贵了,这也是为何参天制药会借此抢占先机。 而在谈到中国眼健康市场时,参天制药的中国区曾表示:“我们不仅要关注老年人,也要关注年轻人的眼睛健康需求。我们将充分规划整个眼健康领域。” 而CBT-009恰巧有望成为同类最佳。或许未来还能看到参天制药和拨康视云的进一步合作。
130 6172 3098
zakk.cui@siqibest.com
文章导航