今年以来,信达生物可谓风头正劲,在各大医学大会上频频亮相重磅数据,叠加不久的将来GLP-1玛仕度肽就要获批,各大BD品种也即将落地……
国产GLP-1日趋白热化,随着6月25日司美格鲁肽减重适应症在国内获批,为GLP-1赛道再添柴,据药智数据统计,国内已有超百款GLP-1类药物进入临床试验阶段。
这其中,信达生物的玛仕度肽最为亮眼,其减重适应症NDA已于今年2月提交。
近日在2024美国糖尿病协会(ADA)大会上,信达生物汇报了玛仕度肽首个III期临床研究之后,市场的期待更趋于热烈。
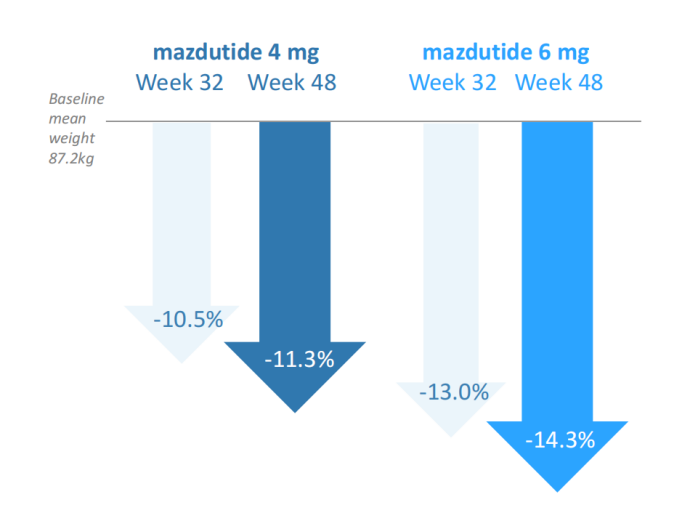
以重磅进展摘要(1857-LB)的形式发表的GLORY-1临床研究共纳入610例中国超重(BMI≥24 kg/m2)伴有至少一种体重相关合并症或肥胖(BMI≥28 kg/m2)受试者,按1:1:1随机接受玛仕度肽4 mg、玛仕度肽6 mg或安慰剂治疗。
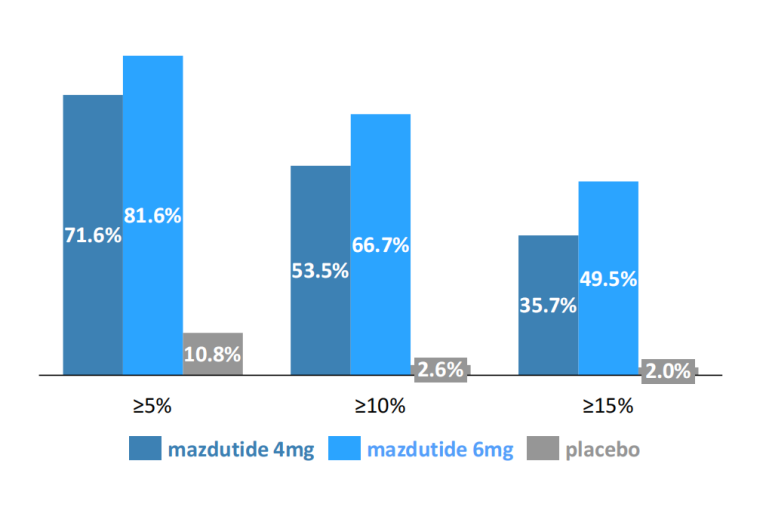
研究结果显示,4mg/6mg剂量组在32周体重较基线分别下降10.54%、13%;48周时4mg/6mg剂量组体重较基线分别下降11.3%、14.31%。
此外,肝脏脂肪降低数据也表现亮眼。48周治疗后,4mg/6mg剂量组分别有76%/77.3%实现肝脏脂肪正常化;4mg/6mg剂量组有80%/95.5%受试者实现肝脏脂肪含量(LFC)较基线时降低至少30%,76%/90%受试者实现LFC较基线时降低至少50%。
基于该亮眼疗效,信达生物已公布MASH将是未来一大适应症拓展方向。
目前,信达生物计划于2024年根据DREAMS-1及DREAMS-2的临床结果递交玛仕度肽治疗2型糖尿病的第二项NDA;已启动GLORY-2研究,旨在探索更高BMI基线水平的肥胖患者中探索高剂量9mg玛仕度肽的疗效和安全性;另一项DREAMS-3研究也在进行中,旨在合并肥胖的T2D患者中对比玛仕度肽和司美格鲁肽的效果;针对中国肥胖青少年的I期临床即将开展。
然而,信达生物整个研发管线之中,玛仕度肽也仅能作为其中较为优秀的潜在重磅而已,其研发管线之优秀可以想象。目前,信达生物共有10个商业化产品,3个品种在国家药监局审评中,5个品种进入Ⅲ期或关键性临床研究,另外还有18个分子进入早期临床研究。
作为少数兼具IO和ADC领域领先研发能力的Biotech,信达生物在肿瘤治疗的下一代创新中具备独特的竞争优势。
自PD-1信迪利单抗上市以来,信达生物以其为核心逐步形成专科系统性产品布局,目前已有8个产品实现商业化,包括6个新药和2个生物类似药,覆盖肺癌、消化道肿瘤、血液瘤等患病人群较大的瘤种。
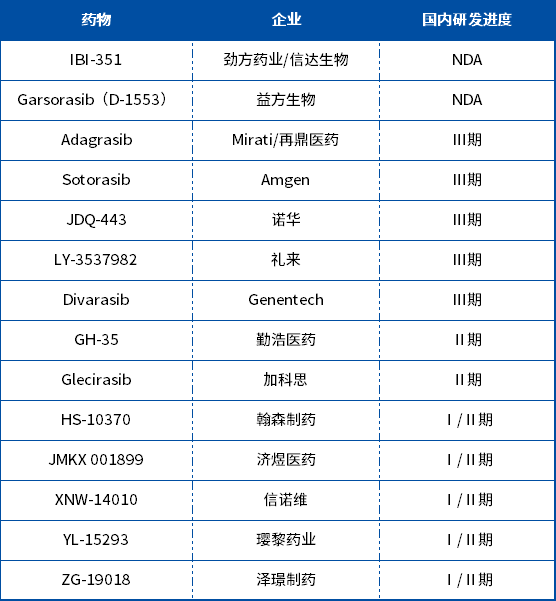
两个新药IBI351(KRAS-G12C)和IBI344(ROS1/TRK)的上市申请已于2023年11月获得国家药监局受理。
IBI351(氟泽雷塞)是一款特异性共价不可逆的KRAS-G12C抑制剂,于2021年9月从劲方药业获得其大中华区权益,是中国首个递交NDA的KRAS-G12C抑制剂,提交上市申请的首个适应症为治疗至少接受过一种系统性治疗的KRAS-G12C突变型晚期非小细胞肺癌(NSCLC)患者。
目前全球KRAS-G12C同靶点药物仅有Sotorasib及Adagrasib于美国获批,国内用药尚为空白,从国内同靶点药物竞争格局来看,IBI-351先发优势明显。
IBI344(他雷替尼)是信达生物从葆元医药引进的新一代ROS1-TKI,提交NDA的适应症为用于治疗经ROS1-TKI治疗失败的ROS1阳性局部晚期或转移性NSCLC成人患者;2024年3月,一线治疗上述适应症的NDA也被受理。
作为肺癌驱动基因,ROS1已经被证实为非常有潜力的NSCLC治疗靶点。
在ELCC 2023年会公布的TRUST-I研究期中分析结果显示:在67例先前未经ROS1-TKI治疗的ROS1+NSCLC患者中,cORR为92.5%;38例经克唑替尼治ROS1+NSCLC患者中,cORR为52.6%,mPFS为9.8个月;在12例脑转移患者中,ORR为91.7%,DCR为100%。
在发挥IO+ADC双项优势上,信达生物今年以来也取得了诸多令人鼓舞的重要进展。
2024年3月,信达生物启动了IBI310(CTLA-4)联合信迪利单抗用于结肠癌新辅助疗法的III期试验;2024年4月,递交了信迪利单抗联合呋喹替尼治疗子宫内膜癌的sNDA。同时,还在探索IBI343(CLDN 18.2 ADC)分别联合信迪利单抗在治疗一线胃或胃食管交界处腺癌(GC)和雷莫西尤单抗在治疗二线 GC的PoC研究,以及通过与轩竹生物、荣昌生物等合作伙伴的临床试验合作,探索信迪利单抗联合不同ADC(靶向HER-2、c-Met及MSLN等)治疗实体瘤。
IBI343是信达生物的王牌ADC项目,差异化设计使IBI343具有Best-in-class潜力。
IBI343毒素为TOP1I,采用定点偶联技术,稳定均一且DAR值为4,并在动物实验中表现出比αCLND18.2-Dxd潜在更强的抑瘤活性。抗体部分使用全人源化、具有高效内吞性的αCLND18.2单抗,同时利用Fc silent技术改造单抗来避免非特异性摄取。目前,IBI343正在澳大利亚和中国同步开展IBI343治疗晚期实体瘤的I期临床。
此外,信达生物正在推进多款具有全球创新潜力的双抗、多抗及ADC的PoC或早期临床研究,如下一代IO药物IBI363(PD-1/IL-2)已在研究中观察到初步PoC结果,用于治疗IO耐药及不响应瘤种。
信达生物自主研发的潜在First-in-class新药PD-1/IL-2双抗融合蛋白IBI363,其IL-2部分采用α偏向设计,提高疗效的同时降低IL-2相关毒性,通过同时阻断PD-1/PD-L1通路并激活IL-2通路,更加精确、有效实现对肿瘤特异性T细胞的靶向和激活,并在PD-1耐药和转移模型中表现出良好的抗肿瘤活性。
信达生物计划于2024年在美国启动IBI363的临床II期临床试验。
除了以上的潜在重磅项目,信达生物肿瘤方面的早期项目还包括IBI389(CLDN18.2/CD3)、IBI334(EGFR/B7H3)、IBI3003(GPRC5D/BCMA/CD3)、IBI3001(EGFR/B7H3 ADC)、IBI130(TROP2 ADC) 、IBI133(HER3 ADC)等。
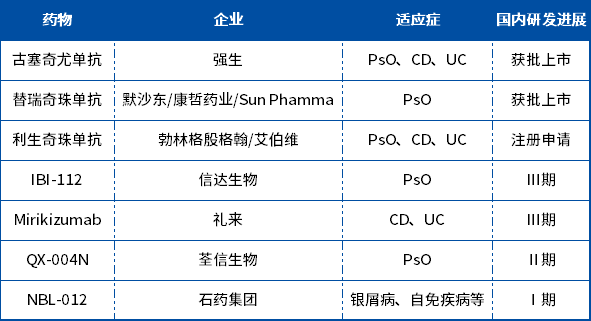
在非肿瘤管线方面,除了上文的玛仕度肽外,信达生物首个创新药IBI306(PCSK9)于2023年8月获批上市,另有4款处于注册临床阶段。其中,IBI112是首个进入III期临床的国产IL-23p19单抗;自主研发的IBI302是全球首个眼用VEGF/C双抗;IBI311是国内唯一处于临床III期研究阶段的IGF-1R单抗。
另外,License-in的痛风新药IBI128(XOI),针对高血压的siRNA药物SGB-3908也看点十足。
5月底,信达生物宣布其自主研发的重组抗白介素23p19亚基(IL-23p19)抗体注射液匹康奇拜单抗(IBI112)在中国中重度斑块状银屑病受试者中开展的Ⅲ期临床研究(CLEAR-1)中达成主要终点和所有关键次要终点。
CLEAR-1是目前本靶点全球唯一一个首要研究终点(16周PASI90)突破80%的银屑病III期注册临床研究。研究结果显示,第16周时,匹康奇拜单抗合计组PASI 90和sPGA 0/1分的受试者比例分别达到80.3%和93.5%;第52周时,200 mg组PASI 90和sPGA 0/1分别维持在84.9%及85.9%。
优异的临床数据显示了匹康奇拜单抗在短期内起效明显、疗效强劲的同类最佳潜质,预计信达生物将很快提交匹康奇拜单抗的NDA。
在眼科方面,信达生物布局多款在研新药,其中IBI311(IGF-1R)及IBI302(VEGF/C)已进入III期,IBI324(VEGF-A/ANG-2)及IBI333(VEGF-C/VEGF-A)尚处于早期阶段。
甲状腺眼病(TED)是甲状腺疾病密切相关的一种器官特异自身免疫性疾病,发病率居于成人眼眶疾病首位。我国目前约有700万甲状腺相关眼病患者,大约3%-5%的患者病情严重,伴有剧烈疼痛、炎症和威胁视力的角膜溃疡或压迫性视神经病变。
IBI311是首个治疗TED的国产抗IGF-1R单克隆抗体,今年2月,信达生物公布了IBI311的临床研究结果。
研究结果显示:第24周时,IBI311组和安慰剂组研究眼的眼球突出应答率分别为85.8%和3.8%,两组差异为81.9%。此外,研究的关键次要研究终点如研究眼的眼球总体应答率、研究眼临床活动性评分(CAS)为0或1的受试者百分比、研究眼的眼球突出度较基线的改变等均顺利达成,IBI311对上述指标的改善均显著优于安慰剂组。
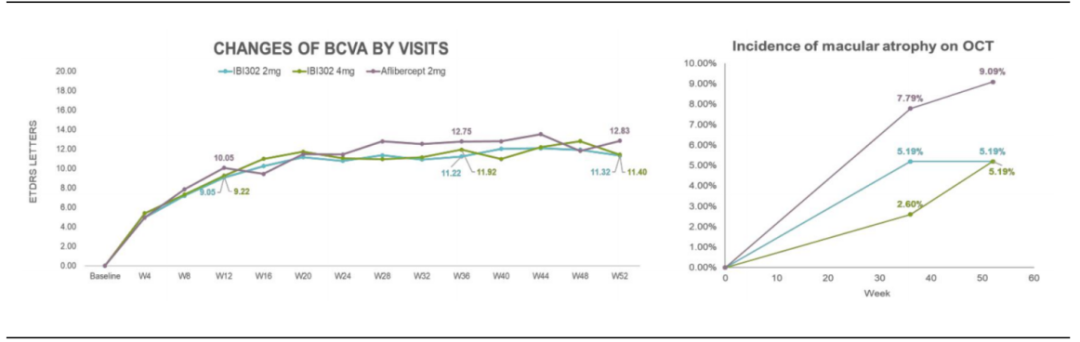
在年龄相关性黄斑变性(AMD)疾病方面,信达生物布局有IBI302。
IBI302是一种靶向VEGF和C3b/C4b的双特异性融合蛋白,可以通过同时抑制VEGF介导的血管生成和补体通路发挥疗效。与抗VEGF单一疗法比,IBI302可通过额外抑制补体级联以及抑制巨噬细胞浸润和M2巨噬细胞极化显示出更优的疗效。
2023年10月,IBI302治疗nAMD的III期临床研究(STAR)已完成首例受试者给药。作为全球首个靶向VEGF和补体的双特异性融合蛋白,IBI302非常值得期待。
在治疗痛风方面,信达生物从LG化学引进新药Tigulixostat(IBI128),这是一款黄嘌呤氧化酶抑制剂(XOI),可以通过抑制黄嘌呤氧化酶减少尿酸生成。与IBI128同靶点药物非布司他是国内降尿酸一线治疗的主要用药,但非布司他可能会增加心血管相关死亡风险而被FDA加了黑框警告,IBI128作为新一代XOI有望解决高尿酸/痛风领域未被满足的临床需求。
目前IBI128在海外已启动了两项国际多中心Ⅲ期临床研究,在国内尚处于IND阶段。
在治疗高血压方面,从圣因生物License-in的治疗高血压的小核酸(siRNA)药物SGB-3908临床试验申请已于7月8日获批。
作为超前沿项目,SGB-3908采用的新一代siRNA药物平台技术,临床前实验数据显示,SGB-3908能使高血压食蟹猴血清中AGT蛋白及相关生物标志物(ANG I、ANG II)显著下降,达到明显的降血压作用,作用效果持久,且未观察到低血压等安全性问题。
全球范围内看,SGB-3908目前处于AGT靶点siRNA药物的研发进展的第一梯队。
港股市场长期的低迷,无法全部体现当前中国Biotech的价值,复宏汉霖已经深刻地意识到这一点,并坚定地开启了私有化退市进程,未来可能会寻求溢价较高的A股市场或美股市场。信达生物或许也到了该考虑这个选项的时候了,随着未来两三年内管线开始进入收获期,信达生物有资格得到更多的肯定。
本文来源于互联网:信达生物剑指医药“二哥”宝座