2024年1月9日,GSK宣布将以10亿美元的预付款和多至4亿美元的里程碑付款收购Aiolos Bio公司,意在获得Aiolos的AIO-001。
AIO-001正是Aiolos Bio于2023年8月自恒瑞医药引进的SHR1905,短短半年,从License in到卖身,Aiolos Bio凭借一款TSLP药物完成华丽转身。
TSLP(胸腺基质淋巴细胞生成素)被认为是Th2 细胞介导的哮喘炎症的中央调节因子,在气道炎症的发生和持续中起着关键作用。TSLP可以驱动下游2型细胞因子的释放,从而导致炎症和哮喘症状。然而除哮喘外,TSLP与多种自身免疫性疾病、慢性炎症性疾病的发病有着密切关系,因此TSLP抗体药物具有广阔的市场应用前景,有望成为自身免疫疾病领域的重要靶点之一。
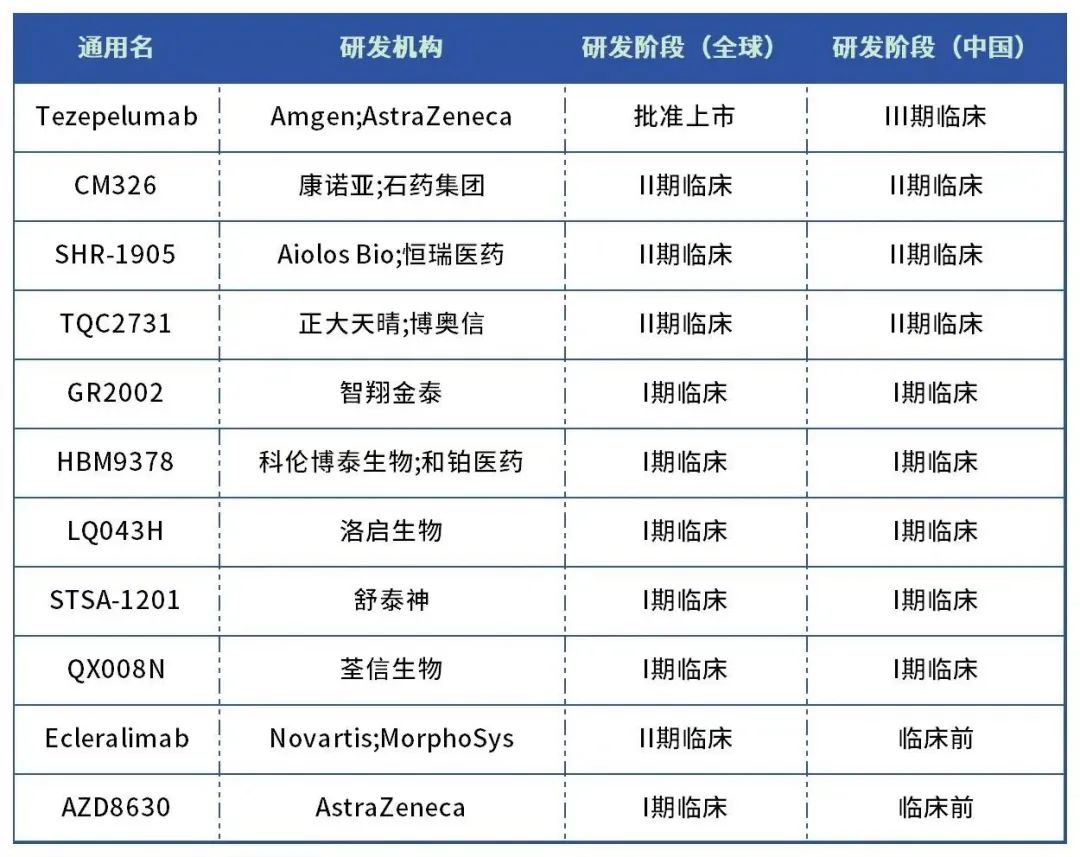
目前,全球仅一款TSLP单抗获批上市,为阿斯利康和安进联合研发的Tezepelumab(特泽鲁单抗),于2021年12月获FDA批准上市。三款TSLP单抗处于Ⅱ期,包括康诺亚和石药集团联合研发的CM326、恒瑞医药的SHR-1905、正大天晴/博奥信的TQC2731,此外,5款TSLP单抗处于临床Ⅰ期。
Tezepelumab是全球首款针对靶向胸腺间质淋巴细胞生成素(TSLP)的抗体药物,也是目前唯一被批准用于不受表型(例如嗜酸性粒细胞性哮喘或过敏性哮喘)或生物标志物限制的严重哮喘的生物制剂。但针对特应性皮炎适应症,随着两项二期研究的失败,阿斯利康已经放弃了该适应症的研发。
不过,Tezepelumab重症哮喘适应症有着十分优异的疗效,其III期临床试验显示:Tezepelumab组和安慰剂组的哮喘急性发作的年发作率分别为0.93和2.10(P<0.001),患者急发作率降低了56%。安全性方面,Tezepelumab组与安慰剂组的不良事件发生率分别为77.1%和80.8%,严重不良事件发生率分别为9.8%和13.7%,整体来看,Tezepelumab无明显的副作用。
正因如此,也因其突破治疗嗜酸性哮喘的局限,Tezepelumab在上市后销售额快速攀升,2022年销售额 1.74亿美元。EvaluatePharma预计Tezepelumab在2026年突破十亿美元年销售额大关,达到10.21亿美元。
国内对TSLP药物也备受关注,多款国产TSLP药物处于临床阶段,恒瑞医药、正大天晴、石药集团等企业纷纷入局。
(1)SHR-1905为恒瑞自主研发且具有知识产权的胸腺基质淋巴细胞生成素(TSLP)单克隆抗体,可以阻断炎症细胞因子的释放,抑制下游炎症信号的传导,最终改善炎症状态并控制疾病进展。2023年8月,恒瑞医药与美国Aiolos Bio(原名One Bio)达成协议,将1类新药SHR1905在大中华地区以外的全球开发和商业化独家权益有偿许可给Aiolos Bio。首付款和近期里程碑付款达2500万美元,研发及销售里程碑款累计可达10.25亿美元。
与Tezepelumab每四周皮下注射一次不同,SHR-1905可实现每六个月注射一次,依从性优势明显,这种差异化的设计有望成为BIC药物。
(2)CM326是由康诺亚研发的1.1类创新性生物制剂,石药集团负责其在中国大陆呼吸领域适应症的开发和商业化。CM326是国内首家进入临床阶段的抗TSLP靶点药物。2021年11月,石药集团与康诺亚签订协议,获得CM326在中重度哮喘和慢性阻塞性肺病(COPD)等呼吸系统疾病的独家授权开发及商业化权益。
(3)TQC2731(BSI-045B)是一款TSLP人源化单克隆抗体,其用于治疗哮喘适应症已处于Ⅱ期临床阶段,慢性鼻窦炎伴鼻息肉为其第2项适应症,于2023年5月获得CDE临床试验默示许可。2017年12月,博奥信与正大天晴签署合作协议,正大天晴获得BSI-045B的大中华区权益,博奥信则保留大中华区以外的所有适应症的开发和商业化权利。
(4)LQ043是洛启生物自主研发的靶向IL-4R的吸入式纳米抗体药物,用于治疗中重度哮喘。相比于常规注射式抗体药物避免了肝脏首过效应,降低了系统毒副作用风险。LQ043正在澳大利亚和中国同时开展I期临床研究。目前,澳大利亚Ia期临床研究已完成健康受试者单剂量爬坡,表现出良好的安全性和耐受性。与此同时,中国临床I期正在进行中;COPD适应症的注册申报正在进行中。
目前在全球TSLP靶点的在研项目中,仅三款药物的给药方式为吸入给药,分别为诺华/MorphoSys的Ecleralimab、AZ的AZD8630以及洛启生物的LQ043H。但诺华终止了其吸入式抗TSLP疗法Ecleralimab的开发,其终止原因可能与该吸入剂的吸入途径设计出现错误有关。
来源:药智头条
作者:橙子