由于急性髓细胞白血病(AML)的长期预后不理想,因此需要更有效的靶向治疗和新的联合治疗方案。近日,东南大学附属中大医院葛峥教授团队在国际知名学术杂志Experimental Hematology & Oncology发表文章Synergistic effect of HDAC inhibitor Chidamide with Cladribine on cell cycle arrest and apoptosis by targeting HDAC2/c-Myc/RCC1 axis in acute myeloid leukemia,通过临床前研究,为AML的治疗提供了一种潜在的高效治疗方案——西达本胺联合克拉屈滨方案,有望为AML的治疗带来突破。
急性髓系白血病(AML)是一组异质性恶性血液病,其前体细胞自我更新、增殖能力增强,分化能力下降,目前AML领域新药/新方案进展较为缓慢,标准的3+7诱导方案后,即便达到完全缓解(CR)、仍有超过50%的患者最终会复发。
组蛋白去乙酰化酶抑制剂(HDACi)是一组表观遗传调节剂,已被证明在AML中具有抗白血病作用。西达本胺(CHI)是一种新的亚型选择性HDACi,可以在低浓度下选择性抑制I类(HDAC1、2和3)和IIb类(HDAC10) HDAC的活性,已被批准用于治疗外周T细胞淋巴瘤。据报道,在AML中,CHI可以单独或与其他药物联合抑制细胞增殖,诱导G0/G1阻滞,增加细胞凋亡和化学敏感性。
克拉屈滨(CLA)是一种嘌呤核苷抗代谢类似物,通过嘌呤核苷补救途径代谢。CLA三磷酸(CLA的磷酸化代谢产物)结合到DNA中,导致DNA单链断裂,并引发细胞凋亡,被开发用于治疗血液恶性肿瘤。
用不同剂量的CHI处理AML细胞系U937、THP-1和MV4-11,结果显示CHI以剂量和时间依赖的方式抑制细胞活力。与对照组相比,CHI显著增加U937细胞中G0/G1期的百分比(对照组:39.04±0.85%对CHI 4μm:83.79±0.85%,p < 0.001与CHI 8 μM相比:91.44±0.65%,p < 0.001与CHI 16 μM相比:96.85±0.88%,p < 0.001),在THP-1和MV4-11细胞中也观察到类似的结果;另外,与对照组相比,CHI处理以剂量依赖性方式显著增加了AML细胞的凋亡率。
与单一药物对照相比,CHI联合克拉屈滨(CLA)对来自健康供者的PBMC的毒性作用没有显著增强;与单一药物或DMSO对照相比,CHI联合CLA显著抑制了AML细胞的增殖。CompuSyn分析显示该组合对AML细胞的增殖抑制具有协同作用。
与单一药物对照相比,CHI联合CLA显著增加了U937、THP-1和MV4-11中的G0/ G1期阻滞。定量数据显示,与DMSO对照相比,在U937(对照:46.79±0.43% vs. 62.27±0.88%,p < 0.001)、MV4-11(60.20±1.39% vs. 63.17±0.24%,p < 0.001)中,CLA在低剂量(0.02 μM)下显著诱导G0/G1期阻滞,但在THP-1细胞系中不诱导(49.95±0.52%)。WB进一步结果显示,与单一药物对照相比,CHI联合CLA显著增加了关键的细胞周期蛋白依赖性激酶抑制剂家族成员p21 Waf1/Cip1蛋白的水平,但是降低了G1向S细胞期进展的限速途径因子CDK2和细胞周期蛋白E2。
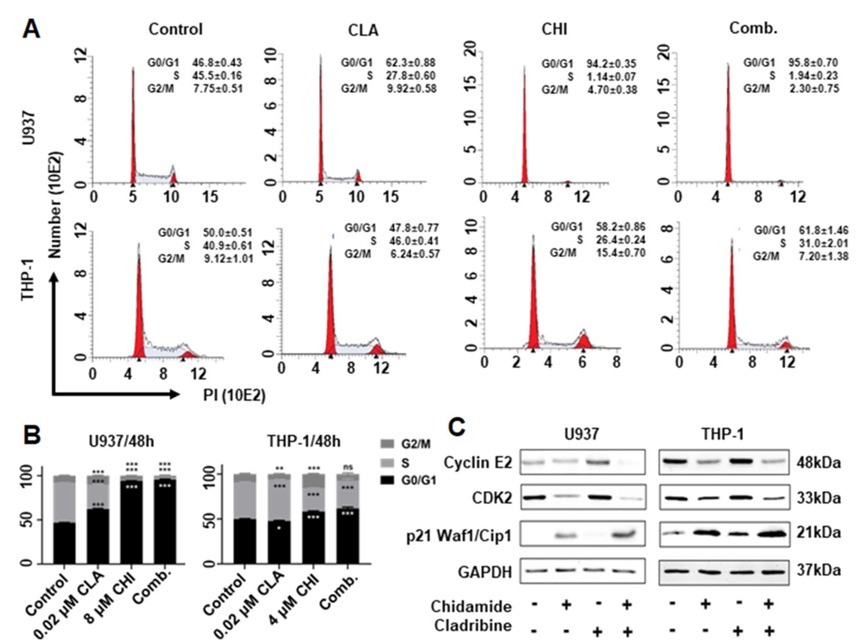
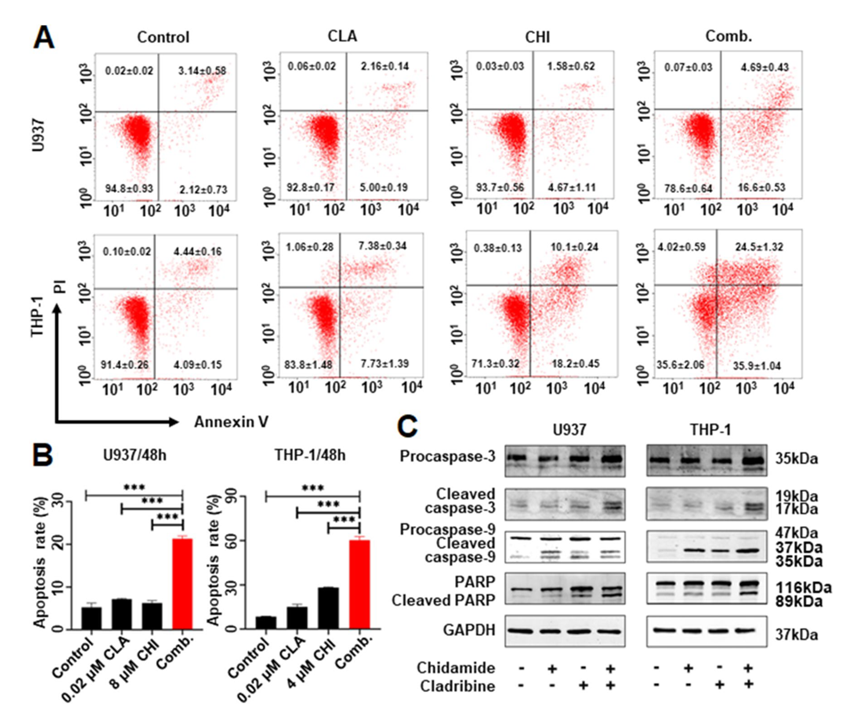
与单一药物对照相比,CHI联合CLA显著增加了THP-1(60.37±2.36%对28.24±0.39%,p < 0.01)、U937(21.29±0.66%对6.25±0.56%,p < 0.001)和MV4-11(17.43±0.26%对9.89±1.62%,p < 0.001)中的细胞凋亡,WB数据进一步显示该组合显著增加了凋亡相关蛋白(caspase-9、caspase-3和PARP)的表达。
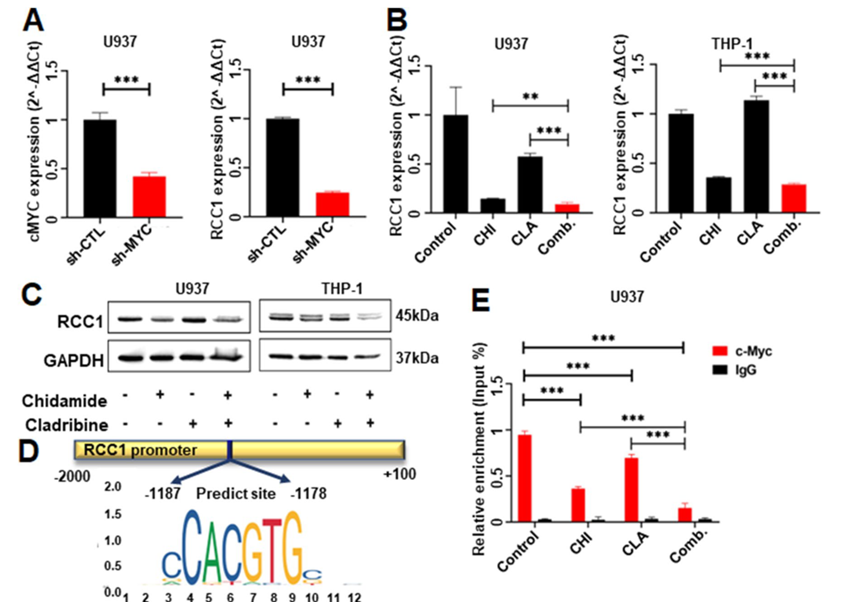
通过转录组分析,发现c-Myc是联合治疗方案中的关键分子。与单一药物对照相比,CHI联合CLA显著抑制了AML细胞中的c-MYC表达,并且c-MYC敲低显著增加了U937细胞对该组合的敏感性。
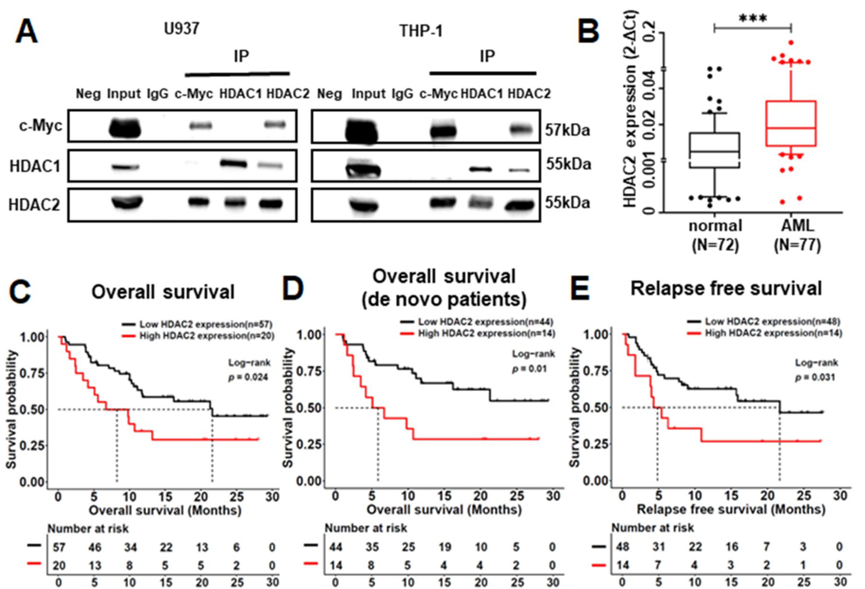
co-IP分析结果显示,HDAC2可以在U937、THP1和MV4-11细胞中免疫沉淀c-Myc,而HDAC1不能。
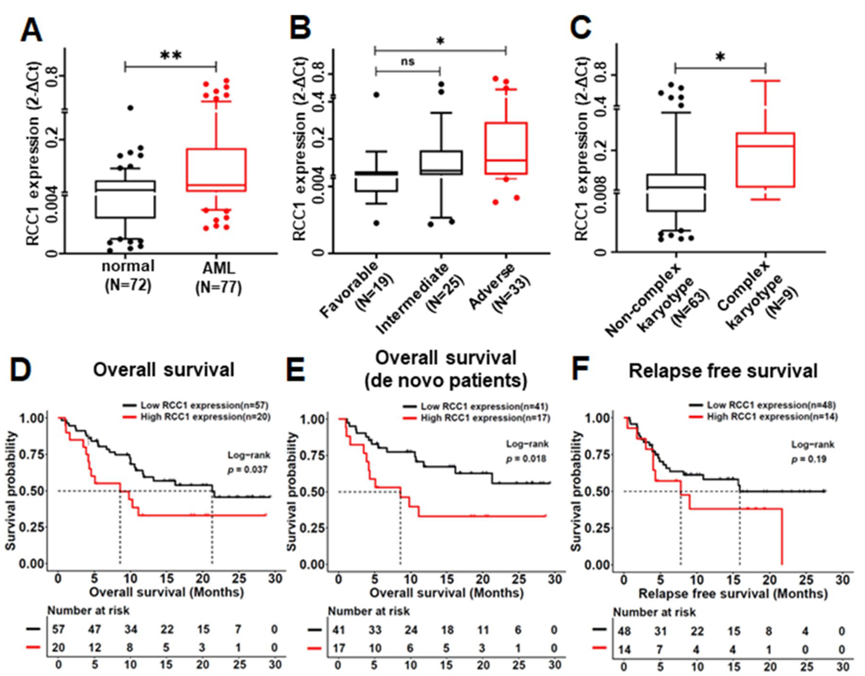
RT-qPCR检测发现HDAC2在AML患者中高表达。进一步将入组的AML患者分为HDAC2 high组(最高25%,n = 20)和HDAC2 low组(最低75%,n = 57)。HDAC2 high组患者中-5/5q的比例远高于HDAC2 low组(20% vs. 3.5%,p < 0.05)。存活曲线显示,高表达HDAC2的患者,总存活率(OS)以及无复发存活率(RFS)更短,提示HDAC2高表达与不良预后相关。
通过分析造血干细胞和祖细胞的ChIP-seq数据,发现RCC1与c-MYC正相关。根据mRNA强度将AML患者分为RCC 1 high组(最高25%,n = 20)和RCC 1 low组(最低75%,n = 57)。诊断时,RCC 1 high组的骨髓原始细胞比RCC 1 low组高得多[72.4%(12.4–96.0) vs. 43%(6.05–94.8),p < 0.05];诱导治疗后,RCC 1 high组的CR率显著低于RCC 1 low组(55.0%比84.2%,p < 0.05);根据2017年ELA风险分层,RCC 1 high组的不良队列比例明显高于RCC 1 low组(70.0% vs. 33.3%,p < 0.05);另外,RCC 1 high组中KMT2A重排(20.0% vs. 3.5%,p < 0.05)和复杂核型(37.5% vs. 5.4%,p < 0.05)的发生率显著更高。
存活曲线显示,与具有低RCC1的患者相比,具有高RCC1的患者与较短的OS显著相关,RFS也有类似但不显著的趋势。
与shCTL相比,c-MYC敲除显著降低了U937细胞系中的RCC1 mRNA水平。与DMSO对照以及单一药物相比,CHI联合CLA显著下调RCC1。通过JASPAR在线工具显示,c-Myc与RCC1的启动子显著结合,并且与单一药物对照相比,西达本胺联合方案显著降低了RCC1的启动子区域中的c-Myc结合。这些数据证实了RCC1是急性髓细胞白血病中c-Myc的下游效应子。
总之,这些数据表明CHI联合CLA通过靶向AML细胞中的c-Myc/RCC1信号传导来发挥其抗白血病作用。
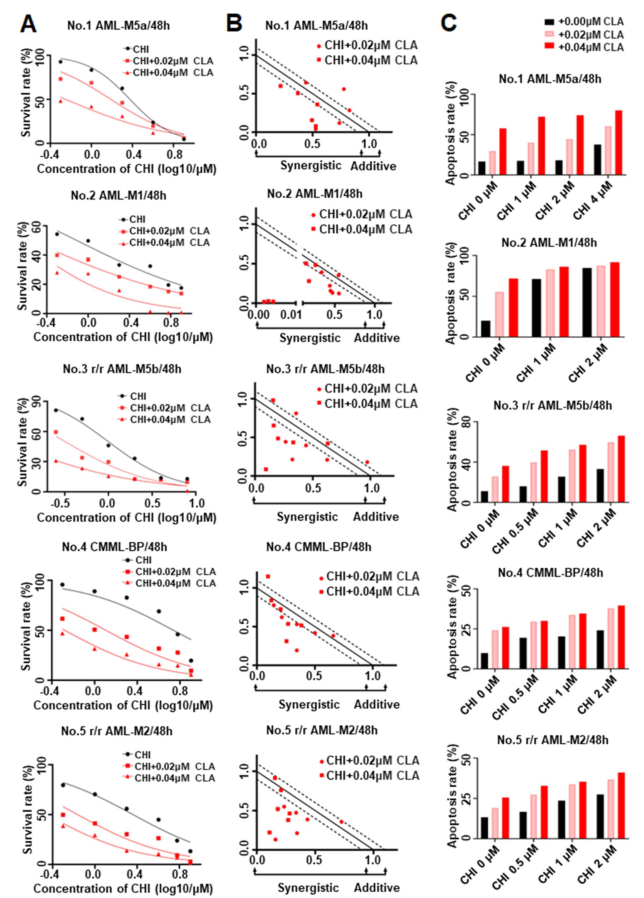
在AML1-ETO融合、c-KIT突变、MLL-AF6融合、FLT3-ITD突变的AML患者和具有复杂核型的CMML-BP患者细胞实验证实,CHI联合CLA显著抑制了细胞生长并诱导原代细胞凋亡,并且CompuSyn分析显示该组合具有协同效应。
研究表明,西达本胺联合克拉屈滨通过靶向AML细胞中的HDAC2/c-Myc/RCC1信号传导,在细胞增殖停滞、细胞凋亡和细胞周期停滞方面具有协同效应。此研究结果为正在进行的关于西达本胺联合克拉屈滨治疗AML患者的临床试验(临床试验ID: NCT05330364)提供了临床前证据。
葛峥 教授
东南大学附属中大医院
东南大学血液病研究所所长
东南大学附属中大医院血液科科主任
江苏省医学会血液学分会副主任委员
江苏省医师协会血液科医师分会副会长
江苏省研究型医院学会白血病和MDS专委会主任委员
中国医师协会血液科医师分会委员
中国抗癌协会血液肿瘤中国MDS和MPN工作组专家委员
中国老年医学会血液学分会委员
中华中医药学会血液病分会常委委员
中国中西医结合学会血液学分会委员
南京医学会血液病分会副主任委员
东南大学血液病国际合作实验室主任
瑞典卡罗林斯卡医学院博士,美国宾夕法尼亚州立大学医学院兼职副教授
江苏省“333高层次人才工程”中青年领军人才