近日,国际知名学术期刊Cancer letters(JCR 1区,2022年IF 9.756)发表了厦门大学附属第一医院徐兵教授团队的最新研究Therapeutic inhibition of PPARα-HIF1α-PGK1 signaling targets leukemia stem and progenitor cells in acute myeloid leukemia,研究发现西格列他钠(Chiglitazar)能够靶向PPARα-HIF1α-PGK1信号通路,从而发挥潜在的抗急性髓系白血病(AML)干祖细胞的效应,有望成为靶向治疗AML的新希望。



急性髓系白血病(AML)来源于遗传和/或表观遗传异常的AML干祖细胞。尽管近些年出现了新的靶向治疗(如BCL2抑制剂、FLT3抑制剂、IDH抑制剂等),但AML患者长期存活率仍然很低,即使对诱导治疗有反应的患者,5年总生存率(OS)也只有40%~50%,而在60岁以上的患者,预后更差。
AML复发通常是由于白血病干细胞耐药(AML-LSC),而骨髓微环境中的糖酵解能够协助维持LSC的存在,这也是导致AML复发的原因之一。依赖PPAR的代谢途径是细胞内能量代谢的主要调节者,并参与肿瘤细胞糖酵解的解除调节;此外,PPARα下游转录因子HIFα在AML中过表达,并在化疗耐药中发挥重要作用。因此,靶向PPARα通路可能会根除LSCs,从而有望治疗AML。
在大量临床使用的PPAR激动剂中,Chiglitazar(西格列他钠)是一种非TZD结构的PPAR全激动剂,目前SFDA批准用于治疗2型糖尿病。在AML中,PPARα的作用和Chiglitazar的抗白血病活性尚未得到充分的评价。


1. Chiglitazar增强PPARα的表达及对白血病干祖细胞的体外杀伤作用
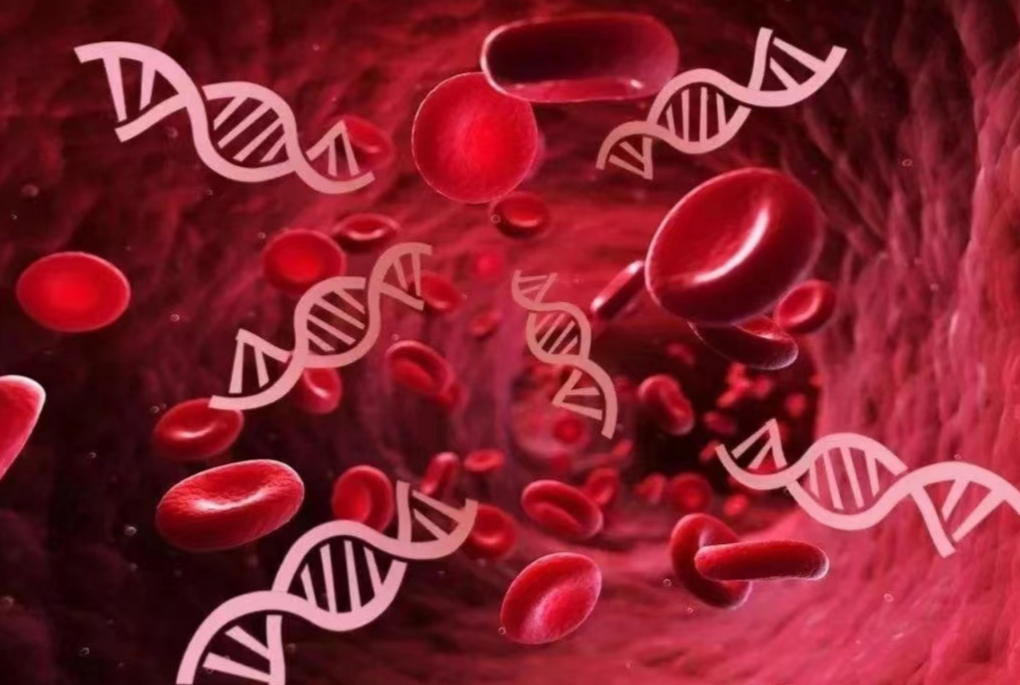
体外实验证实,Chiglitazar以剂量和时间依赖的方式显著抑制CD34+和CD38–的KG-1α和KASUMI-1细胞增殖和降低细胞活力,诱导CD34+和CD38–的KG-1α和KASUMI-1细胞发生凋亡,并导致CD34+和CD38–的KG-1α和KASUMI-1细胞周期停滞于G2期;Co-IP以及分子对接分析显示,Chiglitazar显著抑制PPARα在CD34+和CD38–的KG-1α和KASUMI-1细胞中的泛素化,在蛋白水平激活了白血病干细胞中的PPARα。
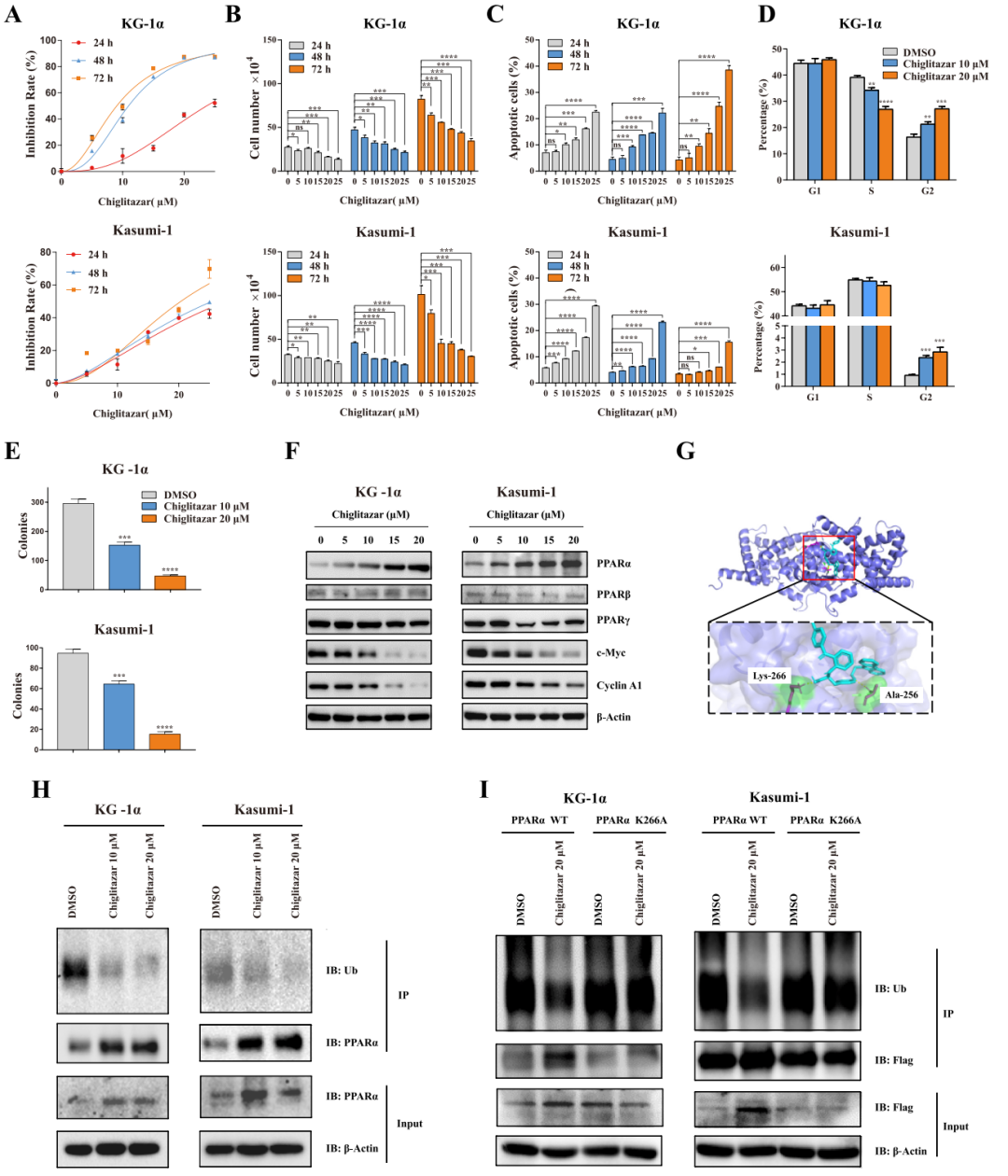
2. Chiglitazar抑制CDX小鼠模型中AML的成瘤进展
活体成像分析显示Chiglitazar显著抑制CD34+和CD38–的KG-1α和KASUMI-1细胞在NSG小鼠体内的成瘤进展;小鼠存活率分析显示Chiglitazar改善了CDX小鼠的存活率;细胞流式结果显示Chiglitazar显著抑制了AML细胞在CDX小鼠外周血,脾脏以及骨髓中的浸润。
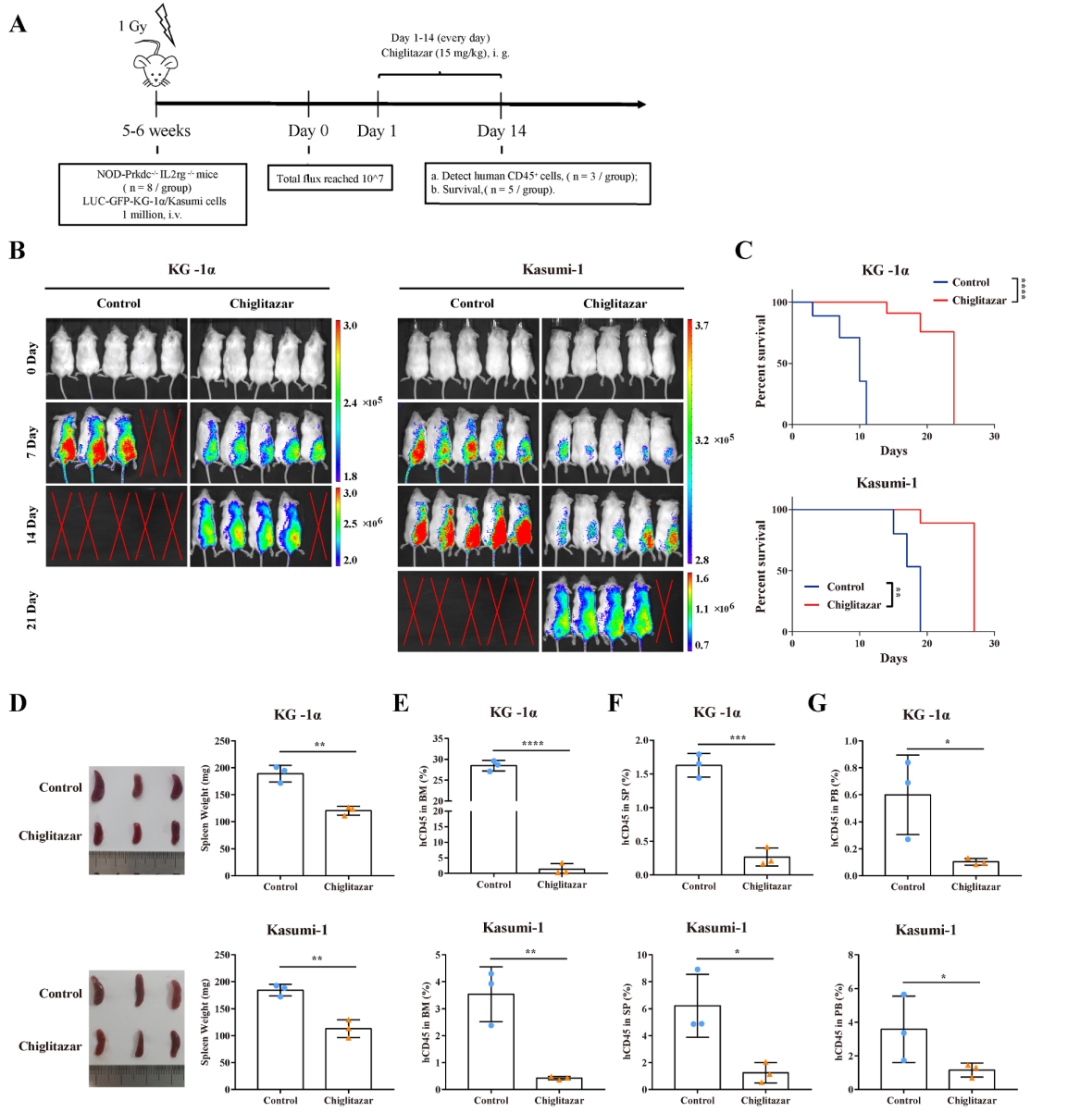
3. Chiglitazar阻断HIF1α信号从而降低人白血病干细胞的糖代谢
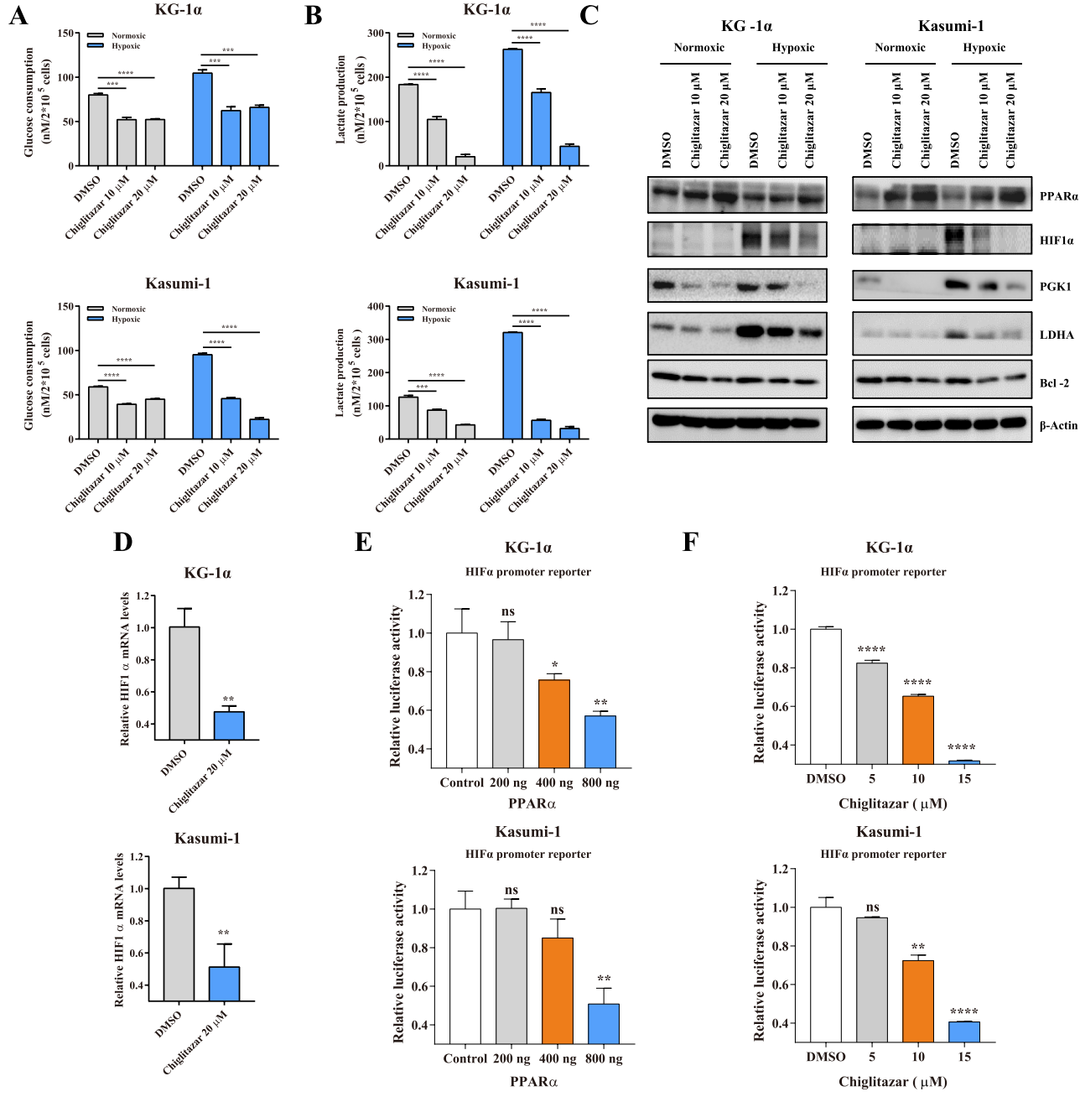
代谢实验显示,在常氧和低氧条件下,Chiglitazar抑制CD34+和CD38–的KG-1α和KASUMI-1细胞中的糖酵解水平;Western blotting和RT-qPCR法显示,在常氧和低氧条件下,Chiglitazar在CD34+和CD38–的KG-1α和KASUMI-1细胞中抑制HIF1α mRNA及其靶基因如PGK1、LDHA、Glt1、HK2和Bcl2的表达;启动子报告实验显示Chiglitazar以及PPARα显著抑制HIF1α的启动子活性;证实Chiglitazar抑制AML干祖细胞的葡萄糖代谢,可能与抑制HIF1α信号通路有关。
4. PPARα直接与HIF1α结合,并抑制其向PGK1基因启动子的募集
细胞实验发现,HIF1α的过表达显著增强了PGK1基因启动子的转录活性,但这一活性被PPARα的过表达所削弱;同时还观察到PGK1基因启动子的转录活性在Kasumi-1细胞中被PPARα过表达或Chiglitazar处理抑制;Co-IP和His-Pull down实验表明,PPARα与HIF1α在CD34+和CD38–的KG-1α和KASUMI-1细胞中直接相互作用。ChIP检测进一步发现,Chiglitazar处理能显著抑制缺氧条件下HIF1α在CD34+和CD38–的KG-1α和kasumi-1细胞中对PGK1基因启动子的募集。流式细胞分析以及CCK-8实验分析发现,HIF1α的表达能够挽救Chiglitazar诱导的细胞凋亡以及细胞活力抑制,且能够恢复下游目标基因的表达。
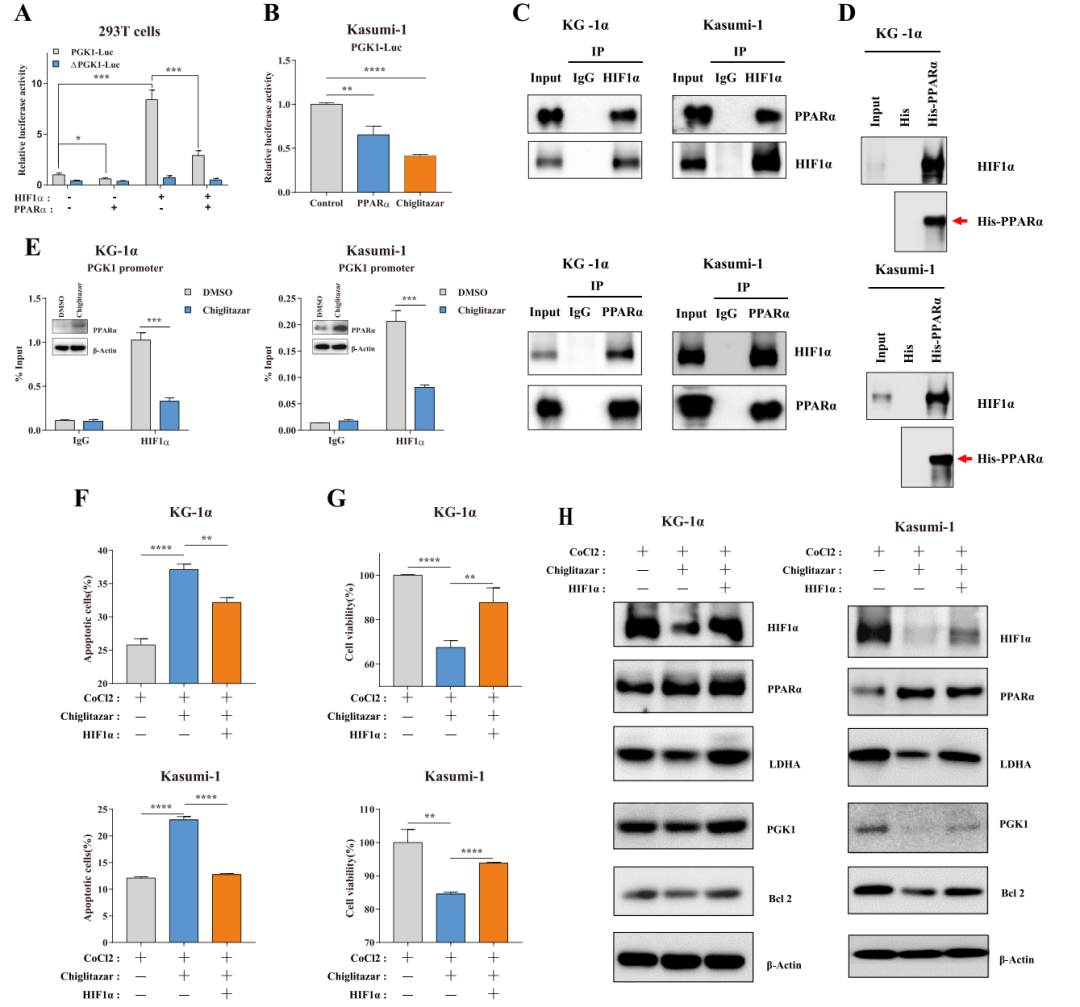
5. Chiglitazar选择性靶向原代CD34+AML细胞
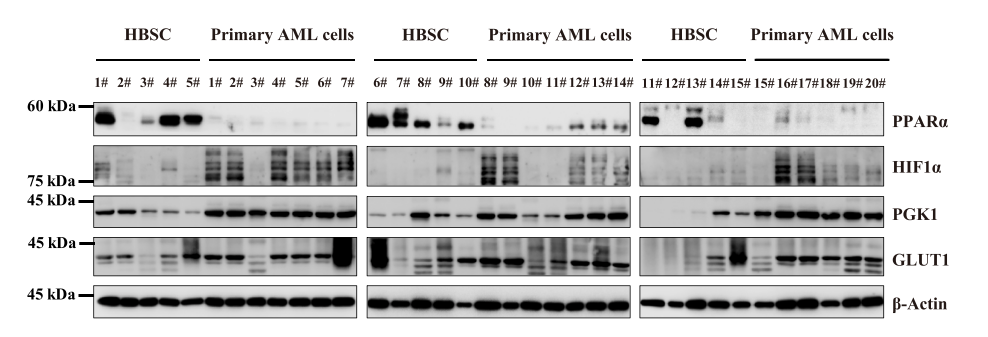
Western blotting发现,PPARα在几乎所有AML患者的原代CD34+细胞中低表达,而HIF1α及其靶基因(如PGK1、GLUT1)的表达相对较高,表明两者之间存在负相关。细胞培养试验发现,Chiglitazar以剂量依赖的方式诱导原代CD34+AML细胞凋亡、抑制其增殖,但对正常外周血单个核细胞(PBMC)和造血干细胞(HBSC)并没有细胞毒性;Western blotting发现,在低氧条件下,Chiglitazar可抑制CD34+AML细胞HIF1α及其靶基因PGK1和Glut1的蛋白表达。这或许与原代CD34+AML细胞和正常HPSC之间PPARa的差异表达有关。
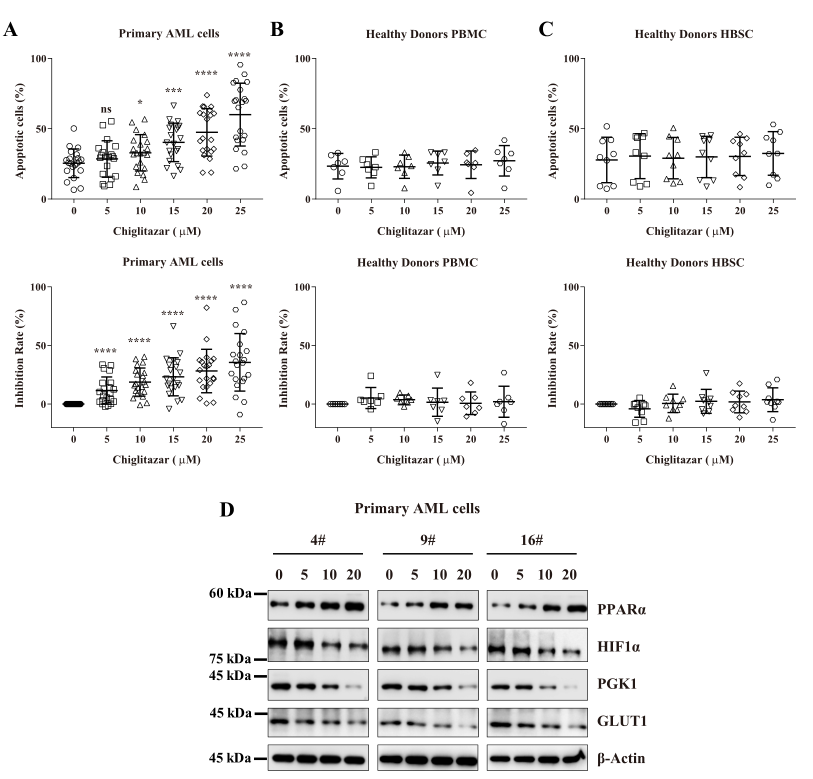
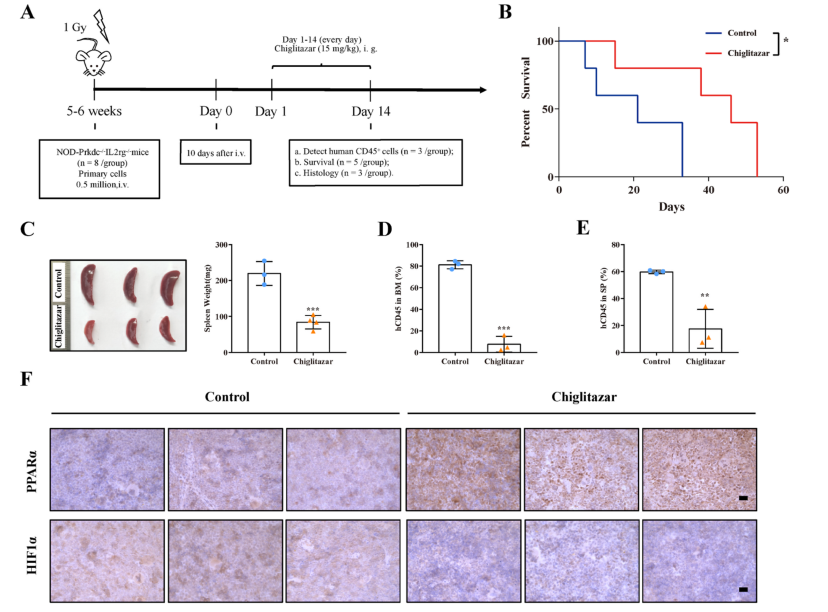
6.Chiglitazar抑制人源化AML小鼠模型的疾病进展
Chiglitazar治疗后的AML PDX模型小鼠,其骨髓、脾脏中的hCD45+细胞显著减少;免疫组化显示,Chiglitazar处理后增加了小鼠脾脏中PPARα的蛋白水平,但降低了HIF1α的水平。这些结果显示出Chiglitazar潜在的抗白血病活性。


该项研究揭示了PPAR信号,特别是其下游转录因子HIF1α,是有前景的AML治疗靶点。同时,Chiglitazar能够特异性激活PPARα,通过阻断HIF1α信号,有效地靶向AML干祖细胞,因此可能是一种很有前途的抗白血病药物。鉴于AML干祖细胞与AML的疾病复发和进展有关,Chiglitazar与当前的一线治疗相结合,值得在AML的治疗中进行进一步的转化医学研究。

徐 兵 教授
厦门大学附属第一医院
二级主任医师、教授、博士生导师,
国务院特殊津贴专家
福建省突出贡献中青年专家
厦门大学血液病学系主任,厦门大学血液病研究所所长
厦门大学附属第一医院院务委员、血液科主任兼内科 教研室主任、内科规培基地主任
中国医师协会血液科医师分会常委
中国老年医学会血液分会副会长兼白血病工作委员会主委
中国滤泡淋巴瘤工作组组长
中国抗癌协会血液肿瘤和淋巴瘤专业委员会常委
获省部级科技进步一、二等奖4项,主持国家自然科学基金重点及面上项目6项,以第一或通讯作者在BLOOD、JHO等杂志发表论文200余篇,其中SCI论文80多篇, 5分以上30多篇,20分以上4篇,总影响因子超过460分。

爱谱新程 加C先行|30场病例直播周享汇,全年精华一网打尽!
徐兵教授:西达本胺联合维奈克拉有望成为R/R AML患者提供更优的治疗选择
【2022 ESMO IO】西达本胺联合替雷利珠单抗和化疗一线治疗晚期NSCLC实现ORR和PFS双突破
ASH速递|2022年ASH年会盘点之HDACi西达本胺:厚积薄发,多点开花
张薇教授:回顾性分析中国血管免疫母细胞淋巴瘤,构建新型预后模型
蔡真教授:西达本胺联合方案可以通过上调BIM表达而发挥抗MM作用
孙自敏教授团队:西达本胺联合方案为R/R AML患者的桥接移植创造可能
1种维持选择,2年mPFS:HDAC抑制剂为淋巴瘤患者长期生存助力
苏州大学附属第一医院血液团队最新发表复发难治AML研究结果:双表观方案为复发/难治AML治疗另辟蹊径