
摘要
背景:NF-E2相关因子2(Nrf2)参与食管鳞状细胞癌(ESCC)的抗辐射性,但潜在的分子机制尚不清楚。我们的研究目的是探讨Nrf2在ESCC的抗辐射性中的作用和潜在的分子机理。
结果:用慢病毒将Nrf2表达引入Ec109和KYSE-30 ESCC细胞。使用CCK-8和集落形成测定法来评估Nrf2对培养物中抗辐射性的影响。通过蛋白质印迹、流式细胞仪和共聚焦荧光显微镜评估自噬水平。通过染色质免疫沉淀研究了Nrf2对Ca2 + /钙调蛋白依赖性蛋白激酶IIα(CaMKIIα)转录的影响。我们发现Nrf2的过表达增加了ESCC细胞的抗辐射性。从机制上讲,Nrf2通过靶向CaMKIIα并随后激活自噬来触发ESCC细胞的抗辐射性。此外,我们发现Nrf2通过与其启动子区域结合直接调节CaMKIIα的转录。在异种移植小鼠模型和ESCC患者样品中也都研究了Nrf2对抗辐射性的影响。与体外研究的结果一致,高Nrf2表达水平在Ec109衍生的异种移植小鼠模型中导致体内抗辐射性。此外,我们还证明Nrf2和CaMKIIα的上调与ESCC患者较低的生存率密切相关。
结论:我们的研究表明,Nrf2通过靶向CaMKIIα并随后激活自噬来促进ESCC的抗辐射性,其特征是抑制磷酸化的mTOR和p62,激活Beclin 1以及将LC3-I转化为LC3-II。
背景
NF-E2相关因子2(Nrf2)是一种转录因子,对维持正常的细胞生物学过程至关重要。 Nrf2的失调被认为是致癌的关键分子事件之一。近年来,许多研究已经报道Nrf2的异常激活增强了食管鳞状细胞癌(ESCC)对放化疗(CRT)的耐药性。但是,尚不清楚Nrf2介导的抗辐射性的确切分子机制。
自噬是一种生物过程,涉及营养应激条件下细胞质大分子和细胞器的自降解。作为一个适应性反应,自噬可以被多种治疗癌症的方法激活,以促进癌症存活。最近的研究表明自噬可以介导ESCC的抗辐射性。据报道自噬激活在真核延伸因子2激酶(eEF2K)诱导的ESCC抗辐射性中起关键作用。有文献报道HMGB1通过激活自噬增强了ESCC的抗辐射性。还发现自噬增加是由肝激酶B1(LKB1)诱导的ESCC抗辐射性的主要机制。自噬诱导的抗辐射性的机制,特别是自噬是否与Nrf2介导的抗辐射性有关,值得进一步研究。
Ca2 + /钙调蛋白依赖性蛋白激酶II(CaMKII)是钙/钙调蛋白激活的蛋白激酶家族的重要成员,并且CaMKII在突触刺激和T细胞受体信号转导中起作用。越来越多的研究还表明,CaMKII的异常激活是促进多种癌症的信号转导节点。在先前的研究中,我们证实了CaMKIIα可以通过调节自噬信号通路来影响食道癌细胞对CDr-Me(一种Nrf2诱导剂)的敏感性。但是,迄今为止,还没有关于CaMKIIα在Nrf2介导的抗辐射性和自噬激活中的作用的报道。
在这项研究中,我们研究了Nrf2介导的ESCC抗辐射性的潜在机制。我们的研究表明Nrf2通过上调ESCC细胞中的自噬水平来触发抗辐射性。我们还发现,CaMKIIα是参与Nrf2诱导的自噬激活和抗辐射的关键分子。从机制上讲,Nrf2通过激活ESCC中的转录活性来诱导CaMKIIα的表达。这些结果为进一步研究Nrf2介导的抗ESCC分子机制提供了新思路,并提供了一种潜在的手段,通过靶向Nrf2 /CaMKIIα/自噬信号通路提高ESCC的放射敏感性。
结果
1.Nrf2触发食道癌细胞的抗辐射性
为了确定Nrf2是否参与食管癌细胞的抗辐射性,我们首先使用慢病毒转导方法在Ec109和KYSE-30细胞中过表达Nrf2。qRT-PCR和Western印迹分析证实,慢病毒转导在Ec109和KYSE-30细胞中均增加了Nrf2表达。通过蛋白质印迹分析还观察到了ESCC细胞中NAD(P)H醌脱氢酶1(NQO1)的上调,这表明Nrf2的活性被诱导。在随后的分析中,用不同剂量的辐射处理ESCC细胞。通过CCK-8和集落形成试验评估了Nrf2对Ec109和KYSE-30细胞放射敏感性的影响。有趣的是,CCK-8和集落形成试验都证明,过表达Nrf2的Ec109细胞比野生型细胞对辐射的耐受性更高。在KYSE-30细胞中也得到了类似的结果。这些结果表明Nrf2触发食道癌细胞中的抗辐射性。
2.Nrf2的过表达增加食管癌细胞中的自噬
越来越多的证据表明自噬有助于癌细胞的抗辐射性。减少自噬已经显示使肿瘤细胞对放疗更敏感。为了探讨自噬是否在Nrf2诱导的抗辐射增强中起作用,我们将Nrf2转染到Ec109和KYSE-30细胞中,然后测量了磷酸化的mTOR,Beclin 1,p62和LC3的水平。免疫印迹结果表明,在过表达Nrf2的ESCC细胞中磷酸化的mTOR和p62水平降低。Nrf2触发Beclin 1的上调。在过表达Nrf2的Ec109和KYSE-30细胞中也观察到LC3-I向LC3-II的转化。接下来,我们通过流式细胞术分析了Nrf2在ESCC细胞中的自噬诱导作用。结果表明自噬Ec109和KYSE-30细胞的数量分别增加了3倍和2.5倍。通过共聚焦显微镜分析进一步证实了这些结果。共聚焦显微镜分析显示,Nrf2过表达细胞的绿色点状结构显著增加,分布在核周区域,并集中分布在细胞质中,表明Nrf2的上调增加了食管癌细胞的自噬水平。这些数据表明,Nrf2激活食管癌细胞中的自噬通量,这可能有助于抗辐射。
3.Nrf2通过CaMKIIα激活自噬促进食道癌细胞的抗辐射性
我们先前的研究报道,CDDO-Me可能在食管癌细胞中上调CaMKIIα。为了确定CaMKIIα是否与Nrf2触发的抗辐射性有关,首先进行了蛋白质印迹分析。在过表达Nrf2的Ec109细胞中检测到CaMKIIα和磷酸化的CaMKIIα的蛋白质水平增加。在KYSE-30细胞中,仅观察到磷酸化CaMKIIα的水平增加。接下来,我们用CaMKIIα抑制剂KN-93处理了过表达Nrf2的Ec109细胞。CCK-8和菌落形成实验的分析结果表明,KN-93处理可以部分逆转Nrf2触发的抗辐射性。为了进一步验证CaMKIIα在Nrf2介导的抗辐射性中的作用,通过蛋白质印迹,流式细胞术和共聚焦显微镜评估了用KN-93处理的Nrf2过表达的Ec109细胞的自噬水平。正如预期的那样,我们发现Nrf2诱导的自噬被CaMKIIα抑制剂逆转了。由此,我们发现Nrf2通过靶向CaMKIIα并激活自噬增强了ESCC细胞的抗辐射性。
4.Nrf2通过调节启动子活性来激活CaMKIIα转录
由于Nrf2是转录因子,因此我们假设Nrf2可能直接调节CaMKIIα的转录。为了证明Nrf2通过作用于其启动子来影响CaMKIIα的转录,我们首先进行了生物信息学分析。在线数据库筛选显示,Nrf2结合位点(抗氧化反应元件,ARE)位于距CaMKIIα启动子区域转录起始位点− 960 bp处。为了检查Nrf2和CaMKIIαARE之间的相互作用,进行了染色质免疫沉淀(ChIP)-qPCR(ChIP-qPCR)分析。结果表明,与野生型ESCC细胞相比,在Nrf2过表达的ESCC细胞中,CaMKIIαARE特异的qPCR信号增加。在位于NQO1上游的ARE中观察到了相同的趋势,但在非Nrf2靶序列RPL30外显子3中却没有观察到相同的趋势。最终,蛋白质印迹分析结果显示Nrf2-siRNA组中CaMKIIα的水平显著下调。这些结果表明Nrf2通过调节其启动子活性来激活CaMKIIα转录。
5.Nrf2在体内增强食管癌的抗辐射能力
为了探索Nrf2在体内介导ESCC放射抗性中的功能,我们通过皮下注射野生型Ec109细胞和过表达Nrf2的Ec109细胞建立了ESCC异种移植模型,并用放射线处理了荷瘤小鼠。放射疗法在体内抑制两种Ec109细胞的增殖。但是,Nrf2的过表达可以在很大程度上消除Ec109肿瘤的放射敏感性。与体外结果一致,免疫组化(IHC)染色显示Nrf2在体内促进了CaMKIIα和LC3-II的表达。综上所述,我们的观察结果表明,Nrf2增强了ESCC体内的抗辐射性。
6.Nrf2和CaMKIIα表达的上调与食管癌患者的预后有关
为了进一步探讨Nrf2和CaMKIIα在食管癌患者中的功能,通过IHC分析了食管癌组织中Nrf2和CaMKIIα的蛋白水平。结果表明,Nrf2主要在细胞质中表达。我们队列中共有58.9%的ESCC患者显示Nrf2的高表达。CaMKIIα主要在细胞核中表达。总计45.4%的ESCC患者显示CaMKIIα高表达。进一步的Kaplan–Meier分析发现,Nrf2或CaMKIIα的表达水平对ESCC患者的预后没有影响。但是,同时表达CaMKIIα和Nrf2的ESCC患者的预后要差于高表达CaMKIIα但低表达Nrf2的ESCC患者。所有这些结果表明,Nrf2和CaMKIIα表达的上调与ESCC患者存活率降低密切相关。
结论
我们已经显示,Nrf2通过与CaMKIIα直接相互作用,在体外和体内诱导ESCC细胞的抗辐射性,然后触发自噬,这与磷酸化mTOR和p62的减少,Beclin 1的活化以及LC3-I向LC3-II的转化有关。这些数据表明,Nrf2是ESCC患者放射增敏治疗发展中的有希望的靶标。
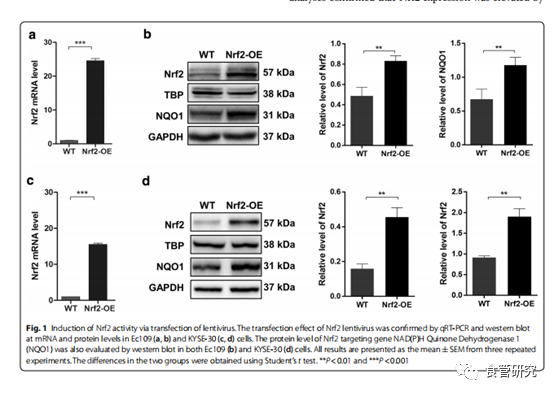
图1. 通过慢病毒转染诱导Nrf2活性。通过qRT-PCR和Western blot证实了Nrf2慢病毒在Ec109(a,b)和KYSE-30(c,d)细胞中的mRNA和蛋白水平上的转染效果。还通过蛋白质印迹法在Ec109(b)和KYSE-30(d)细胞中评估了Nrf2靶向基因NAD(P)H醌脱氢酶1(NQO1)的蛋白水平。所有结果均表示为来自三个重复实验的平均值±SEM。两组之间的差异是使用t检验得出的。** P <0.01和*** P <0.001。
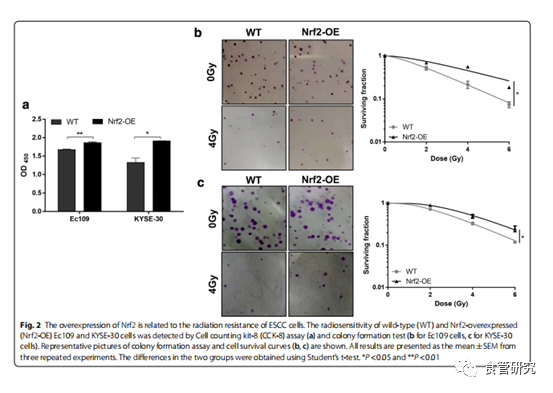
图2. Nrf2的过表达与ESCC细胞的抗辐射能力有关。通过细胞计数试剂盒8(CCK-8)测定(a)和集落形成试验(b用于Ec109细胞)检测野生型(WT)和Nrf2过表达(Nrf2-OE)Ec109和KYSE-30细胞的放射敏感性)。显示了菌落形成测定法和细胞存活曲线(b,c)的代表性图片。所有结果均表示为来自三个重复实验的平均值±SEM。两组之间的差异是使用t检验得出的。* P <0.05和** P <0.01。
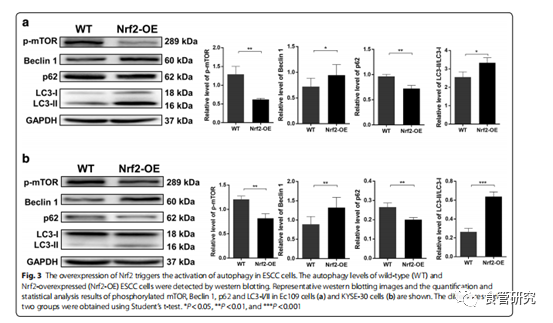
图3. Nrf2的过表达触发ESCC细胞中自噬的激活。通过western印迹检测野生型(WT)和Nrf2过表达(Nrf2-OE)的ESCC细胞的自噬水平。显示了代表性的蛋白质印迹图像以及Ec109细胞(a)和KYSE-30细胞(b)中磷酸化的mTOR,Beclin 1,p62和LC3-I / II的定量和统计分析结果。两组之间的差异是使用t检验得出的。* P <0.05,** P <0.01和*** P <0.001。
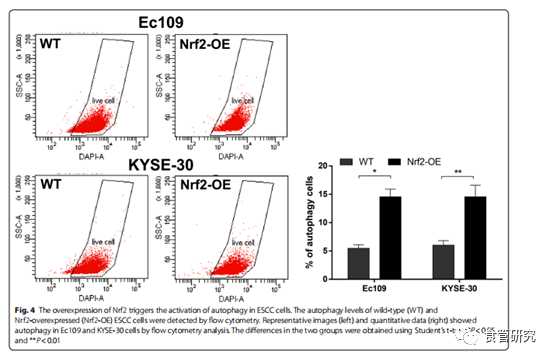
图4. Nrf2的过表达触发ESCC细胞中自噬的激活。流式细胞仪检测野生型(WT)和过表达Nrf2(Nrf2-OE)的ESCC细胞的自噬水平。通过流式细胞术分析,代表性图像(左)和定量数据(右)显示Ec109和KYSE-30细胞中的自噬。两组之间的差异是使用t检验得出的。* P <0.05和** P <0.01。
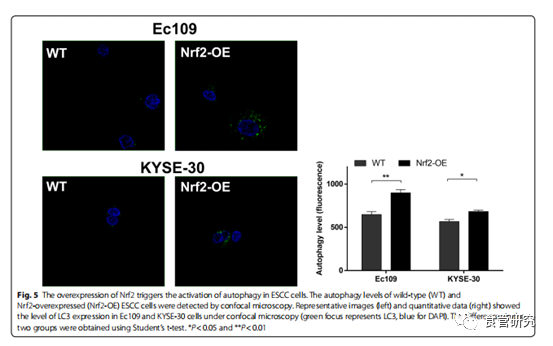
图5. Nrf2的过表达触发ESCC细胞中自噬的激活。通过共聚焦显微镜检测野生型(WT)和Nrf2过表达(Nrf2-OE)的ESCC细胞的自噬水平。代表性图像(左)和定量数据(右)显示了共聚焦显微镜下Ec109和KYSE-30细胞中LC3的表达水平(绿色代表LC3,蓝色代表DAPI)。两组之间的差异是使用t检验得出的。* P <0.05和** P <0.01。
翻译:孙玲云