据《Molecular Nutrition & Food Research》2020年3月报道题:短肽型肠内营养对于急性胰腺炎大鼠肠道微循环和黏膜屏障的作用(作者张剑、张匀等)
20世纪80年代,研究烧伤的学者发现,烧伤患者的创面尚无明显感染时,血液中已有肠道细菌,称之为肠源性感染。继而,进一步的研究发现,在组织缺血、缺氧时,肠黏膜的通透性增加,肠腔内的细菌、内毒素可穿过肠黏膜细胞的紧密连接或直接透过黏膜细胞进入至黏膜下层的淋巴管或门静脉微细血管,再进入到全身的淋巴系统或血循环,称之为细菌易位,这是肠源性感染或内源性感染的一个途径,也是危重症患者后期出现继发性感染的一个源泉。
继“细菌易位”这一现象被发现后,进一步的研究证实肠道有屏障功能,是由“黏膜屏障”、“免疫屏障”和“生物屏障”三部分组成。“怎样预防内源性感染”、“怎样维护肠黏膜屏障”就成为临床治疗,特别是危重症患者治疗处理中的一个重点。
肠黏膜细胞70%的营养物质来自于肠腔内,需与食糜直接接触,方能增殖、修复。肠黏膜细胞对蛋白质的摄取,大部分是以二肽或者三肽的形式,少部分是以氨基酸单体的形式。因此,整蛋白需要在肠腔内分解为二肽、三肽和氨基酸,才能被肠黏膜细胞摄取。
既往已有研究证实短肽具有加强上皮细胞屏障、提高粘液和抗菌蛋白产生、促进粘膜下层免疫细胞分化等作用。由于危重症患者的肠道功能障碍,胰蛋白酶分泌减少,对整蛋白的消化能力下降,给予短肽型肠内营养制剂,跳过了整蛋白分解为短肽和氨基酸这一步骤,能够为肠黏膜细胞提供充分的营养底物,有利于恢复肠道屏障功能,减少肠道菌群易位及肠源性感染的风险。但是,尚缺少短肽减少菌群异位的直接证据。
基于以上背景,浙江大学医学院附属第一医院肝胆胰外科、浙江省胰腺病研究重点实验室研究团队,利用生物荧光标记的柠檬酸杆菌示踪技术 , 在急性重症胰腺炎动物模型上,获得了短肽减少菌群异位的直接证据。2020年1月21日,这项最新研究成果5发表于《分子营养食品研究》(Molecular Nutrition Food Research,IF 4.653)。
重症急性胰腺炎(Severe Acute Pancreatitis,SAP)在临床上是一个棘手的疾病,其死亡率高达39%,主要死因则是继发于胰腺及胰周感染引起的脓毒症和多器官功能衰竭。传统治疗SAP的主要方法之一是让患者禁食,但是近年来越来越多的研究表明肠道在SAP进展中具有关键作用。一方面,SAP继发肠缺血/再灌注损伤所导致的肠黏膜屏障功能衰竭和细菌移位,是造成患者早期感染的第一步。另一方面,肠上皮需要肠内滋养才能维持其结构和功能,从而防止细菌肠外移位。因此,对于SAP患者,通过肠内营养来保护肠黏膜屏障并在早期维持肠道功能显得尤为重要。与基于完整蛋白的肠内营养(Intact-Protein based Enteral Nutrition,IPEN)相比,短肽型肠内营养制剂(Short-Peptide based Enteral Nutrition,SPEN)已在临床上被认为因更易被吸收而有效改善危重症患者的营养状况,同时能使腹泻、发热等症状得到一定程度的缓解,那么是否是因为SPEN具备维护肠屏障减少肠菌移位的作用而具有上述疗效呢?目前尚无研究报道。
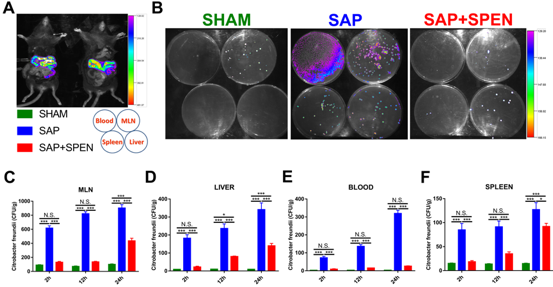
图1 SPEN能够减少SAP后肠道细菌肠外移位
(SHAM,对照组; SAP,整蛋白组; SAP+SPEN,短肽组; *p<0.05, **p<0.01, ***p<0.001, N.S.,无显著性差异.)
通过生物荧光标记的柠檬酸杆菌示踪技术,研究发现SPEN可以有效减少SAP后的肠道细菌向肠系膜淋巴结、门静脉血、肝脏和脾脏的肠外细菌移位,表明SPEN在缓解肠源性感染方面起着重要作用。进一步的机制研究发现,SPEN可显著减轻SAP对肠道的“打击”所造成的肠上皮电阻(Transepithelial Electrical Resistance,TEER)下降、肠道通透性增加、紧密连接蛋白ZO-1表达的下降以及肠黏液层剥落和杯状细胞激活等机械屏障的损伤。
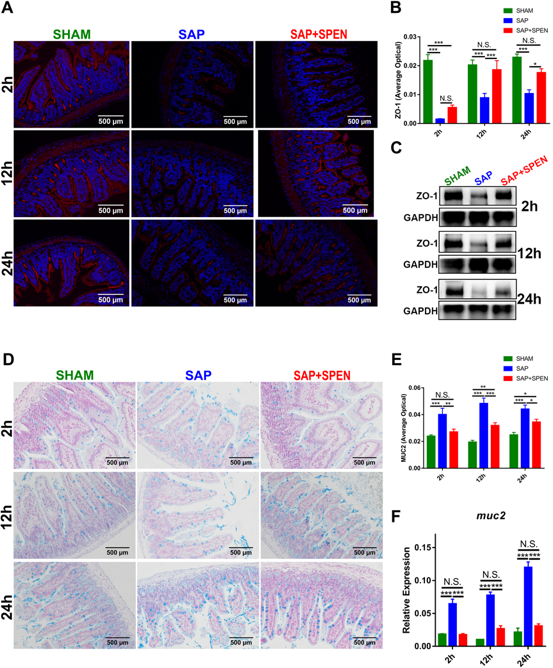
图2 SPEN能够缓解SAP后肠黏膜ZO-1表达的下降和肠道黏液层的破坏
此外,对肠道局部免疫状态的分析显示,SAP后肠道局部的趋化因子如CCR6、CCL20表达增加,诱导了肠黏膜固有层可极化局部免疫反应的CD11c+树突状细胞的聚集,而SPEN可有效减轻上述过程。虽然SPEN对SAP所造成的系统炎症因子如TNFα、IL-1β、IL-6的调节有限,但是通过对血液CD4+、CD8+、Th1、Th2、Treg细胞的流式分析,则揭示了SPEN可有效缓解SAP导致的系统免疫抑制。在对肠道肌层血流(Blood Flow in the Intestinal Lamina Muscularis,BFI)的检测中研究团队发现SPEN可改善SAP导致的肠黏膜微循环缺血,同时,微血管结构和内皮细胞缺氧诱导因子hif-1α、促血管生成因子angpt-1、angpt-2和vegf-β等表达的检测也证实了SPEN具有改善肠道血供及低氧状态的作用。
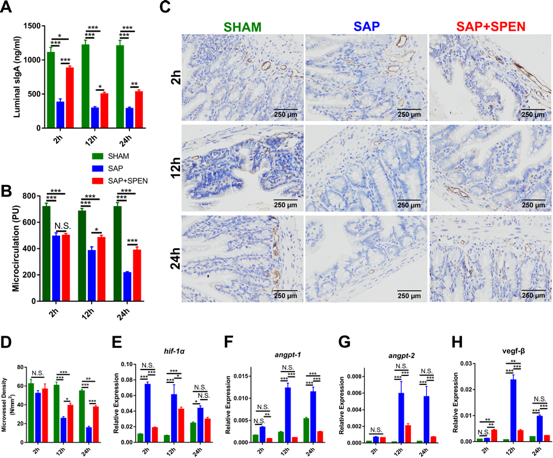
图3 SPEN能够明显改善SAP导致的肠道黏膜微循环障碍
在这项研究中,团队揭示了SPEN可通过改善SAP“打击”肠道所导致的肠道微循环障碍、肠黏膜机械屏障损伤、肠黏膜局部免疫失衡和系统免疫抑制,最终减少肠道菌群的肠外移位,表明SPEN因具备了对肠屏障功能的保护作用,从而阻止了胰腺单一器官的炎症进展为肠源性感染、sepsis甚至免疫抑制和多器官功能衰竭的进程。SPEN没有足够的能力改善胰腺局部和系统性炎症的情况(如胰腺的病理损伤、血清中淀粉酶增加和持续的TNF-α、IL-1β和IL-6等促炎介质),但是它减少了CCR6、CCL20趋化因子的表达、缓解肠黏膜CD11c+树突状细胞的浸润、改善肠道局部免疫抑制,从而维持肠道免疫稳态。另一方面,SAP后肠道肌层出现了以血流量减少和血管密度降低为表现的微循环障碍,进而导致肠道的病理形态学及屏障功能受损。由此肠道对病原菌的防御能力减弱,最终促使细菌向肠系膜淋巴结、门静脉血、肝脏、脾脏等肠外器官移位。SPEN则可有效改善肠道微循环及低氧状态,从而阻止上述肠屏障破坏所导致的恶性循环。
总之,SPEN一方面可有效提供SAP患者的营养需求,另一方面在改善肠黏膜微循环血供、维持肠道屏障功能、调节局部和全身免疫状态等方面具有重要的作用,最终有助于缓解SAP后肠道细菌移位和肠源性感染。目前仍然需要进一步的研究来证实SPEN作用于肠屏障的确切的分子机制,同时开展相关的临床前瞻性对照试验,尽早将本研究的初步成果转化为具有确切疗效的临床干预技术。
论文的第一作者为浙江大学医学院附属第一医院张剑博士,论文的通讯作者为浙江大学医学院附属第一医院梁廷波教授和张匀教授。项目获得了国家自然科学基金(81801640,81802359,81671893,81871545,81802334)的支持。



