







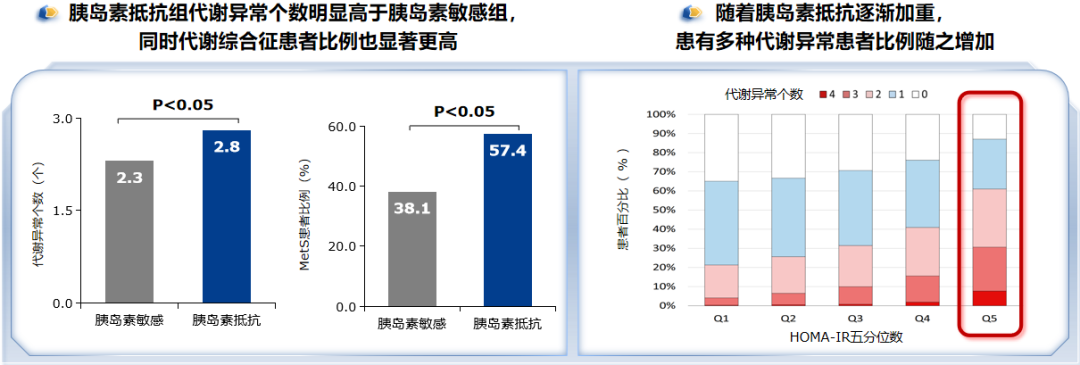
图2. 胰岛素抵抗与血糖、肥胖、血脂异常等多种代谢异常相关


三、降糖调脂,保肝护心——西格列他钠足量治疗改善胰岛素抵抗之中国方案

于淼教授做会议报告
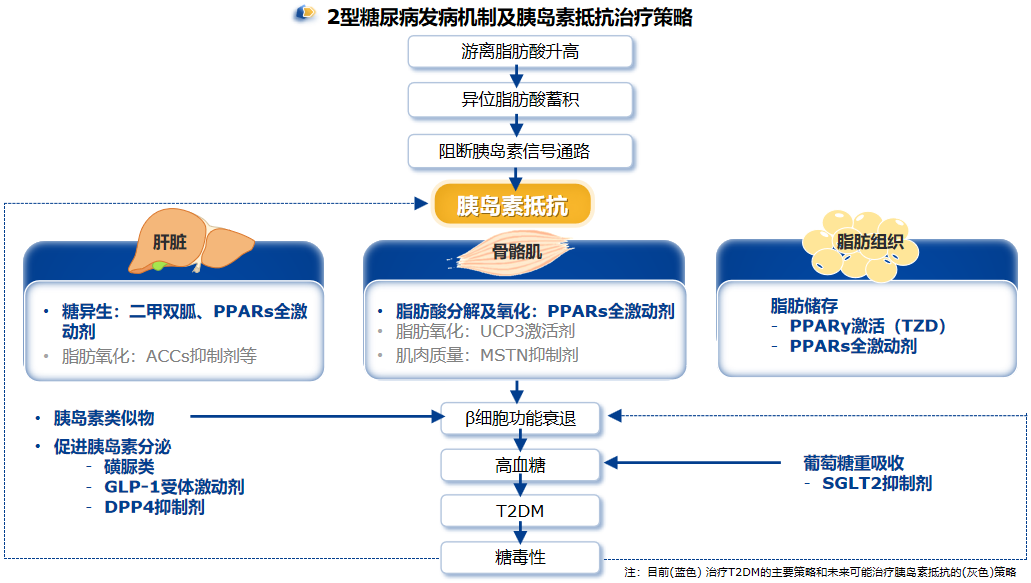
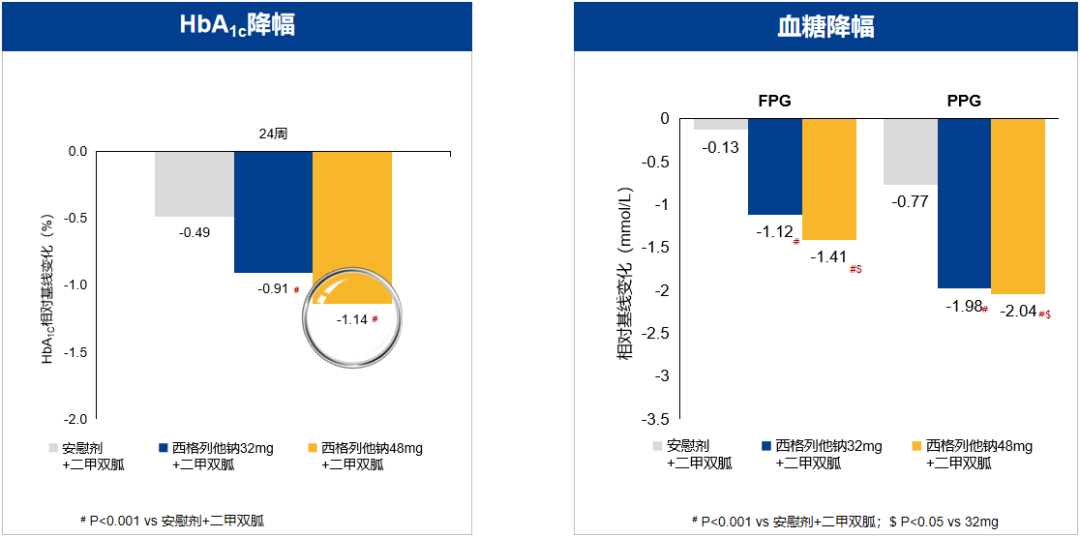
图4. 西格列他钠显著降低HbA1c以及空腹、餐后血糖,48 mg组降幅更大
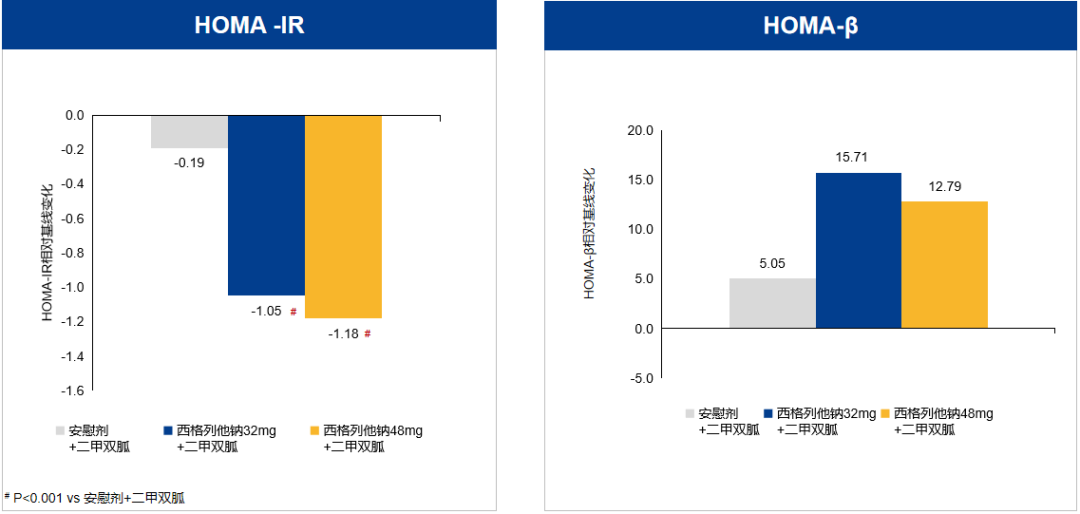
在调节血脂方面,西格列他钠48 mg组显著降低甘油三酯(TG)、极低密度脂蛋白胆固醇(VLDL-C)和游离脂肪酸(FFA)和升高高密度脂蛋白胆固醇(HDL-C)水平(图6)。此外,西格列他钠48 mg还明显降低丙氨酸转移酶和总胆红素水平,具有肝脏保护作用。
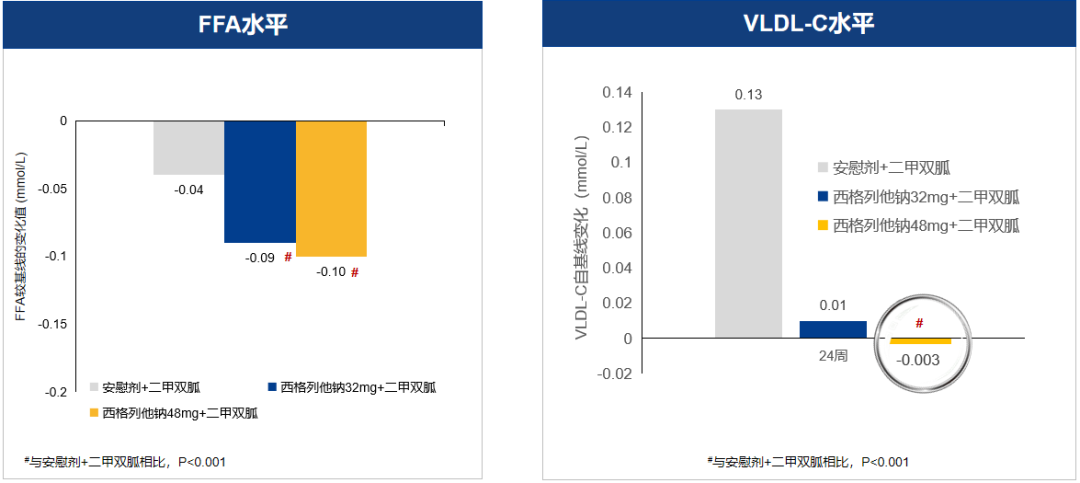
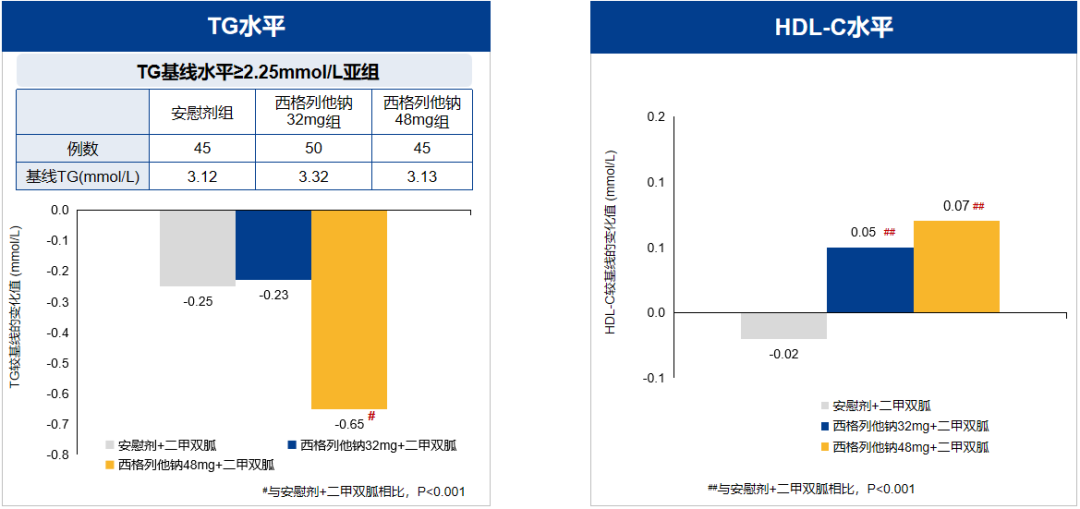
西格列他钠总体安全性良好,严重不良事件、心血管事件发生率均较低,且明显低于安慰剂组,其中48 mg组心血管事件数更少,提示西格列他钠具有良好的心血管安全性及潜在的脏器保护作用。此外,西格列他钠组水肿、体重增加的发生率很低,且均为轻中度。由此可见,西格列他钠48 mg除了带来更强效的降糖、全面调脂作用外,还可以保护肝脏和更优的心血管安全性,是联合二甲双胍的推荐剂量。


四、总结
胰岛素抵抗在中国T2DM人群中普遍存在,是驱动T2DM发生发展的关键因素,它不仅影响血糖控制,还与心血管疾病、微血管疾病和NAFLD等多种慢性代谢性疾病的发生及进展密切相关。因此,识别和干预胰岛素抵抗对于改善T2DM患者的预后至关重要。作为全球首个上市的PPAR全激动剂,西格列他钠联合二甲双胍显示出良好的临床疗效-安全性综合特征,西格列他钠48 mg与二甲双胍联用在改善胰岛素抵抗、降低HbA1c、调节血脂、肝脏保护、心血管保护等方面显示出综合获益趋势,且安全性较高,水肿、骨折、体重增加的发生率均低,对患者的长期管理具有重要意义。


参考文献
