Chidamide combined with a modified Bu-Cy conditioning regimen improves survival in patients with T-cell acute lymphoblastic leukemia/lymphoma undergoing allogeneic hematopoietic stem cell transplantation
译名:西达本胺联合mBuCy预处理方案改善接受异基因造血干细胞移植的T细胞急性淋巴细胞白血病/淋巴瘤患者的生存率
发表杂志:Annals of Hematology
发表时间:2024.06.20
DOI号:10.1007/s00277-024-05849-y
急性T淋巴母细胞性白血病/淋巴瘤(T-ALL/LBL)是一种罕见且具有挑战性的白血病亚型,高危患者对传统治疗预后较差。异基因造血干细胞移植(allo-HSCT)被认为是治疗T-ALL/LBL的有效方法之一,然而传统的强化预处理方案存在毒性和治疗效果不佳的问题。近日,一项研究探索了西达本胺联合改良的白消安-环磷酰胺(mBuCy)预处理方案对接受异基因造血干细胞移植T-ALL/LBL患者的生存率的影响,详细内容如下。
一、研究背景
在当前白血病治疗领域,T-ALL/LBL的治疗一直备受关注。Allo-HSCT作为一种潜在的治疗选择,被认为能够提供长期疗效,并在一定程度上克服传统治疗的局限。然而,移植后复发率仍高达30%至50%,是患者高死亡率的主要原因。研究人员尝试多种治疗策略以提高T-ALL/LBL患者的治疗效果并降低复发风险;改良的白消安-环磷酰胺(mBuCy)方案是国内最常见的清髓预处理方案,但是此方案应用于T-ALL/LBL患者时面临难以清除MRD以及复发率高的现状。
西达本胺作为口服亚型选择性组蛋白去乙酰化酶抑制剂(HDACi)在T淋巴细胞恶性肿瘤患者中显示出良好的疗效和安全性,西达本胺在T-ALL/LBL预处理方案中的具体作用尚未得到充分探索。其抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡的抗肿瘤活性及协同效应提示其在T-ALL/LBL患者Allo-HSCT预处理方案的可能性。
因此,本研究回顾性分析了使用西达本胺联合mBuCy与mBuCy预处理方案后接受allo-HSCT的T-ALL/LBL患者的临床疗效和安全性,旨在探索新的治疗模式,为优化T-ALL/LBL的治疗提供新的思路。
二、研究目的
评估西达本胺联合mBuCy预处理方案对T-ALL/LBL患者allo-HSCT的疗效,包括无病生存率(LFS)、总生存率(OS)、累积复发率(CIR)和非复发死亡率(NRM),同时关注安全性和移植相关死亡率。
三、研究方法
回顾性分析2017年12月21日至2022年2月21日在苏州大学附属第一医院接受Allo-HSCT的T-ALL/LBL患者的临床资料。共纳入66例T-ALL/LBL患者,采用1:2比例进行倾向评分匹配(PSM),其中西达本胺联合mBuCy预处理方案组(Chi组;西达本胺15mg,在化疗前D-14,-12,-9,-7,-5口服)22例患者,仅接受mBuCy预处理方案组(CON组)44例患者,评估各组患者的治疗效果和安全性,包括2年CIR、LFS、OS、NRM等,利用单变量及多变量分析评估相关因素对患者预后的影响。
四、研究结果
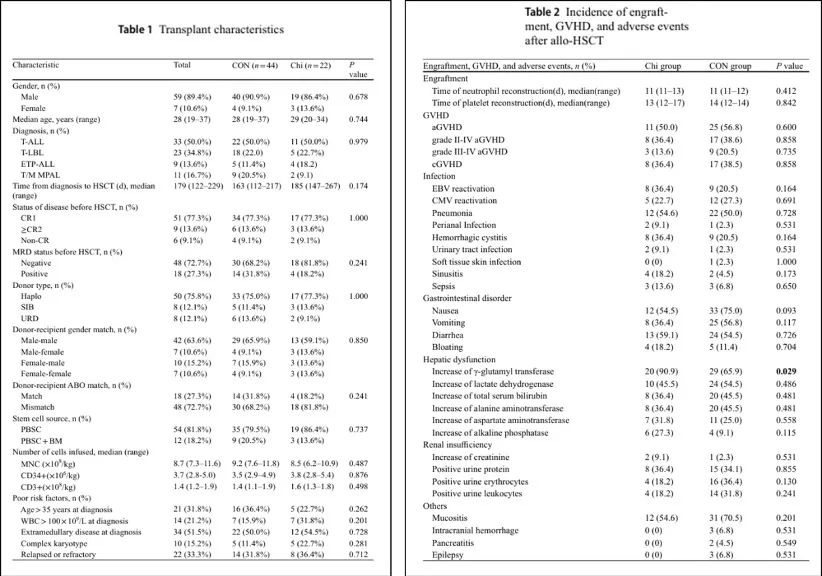
1. 患者特征和安全性数据
患者的特征见表1。移植时的中位年龄为28岁(范围19-37岁),66例患者中有59例(89.4%)为男性。从诊断到HSCT的中位时间为179天(范围122-229天)。两组患者的移植前特征相似(表1)。
所有患者均实现了造血重建,Chi组和CON组的中性粒细胞和血小板植入时间无显著差异。移植后100天内,Chi组和CON组的II-IV级和III-IV级急性移植物抗宿主病(aGVHD)以及2年慢性移植物抗宿主病(cGVHD)发生率均无显著差异。Chi组表现出与CON组一致的骨髓抑制,主要的非血液学不良事件为胃肠道反应,如腹泻和恶心,发生率相似。Chi组患者更易出现肝功能障碍,表现为γ-谷氨酰转移酶升高(90.9% vs. 65.9%,P=0.029)。Chi方案治疗的患者中,77.3%出现与治疗相关的感染,主要为肺炎,严重不良事件如脓毒症在Chi组和CON组中无显著差异(13.6% vs. 6.8%,P=0.650),且Chi组的所有感染均为革兰氏阴性菌感染。治疗期间,Chi组无治疗相关死亡报告(表2)。
表1 表2
2. OS和LFS数据
截止最后随访时,Chi组与CON组的中位随访时间分别为733天(范围368-1255天)和684天(范围246-1219天)。两组间的OS没有显著差异(Chi组80.5% vs. CON组60.4%,P = 0.088,图1a),且两组的中位OS均未达到。对于T-ALL患者,Chi组和CON组的2年OS相似(80.8% vs. 66.9%,P = 0.401,图1c)。对于早期前体T淋巴细胞白血病(ETP-ALL)和混合表型急性白血病(MPAL)患者,两组的OS也无显著差异(66.7% vs. 33.2%,P = 0.511,图1e)。尽管未达到统计学显著性,Chi组在HSCT前MRD阳性的患者在2年OS方面表现出优势(75.0% vs. 11.4%,P = 0.060,图1g)。
在LFS方面,Chi组的2年LFS显著优于CON组(76.1% vs. 45.3%,P = 0.014,图1b)。对于T-ALL患者,Chi组和CON组的2年LFS相似(80.8% vs. 59.5%,P = 0.094,图1d),而对于ETP-ALL或T/M MPAL患者,两组间未发现显著差异(66.7% vs. 17.3%,P = 0.207,图1f)。在移植前MRD阳性的患者亚组中,Chi组表现出更好的2年LFS(75.0% vs. 10.2%,P = 0.047,图1h)。
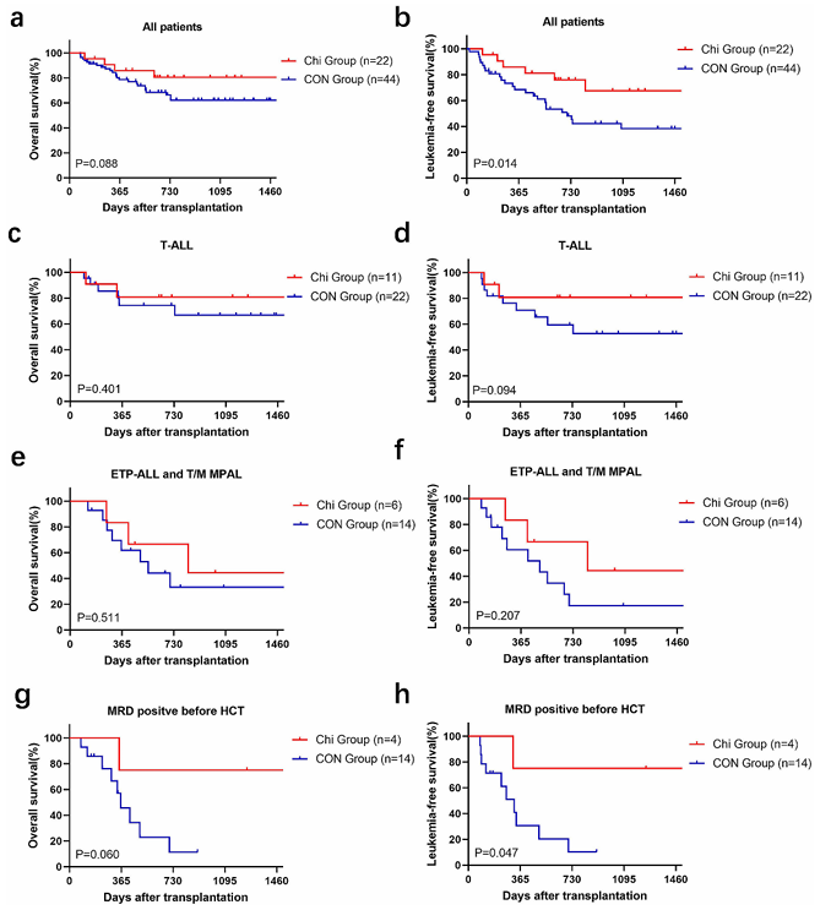
图1. OS和LFS的Kaplan-Meier曲线
3. CIR和NRM数据
在最后随访时,Chi组有5例患者和CON组有20例患者在移植后复发。两组从移植到复发的中位时间分别为255天和266天。Chi组的2年CIR显著低于CON组(19.0% vs. 41.4%,P = 0.030,图2a)。此外,Chi组和CON组的NRM相似(5.5% vs. 21.1%,P = 0.108,图2b)。
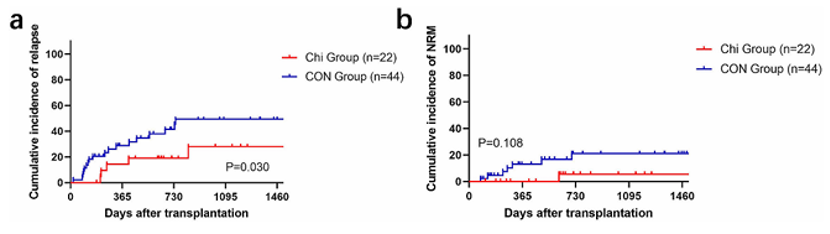
图2. Chi组和CON组的CIR和NRM结果
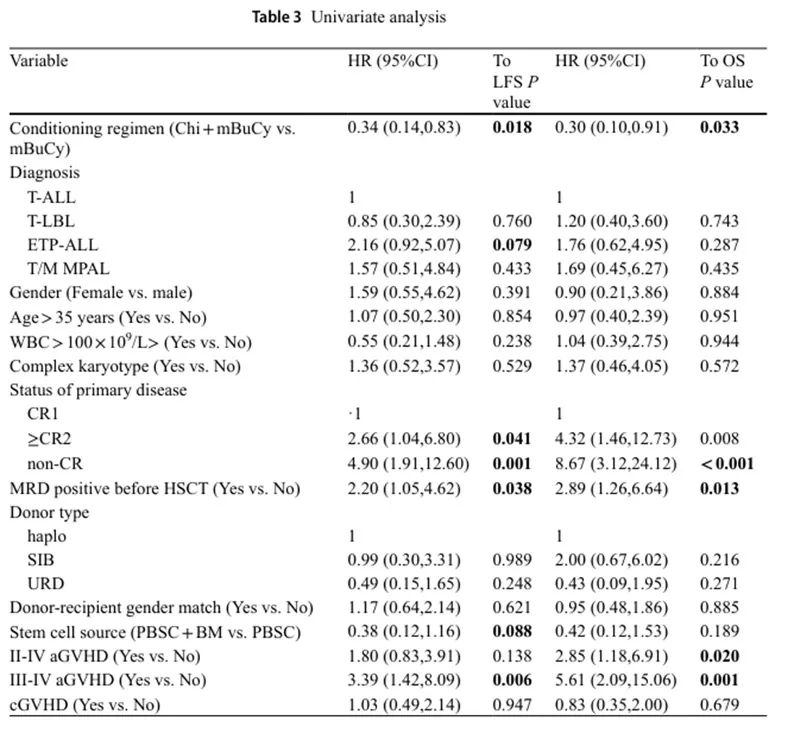
4. 单变量分析数据
在单变量分析中,影响OS和LFS的因素包括西达本胺联合mBuCy治疗、骨髓干细胞与外周血干细胞联合(PBSC + BM)作为干细胞来源、III-IV级aGVHD、移植前MRD阳性以及原发病非完全缓解状态(表3)。
表3
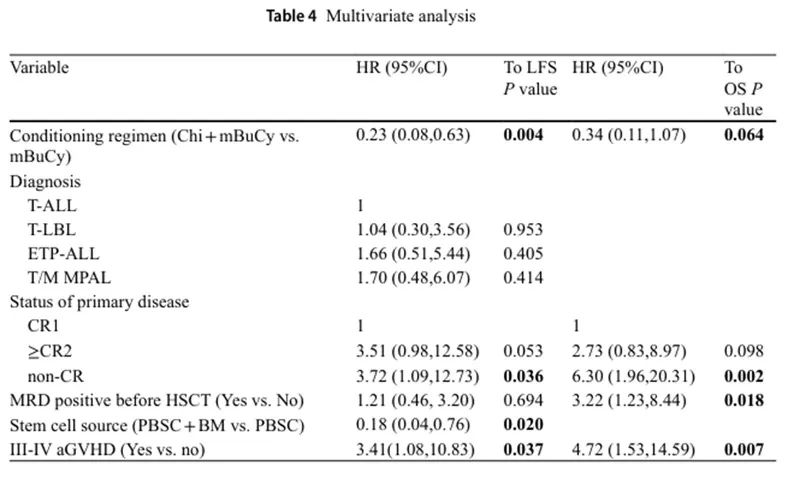
5. 多变量分析数据
在多变量分析中,西达本胺联合mBuCy与所有患者的OS无显著相关性(HR 0.34, 95%CI, 0.11-1.07; P = 0.064),但与较高的LFS显著相关(HR 0.23;95%CI,0.08–0.63;P = 0.004)。PBSC + BM作为干细胞来源也与较高的LFS显著相关(HR 0.18,95%CI,0.04–0.76;P = 0.020)。III-IV级aGVHD(HR 4.72, 95%CI, 1.53-14.59; P = 0.007)、HSCT前MRD阳性(HR 3.22, 95%CI, 1.23-8.44; P = 0.018)和原发病非完全缓解状态(HR 6.30, 95%CI, 1.96-20.31; P = 0.002)则与较低的OS相关。此外,III-IV级aGVHD(HR 3.41,95%CI,1.08–10.83;P = 0.037)和原发病非完全缓解状态(HR 3.72,95%CI,1.09–12.73;P = 0.036)也与较低的LFS显著相关。
表4
五、结论
本项研究中,西达本胺联合mBuCy方案在T-ALL/LBL患者进行allo-HSCT中展现出显著的临床优势。Chi组患者的2年CIR降低至19.0%(对照组为41.4%),2年LFS提高至76.1%(对照组为48.1%)。在移植前MRD阳性患者中,Chi组的2年LFS达到75.0%(对照组为10.2%)。尽管两组的2年OS差异不显著,但西达本胺方案在提升LFS方面表现出独立且显著的效果。总体而言,西达本胺联合mBuCy方案展现出良好的疗效和安全性,为T-ALL/LBL患者带来了新的治疗希望,进一步研究和验证将有助于推广和优化该方案,为患者提供更好的治疗效果和生存机会。
通讯作者点评
T-ALL/LBL作为一种罕见且具有挑战性的白血病亚型,其治疗一直备受关注。传统治疗方法效果有限,很多患者反应不佳,预后较差。Allo-HSCT虽被视为一种有效治疗方法,但传统的预处理方案存在毒性和治疗效果不佳的问题。为了应对这些挑战,我们的研究团队开始探索新的治疗策略,以提高治疗效果并降低复发风险。
通过回顾性分析,我们研究了西达本胺联合改良的mBuCy预处理方案与单独mBuCy预处理方案后进行allo-HSCT的T-ALL/LBL患者的临床疗效和安全性。研究结果显示,西达本胺联合mBuCy方案在T-ALL/LBL患者的allo-HSCT中显现出显著的临床优势,能够显著降低患者的2年CIR,并提高2年LFS。特别是在移植前MRD阳性的患者中,西达本胺方案的优势更为显著。尽管两组患者的OS差异不显著,但西达本胺方案在提升LFS方面表现出独立且显著的效果,为患者带来了新的治疗希望。同时,该方案的安全性也得到了验证,主要不良事件与对照组相似,未出现治疗相关的死亡报告。
总体而言,西达本胺联合mBuCy方案展现出良好的疗效和安全性,有望为患者提供更好的治疗效果和生存机会。未来,进一步的研究和验证将有助于推广和优化该方案,以期在临床中获得更广泛的应用。我们对这项研究结果深感振奋,这不仅为T-ALL/LBL患者带来了更佳的治疗选择,也为优化T-ALL/LBL的治疗提供了新的思路和方法。期待未来能够进一步深入探索,以造福更多患者。
专家简介
唐晓文 教授
苏州大学附属第一医院
参考文献:
Cao, X., Li, Z., Zhang, Y., Cui, Q., Dai, H., Ma, Y., Li, M., Chen, S., Yin, J., Cui, W., Chen, J., Sun, A., Qiu, H., Chen, S., Zhu, X., Andersson, B. S., Wu, D., & Tang, X. (2024). Chidamide combined with a modified Bu-Cy conditioning regimen improves survival in patients with T-cell acute lymphoblastic leukemia/lymphoma undergoing allogeneic hematopoietic stem cell transplantation. Annals of hematology, 10.1007/s00277-024-05849-y. Advance online publication.